Therapie inoperabler Magenkarzinome: Was ist neu im Jahr 2023?
Autorin:
ap. Prof. Priv.-Doz. Dr. Aysegül Ilhan-Mutlu
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin I
Medizinische Universität Wien
E-Mail: aysegul.ilhan@meduniwien.ac.at
Anfang 2023 wurden die Ergebnisse zweier großer Phase-III-Studien (SPOTLIGHT und GLOW) veröffentlicht, die seit Jahren mit Spannung erwartet werden. Es scheint, dass diese den Standard der Behandlung des gastroösophagealen Karzinoms verändern werden. Diese und viele andere neue Daten wurden beim diesjährigen OeGHO-Kongress in Innsbruck vorgestellt und diskutiert.
Keypoints
Zwei internationale, randomisierte, prospektive Phase-III-Studien (SPOTLIGHT und GLOW) zeigen, dass das Targeting von CLDN18.2 mit Zolbetuximab in Kombination mit mFOLFOX6 oder CAPOX das PFS und OS in der Erstlinienbehandlung von Patient*innen mit CLDN18.2-positivem/HER2-negativem inoperablem oder metastasiertem G/GEJC signifikant verlängert. Diese Behandlungskombinationen haben also ein starkes Potenzial, eine neue Standard-Behandlungsoption für diese Patient*innenpopulation festzulegen.
Nach drei Jahren Nachbeobachtung zeigte Nivolumab + Chemotherapie weiterhin einen klinisch bedeutsamen langfristigen Überlebensvorteil mit einem akzeptablen Sicherheitsprofil, was die Verwendung als Erstlinien-Standardbehandlung bei zuvor unbehandelten Patient*innen mit fortgeschrittenem gastroösophagealem Adenokarzinom mit PD-L1 CPS ≥5 weiter unterstützt.
Erste Daten aus den Studien RATIONALE-305 und KEYNOTE-859 zeigen, dass die Kombinationen von Tislelizumab mit Chemotherapie bzw. Pembrolizumab plus Chemotherapie neue Optionen für Patient*innen mit metastasierten gastroösophagealen Tumoren sein könnten. Es sind jedoch weitere Daten erforderlich, insbesondere Biomarkeranalysen, um den Nutzen dieser Substanzen in der klinischen Routine zu verstehen.
Studien SPOTLIGHT und GLOW
Trastuzumab ist die erste und bisher die einzige zielgerichtete Therapieoption für die Erstlinienbehandlung des metastasierten gastroösophagealen Adenokarzinoms. Claudin 18.2 (CLDN18.2) präsentierte sich als vielversprechender Biomarker, der in normaler und maligner Magenschleimhaut exprimiert wird. Frühere Phase-I- und Phase-II-Studien zeigten eine vielversprechende Anti-Tumor-Aktivität des CLDN18.2-Inhibitors Zolbetuximab bei Patient*innen mit metastasierten gastroösophagealen Tumoren. Daher wurden zwei weitere Phase-III-Studien durchgeführt, um die CLDN18.2-Inhibierung in größeren Kohorten zu untersuchen.
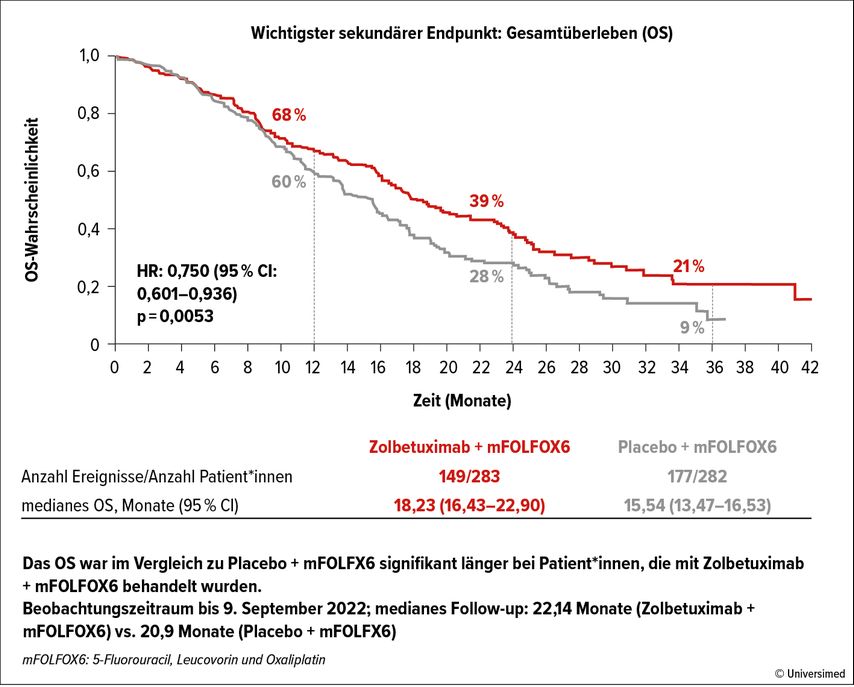
Die SPOTLIGHT-Studie untersuchte Patient*innen mit CLDN18.2-positivem/HER2-negativem, inoperablem oder metastasiertem G/GEJC („gastric und gastroesophageal junction adenocarcinoma“). CLDN18.2-Positivität war definiert als mäßige bis starke membranöse CLDN18-Färbung in ≥75% der Tumorzellen gemäß Immunhistochemie (IHC).
Der primäre Endpunkt war progressionsfreies Überleben (PFS). Zu den sekundären Endpunkten gehörten Gesamtüberleben (OS), Gesamtansprechrate (ORR) und Sicherheit. Die Patient*innen wurden 1:1 zu Zolbetuximab + mFOLFOX6 (n=283) oder Placebo + mFOLFOX6 (n=282) randomisiert. Das PFS wurde mit Zolbetuximab + mFOLFOX6 statistisch signifikant verlängert (median 10,61 vs. 8,67 Monate; HR: 0,751; p=0,0066). Das OS wurde ebenfalls signifikant verlängert (median 18,23 vs. 15,54 Monate; HR: 0,750; p=0,0053; Abb.1). Die ORR war zwischen den Behandlungsarmen ähnlich.
Die häufigsten Nebenwirkungen unter Zolbetuximab + mFOLFOX6 waren Übelkeit, Erbrechen und verminderter Appetit.
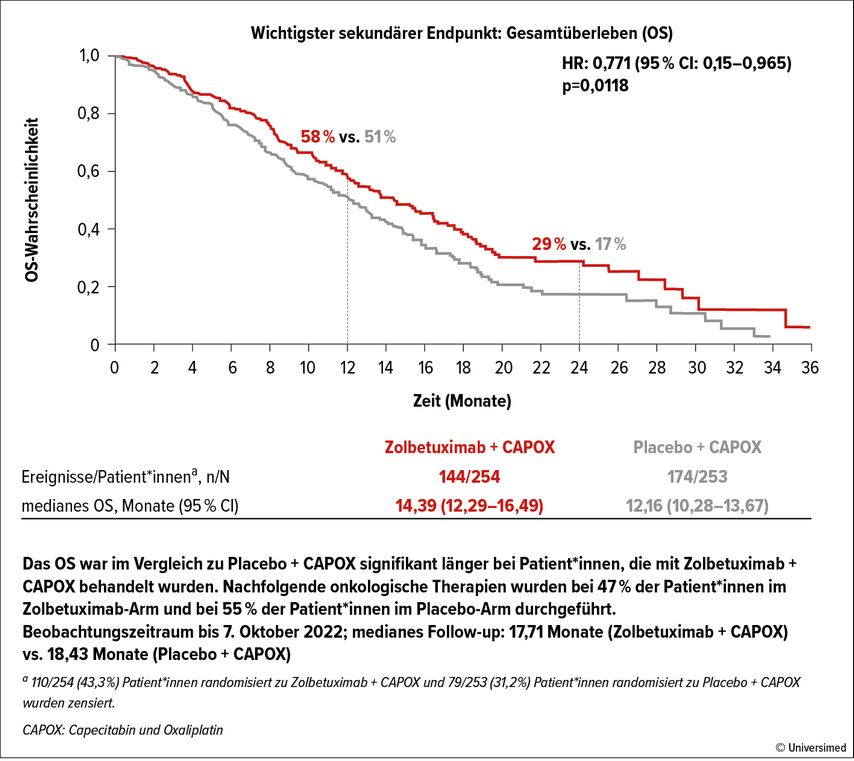
Parallel zur SPOTLIGHT-Studie untersuchte die GLOW-Studie eine ähnliche Population, verwendete jedoch eine andere Chemotherapie-Basis, nämlich CAPOX (die Kombination von Oxaliplatin + Capecitabin). Die Patient*innen wurden auf Zolbetuximab + CAPOX vs. Placebo + CAPOX randomisiert. Sowohl das PFS (median 8,21 vs. 6,80 Monate; HR: 0,687; p=0,0007) als auch das OS (median 14,39 vs. 12,16 Monate; HR: 0,771; p=0,0118; Abb. 2) waren mit Zolbetuximab signifikant verlängert, auch hier war die ORR nicht statistisch signifikant. Das Toxizitätsprofil war dem ähnlich, das in der SPOTLIGHT-Studie beobachtet wurde.
Zusammenfassend zeigen zwei internationale, randomisierte, prospektive Phase-III-Studien, dass das Targeting von CLDN18.2 mit Zolbetuximab in Kombination mit mFOLFOX6 oder CAPOX das PFS und OS in der Erstlinienbehandlung von Patient*innen mit CLDN18.2-positivem/HER2-negativem inoperablem oder metastasiertem G/GEJC signifikant verlängert. Diese Behandlungskombinationen haben also ein großes Potenzial, einen neuen Standard für diese Patient*innenpopulation festzulegen.
36-Monats-Follow-up der CheckMate-649-Studie
Die Kombination Nivolumab + Chemotherapie zeigte ein längeres OS und PFS gegenüber Chemotherapie und ein akzeptables Sicherheitsprofil als Erstlinienbehandlung bei Patient*innen mit fortgeschrittenen Magentumoren, Tumoren des gastroösophagealen Übergangs und Ösophagustumoren, was zu einer Zulassung durch die Europäische Arzneimittelagentur (EMA) für Patient*innen mit „PD-L1 combined positive score“ (CPS) ≥5 führte.
Wirksamkeits- und Sicherheitsanalysen von Nivolumab + Chemotherapie vs. Chemotherapie aus der dreijährigen Nachbeobachtung der CheckMate-649-Studie wurden auf dem ASCO-GI-Kongress demonstriert. In diesem Bericht zeigte die Kombination Nivolumab + Chemotherapie bei Patient*innen mit PD-L1 CPS ≥5 weiterhin OS- und PFS-Vorteile gegenüber Chemotherapie. Die ORR bei Patient*innen mit PD-L1 CPS ≥5 betrug 60% (95% CI: 55–65) mit Nivolumab + Chemotherapie vs. 45% (95% CI: 40–50) mit Chemotherapie allein. Ein OS-Vorteil mit Nivolumab + Chemotherapie wurde in den meisten vordefinierten Untergruppen beobachtet. Es wurden keine neuen Sicherheitssignale identifiziert.
Nach drei Jahren Nachbeobachtung zeigte die Kombination Nivolumab + Chemotherapie weiterhin einen klinisch bedeutsamen langfristigen Überlebensvorteil mit einem akzeptablen Sicherheitsprofil, was die Verwendung als Erstlinien-Standardbehandlung bei zuvor unbehandelten Patient*innen mit fortgeschrittenem gastroösophagealem Adenokarzinom mit PD-L1 CPS ≥5 weiter unterstützt.
Die RATIONALE-305-Studie
RATIONALE-305 war eine globale, doppeltverblindete Phase-III-Studie, in der die Kombination Tislelizumab + Chemotherapie als Erstlinientherapie bei Patient*innen mit Adenokarzinom des G/GEJC untersucht wurde. Die Ergebnisse der Zwischenanalyse in der PD-L1-positiven Population wurden auf dem ASCO-GI-Meeting präsentiert. PD-L1-Positivität wurde definiert als PD-L1-TAP-Score („tissue area positivity“) ≥5% (VENTANA SP263 Assay). Von 546 PD-L1-positiven Patient*innen (73,8% Asien; 26,2% Europa/Nordamerika) erhielten 274 Tislelizumab + Chemotherapie und 272 Placebo + Chemotherapie. Tislelizumab + Chemotherapie zeigte eine statistisch signifikante und klinisch bedeutsame OS-Verlängerung gegenüber Placebo + Chemotherapie (HR: 0,74 [95% CI: 0,59–0,94], medianes OS 17,2 vs. 12,6 Monate; 1-seitig p=0,0056) bei TAP ≥5 Patient*innen. Es wurden keine neuen Sicherheitssignale beobachtet.
Die Kombination Tislelizumab + Chemotherapie führte als Erstlinientherapie zu einer signifikanten und klinisch bedeutsamen Verlängerung des OS bei PD-L1+-Patient*innen mit fortgeschrittenem G/GEJC. Diese Daten deuten darauf hin, dass diese Kombination eine neue Option für die Erstlinienbehandlung bei diesen Patient*innen sein könnte. Obwohl die Studie 26% nichtasiatische Patient*innen umfasste und daher das Potenzial für eine Zulassung in nichtasiatischen Ländern hat, zeigte eine initiale Subgruppenanalyse einen geringeren Nutzen der Behandlung für nichtasiatische Patient*innen. Weitere Daten werden erwartet.
Ein zusätzlicher Punkt ist die Bewertung des PD-L1-Scores. Die Studie verwendete eine neue Bewertung der PD-L1-Färbung, die sich von der bisher verwendeten Bewertung unterscheidet. Zukünftige Forschungsarbeiten werden die Durchführbarkeit dieses Scores in der klinischen Routine und seine Überschneidung mit den bereits bestehenden PD-L1-Scores bei gastroösophagealen Tumorerkrankungen zeigen.
Die KEYNOTE-859-Studie
KEYNOTE-859 war eine doppelverblindete, placebokontrollierte Phase-III-Studie zu Pembrolizumab + Chemotherapie vs. Chemotherapie + Placebo bei fortgeschrittenem HER2-negativem G/GEJC (n=1579). Zwischenanalysen wurden bei der ESMO-Virtual Plenary präsentiert.
Das mediane OS betrug 12,9 Monate mit Pembrolizumab + Chemotherapie gegenüber 11,5 Monaten mit Placebo + Chemotherapie (HR: 0,78; 95% CI: 0,70–0,87; p<0,0001). Das mediane PFS betrug 6,9 Monate vs. 5,6 Monate (HR: 0,76, 95% CI: 0,67–0,85; p<0,0001). Die ORR betrug 51,3% gegenüber 42,0% (p= 0,00009). Es gab keine neuen Sicherheitssignale.
Pembrolizumab in Kombination mit einer überwiegend auf Oxaliplatin basierenden Chemotherapie scheint bei Patient*innen mit gastroösophagealem Karzinom einen Überlebensvorteil zu zeigen, im Gegensatz zu den Ergebnissen der KEYNOTE-062-Studie, in der Pembrolizumab mit einer ausschließlich auf Cisplatin basierenden Chemotherapie kombiniert wurde. Allerdings scheint das Ausmaß des Nutzens von Pembrolizumab in der gesamten Patient*innenpopulation bescheiden zu sein. Weitere Subgruppenanalysen basierend auf der PD-L1-CPS-Positivität werden benötigt, um Pembrolizumab in die tägliche Routine zu integrieren.
Literatur:
bei der Verfasserin