MRD als prognostischer Parameter
Bericht:
Dr. Ine Schmale
Die minimale Resterkrankung (MRD) ist für bestimmte Therapieregime ein hoch prognostischer Surrogatparameter für das Ansprechen bei Patienten mit CLL. In einem Satellitensymposium diskutierten Experten im Rahmen der Jahrestagung der European Hematology Association (EHA) über den heutigen und zukünftigen Stellenwert der MRD-Messung im klinischen Alltag.
Das Erreichen eines Ansprechens, insbesondere die komplette Remission, ist bei CLL-Patienten unter Chemotherapie oder Chemoimmuntherapie mit einem verlängerten progressionsfreien Überleben (PFS) und Gesamtüberleben (OS) assoziiert.1 Allerdings kann eine leichte residuale Lymphadenopathie oder Splenomegalie im CT auch von verbleibenden Gewebenarben hervorgerufen werden. Die MRD-Messung mit einer Messtiefe von 10–4 am Ende der Therapie scheint eine verlässlichere Methode zu sein. Bei Erreichen einer MRD-Negativität wurde ein gleich gutes Ergebnis für Patienten mit kompletter oder partieller Remission beobachtet.2 In verschiedenen Studien konnte der unabhängige prognostische Wert des MRD-Status bei Chemo- und Chemoimmuntherapien in der Frontline-Behandlung wie auch in der rezidivierten oder refraktären Situation bestätigt werden, erklärte Othman Al-Sawaf (Deutschland).3
MRD bei zielgerichteter Therapie
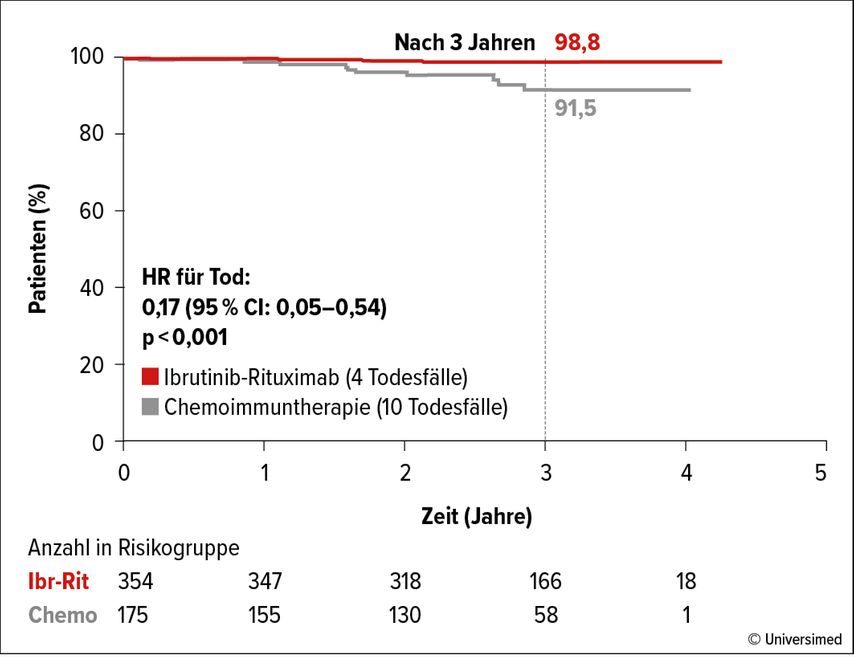
Bei Patienten unter zielgerichteter Therapie, beispielsweise mit dem Bruton-Tyrosinkinase(BTK)-Inhibitor Ibrutinib, wurde ein MRD-Ansprechen nur bei einem geringen Anteil der Patienten erreicht.4 Der Therapieerfolg war allerdings für Patienten mit nicht detektierbarer MRD nicht besser als für Patienten mit detektierbarer MRD.5 Offensichtlich lägen also verschiedene Wirkprinzipien vor, bemerkte Andy C. Rawstron (Großbritannien). In der ECOG1912-Studie wurde bei fitten, therapienaiven Patienten beobachtet, dass 6 Zyklen des FCR-Regimes (Fludarabin, Chlorambucil, Rituximab) bei 57% der Patienten eine MRD-Negativität induzierten versus 5% bei einjähriger Behandlung mit Ibrutinib plus Rituximab.4 Nichtsdestotrotz waren das PFS und das OS signifikant länger unter der Ibrutinib-haltigen verglichen mit der Chemoimmuntherapie (Abb. 1). Die Krankheitsmodulation ohne MRD-Negativität wurde auch für andere BTK-Inhibitoren gezeigt, nicht aber für die zielgerichtete Therapie mit einem BCL2-Inhibitor.
Stellenwert des MRD-Status
Da der MRD-Status eine prognostische Aussage für diverse Therapieregime bei CLL-Patienten zulässt, kann eine Messung zur Abschätzung der Prognose am Ende der Therapie durchgeführt werden. Auf die Verwendung der MRD-Messung zur Weiterführung einer Therapie wurden Hinweise bisher nur aus retrospektiven Analysen gezogen. So zeigte sich ein vergleichbares PFS bei Patienten mit nicht detektierbarer MRD nach 3 oder 6 Zyklen unter dem FCR-Regime.6 Die MRD-geführte Therapie eigne sich aufgrund der schwachen Evidenz derzeit noch nicht uneingeschränkt für den Gebrauch außerhalb von klinischen Studien, bemerkte Al-Sawaf.
Paolo Ghia (Italien) ergänzte mit Blick auf die Zukunft, dass auch der Effekt von genetischen Risikofaktoren auf den MRD-Status bisher nicht ausreichend geklärt sei. Es müsse zudem an genügend belastbaren Kriterien zum Beenden einer Therapie gearbeitet werden. Die Messmethode müsse möglicherweise von der Durchflusszytometrie zur NGS(Next-Generation-Sequencing“)-basierten Messung wechseln, da so tiefere Remissionen gemessen werden könnten, erklärte Ghia. Außerdem müsse das Vorgehen standardisiert werden.
Quelle:
XXX-Satelliten-Symposium „Minimal disease (MRD): the big question mark in chronic lymphocytic leukemia (CLL)?“, EHA2022 Hybrid Congress, 9. Juni 2022
Literatur:
1 Hallek M et al.: Blood 2018; 131: 2745-60 2 Kovacs G et al.: J Clin Oncol 2016; 34: 3758-65 3 Kwok M et al.: Blood 2016; 128: 2770-3 4 Shanafelt TD et al.: N Engl J Med 2019; 381: 432-43 5 Wang XV et al.: Blood 2021; 138: 2810-27 6 Strati P et al.: Blood 2014; 123: 3727-32
Fachkurzinformation
Bezeichnung des Arzneimittels: XXX 140 mg Hartkapseln. XXX 140/280/420/560 mg Filmtabletten. Qualitative und quantitative Zusammensetzung: Jede Hartkapsel enthält 140 mg Ibrutinib. Jede 140/280/420/560 mg Filmtablette enthält 140/280/420 bzw. 560 mg Ibrutinib. Sonstige Bestandteile: Croscarmellose-Natrium, hochdisperses Siliciumdioxid (alle Filmtabletten), Lactose-Monohydrat (alle Filmtabletten), Magnesiumstearat, Mikrokristalline Cellulose, Povidon (alle Filmtabletten), Natriumdodecylsulfat (E487), Gelatine (Hartkapseln), Macrogol (alle Filmtabletten), Poly(vinylalkohol) (alle Filmtabletten), Talkum (alle Filmtabletten), Titandioxid (E171), Schellack (Hartkapseln), Eisen(II,III)-oxid (E172, Hartkapseln, 140 mg, 280 mg u. 420 mg Filmtabletten), Propylenglycol (E1520, Hartkapseln), Eisen(III)-hydroxid-oxid x H2O (E172, 140 mg, 420 mg u. 560 mg Filmtabletten), Eisen(III)-hydroxid-oxid (E172, 280 mg u. 560 mg Filmtabletten).Anwendungsgebiete: XXX als Einzelsubstanz ist indiziert zur Behandlung erwachsener Patienten mit rezidiviertem oder refraktärem Mantelzell-Lymphom (MCL). XXX als Einzelsubstanz oder in Kombination mit Rituximab oder Obinutuzumab ist indiziert zur Behandlung erwachsener Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie (CLL) (siehe Abschnitt 5.1). XXX als Einzelsubstanz oder in Kombination mit Bendamustin und Rituximab (BR) ist indiziert zur Behandlung erwachsener Patienten mit CLL, die mindestens eine vorangehende Therapie erhalten haben. XXX als Einzelsubstanz ist indiziert zur Behandlung erwachsener Patienten mit Morbus Waldenström (MW), die mindestens eine vorangehende Therapie erhalten haben, oder zur Erstlinien-Therapie bei Patienten, die für eine Chemo-Immuntherapie nicht geeignet sind. XXX in Kombination mit Rituximab ist indiziert zur Behandlung erwachsener Patienten mit MW.Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Die Anwendung von Präparaten, die Johanniskraut enthalten, ist während der Therapie mit XXX kontraindiziert. Inhaber der Zulassung: XXX International NV, Turnhoutseweg 30, B-2340 Beerse, Belgien. Vertrieb für Österreich: XXX Pharma GmbH, Vorgartenstraße 206B, A-1020 Wien. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. ATC-Code: L01EL01. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit sowie Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation.
(AT_ CP-205827_v1.0_20Jan2021)
Entgeltliche Einschaltung
Mit freundlicher Unterstützung durch XXX Pharma GmbH