Krebsscreening bei Myositis
Bericht:
Mag. pharm. Irene Senn, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Idiopathische inflammatorische Myopathien (IIM) sind mit einem erhöhten Krebsrisiko assoziiert, insbesondere in den ersten Jahren nach der Diagnose. Eine neue Leitlinie der International Myositis Assessment and Clinical Studies Group (IMACS) bietet nun erstmals klare Handlungsempfehlungen basierend auf definierten Risikofaktoren. Prof. Hector Chinoy (Universität Manchester, UK) stellte anlässlich der Jahrestagung der ÖGR die neuen IMACS-Empfehlungen zum Krebsscreening bei Myositispatienten vor.
Das Verständnis der idiopathischen inflammatorischen Myopathien (IIM) hat sich in den letzten Jahren grundlegend gewandelt. An die Stelle der früheren vereinfachten Unterscheidung zwischen Polymyositis (PM) und Dermatomyositis (DM) ist ein differenzierteres Krankheitsspektrum getreten. Dieses umfasst neben PM und DM auch die Einschlusskörperchen-Myositis (IBM), die immunvermittelte nekrotisierende Myopathie (IMNM), die Überlappungsmyositis und das Antisynthetase-Syndrom.1 Jede dieser Entitäten weist charakteristische Antikörperprofile auf, wobei die verbesserte Risikoeinschätzung für Krebserkrankungen anhand definierter Biomarker einen der wichtigsten Fortschritte darstellt.
TIF1-gamma als Schlüsselmarker
Der Transcription Intermediary Factor 1 gamma (TIF1γ) hat sich als wegweisender Biomarker für die Einschätzung des Krebsrisikos etabliert. Targoff et al. beschrieben ihn erstmals als spezifischen Autoantikörper bei Myositis, einen nukleären Marker, der weder bei gesunden Individuen noch bei anderen Autoimmunerkrankungen nachweisbar ist.2 Etwa 20% der erwachsenen DM-Patienten und bis zu ein Drittel der Patienten mit juveniler DM weisen TIF1γ-Antikörper auf. Eine Metaanalyse bestätigte für die Detektion von Malignomen eine Sensitivität von 78% und eine Spezifität von 89%.3
Bemerkenswert ist dabei die ausgeprägte Altersabhängigkeit. „Studien aus unserem Zentrum haben gezeigt, dass kein Patient unter 40 Jahren mit TIF1γ-Antikörpern Krebs entwickelt hat“, betonte Chinoy. In der TIF1γ-positiven Kohorte lag das mediane Alter bei Erkrankungsbeginn bei jenen Patienten, die eine Krebserkrankung entwickelten, bei 62 Jahren – im Vergleich zu 44 Jahren bei Patienten ohne Malignom (p<0,05). Auch das Spektrum der Tumormanifestationen zeigte charakteristische Muster: Bei TIF1γ-positiven Patientinnen fanden sich gehäuft gynäkologische Tumoren – 90% der Ovarialkarzinome in der DM-Gruppe waren TIF1γ-positiv.4
Neues immunologisches Modell der Krebsentstehung
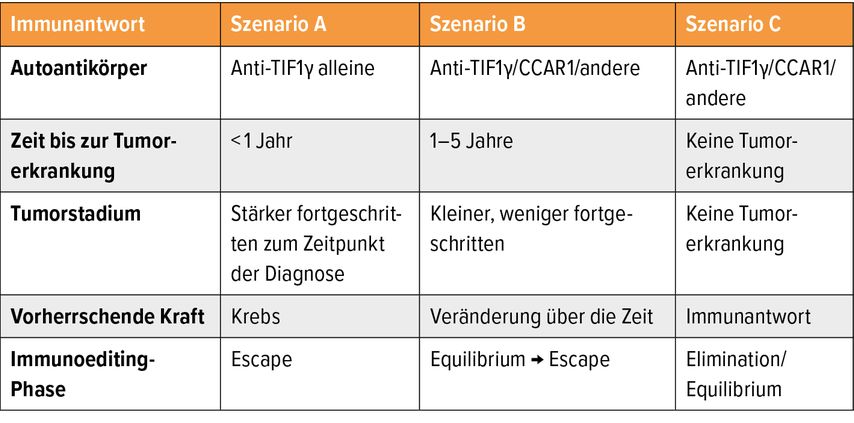
Forschungsteams der Johns-Hopkins-Universität und aus Stanford untersuchten DM-Patienten mit Anti-TIF1γ-Antikörpern und identifizierten zusätzliche Autoantikörper, insbesondere gegen CCAR1, die mit einem geringeren Krebsrisiko assoziiert waren.5 Diese Erkenntnisse führten zur Entwicklung eines dreistufigen Modells (siehe Tab. 1):
-
Szenario A: Bei alleiniger TIF1γ-Positivität entwickelt sich häufig rasch ein fortgeschrittener Tumor.
-
Szenario B: Zusätzliche Autoantikörper wie CCAR1 führen zu einer verzögerten Manifestation in früherem Stadium.
-
Szenario C: Die Kombination mehrerer Autoantikörper kann die Tumorentstehung vollständig verhindern.
Dabei korreliert die Vielfalt der Autoantikörper mit einem signifikant geringeren Krebsrisiko.
Systematische Analyse der Risikofaktoren
Basierend auf diesen Erkenntnissen wurde in der Arbeitsgruppe von Prof. Chinoy eine umfassende Metaanalyse von 69 Studien durchgeführt, die erstmals eine solide Evidenzbasis zur Identifikation der wichtigsten Risikofaktoren für Malignome bei Myositispatienten schuf.6 Als signifikante Risikofaktoren wurden identifiziert: Dermatomyositissubtyp (RR2,21), höheres Lebensalter (WMD11,19), männliches Geschlecht (RR1,53), Dysphagie (RR2,09), kutane Ulzerationen (RR2,73) und Anti-TIF1γ-Positivität (RR4,66). Im Gegensatz dazu waren folgende Faktoren mit einem signifikant niedrigeren Krebsrisiko assoziiert: Polymyositis (RR0,49), klinisch amyopathische Dermatomyositis (RR0,44), Raynaud-Phänomen (RR0,61), interstitielle Lungenerkrankung (RR0,49), Anti-Jo1-Positivität (RR0,45) und Anti-EJ-Positivität (RR0,17). Bemerkenswert war, dass erhöhte Laborwerte wie jene von Kreatinkinase und LDH mit einem niedrigeren Krebsrisiko einhergingen. Diese Ergebnisse bildeten die Grundlage für die Entwicklung der neuen IMACS-Leitlinie zum Krebsscreening.
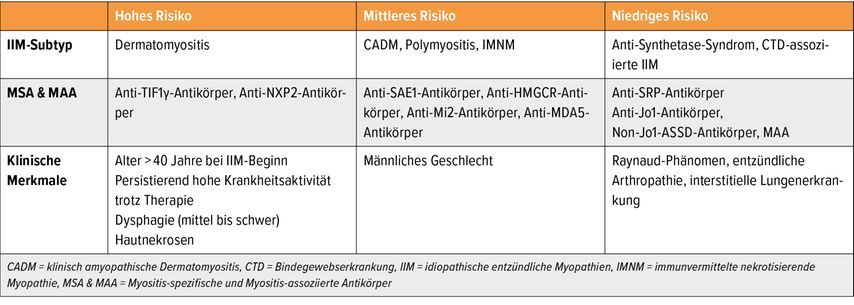
Neue Screening-Leitlinie zur Risikostratifizierung
Da Krebs die häufigste Todesursache bei erwachsenen Myositispatienten darstellt, ist eine frühzeitige Diagnose für die Prognoseverbesserung essenziell. Die IMACS-Leitlinie etabliert erstmals ein systematisches, risikoadaptiertes Screening-Protokoll, das auf einer dreigliedrigen Risikostratifizierung basiert (siehe Tab. 2).7
Je nach Risikogruppe werden unterschiedliche Screening-Protokolle empfohlen:
-
Hohes Risiko (≥2 Hochrisiko-Faktoren): Basis- und erweitertes Screening bei Diagnose, Follow-up nach 1, 2 und 3 Jahren, zusätzlich 18F-FDG-PET-CT
-
Mittleres Risiko: Basis- und erweitertes Screening bei Diagnose, kein systematisches Follow-up
-
Niedriges Risiko: Basisscreening bei Diagnose, kein systematisches Follow-up
Das Basisscreening umfasst eine ausführliche Anamnese, Blutuntersuchungen und eine konventionelle Thorax-Röntgenaufnahme. Das erweiterte Screening beinhaltet zusätzlich Untersuchungen wie CT, Mammografie, CA-125 und PSA-Bestimmung. Ein PET/CT wird gezielt bei Hochrisiko-Patienten empfohlen, insbesondere bei TIF1γ-Positivität in Kombination mit einem Alter >40 Jahre oder mindestens einem weiteren Hochrisiko-Faktor.
Bestätigung durch Real-World-Daten
Die praktische Anwendbarkeit der Leitlinie wurde schließlich in einer Kohorte von 290 Patienten validiert, berichtete Chinoy von seinen Forschungsarbeiten. Von den 17 diagnostizierten Krebsfällen entfielen 14 auf die Hochrisiko-Gruppe (n=123) und 3 auf die Gruppe mit mittlerem Risiko (n=116). In der Standardrisiko-Gruppe (n=51) wurde keine Krebserkrankung diagnostiziert.
Fazit
Die neue IMACS-Leitlinie bietet erstmals einen systematischen, evidenzbasierten Ansatz für das Krebsscreening bei IIM-Patienten. Die klare Risikostratifizierung ermöglicht ein individualisiertes und ressourceneffizientes Vorgehen. Folgende Aspekte sind für die klinische Praxis besonders relevant:
-
Die Bestimmung der Myositis-spezifischen Antikörper, insbesondere TIF1γ, bei DM-Diagnosestellung
-
Die Berücksichtigung des Alters bei Erkrankungsbeginn als wichtiger Risikofaktor
-
Die Durchführung eines intensivierten Screening-Protokolls mit regelmäßigen Verlaufskontrollen über drei Jahre bei Hochrisiko-Patienten
-
Der frühzeitige Einsatz der PET/CT-Bildgebung bei Hochrisiko-Patienten
Die validierten Screening-Algorithmen können dazu beitragen, assoziierte Malignome früher zu erkennen und damit die Prognose der betroffenen Patienten zu verbessern.
Quelle:
Jahrestagung der Österreichischen Gesellschaft für Rheumatologie & Rehabilitation (ÖGR), 28. – 30. November 2024, Wien
Literatur:
1 Khoo T et al.: Epidemiology of the idiopathic inflammatory myopathies. Nat Rev Rheumatol 2023; 19(11): 695-712 2 Targoff IN et al.: A novel autoantibody to a 155-kd protein is associated with dermatomyositis. Arthritis Rheum 2006; 54(11): 3682-9 3 Trallero-Araguás E et al.: Usefulness of anti-p155 autoantibody for diagnosing cancer-associated dermatomyositis: a systematic review and meta-analysis. Arthritis Rheum 2012; 64(2): 523-32 4 Oldroyd A et al.: The temporal relationship between cancer and adult onset anti-transcriptional intermediary factor 1 antibody-positive dermatomyositis. Rheumatology 2019; 58(4): 650-5 5 Fiorentino DF et al.: Immune responses to CCAR1 and other dermatomyositis autoantigens are associated with attenuated cancer emergence. J Clin Invest 2022; 132(2): e150201 6 Oldroyd AGS et al.: A systematic review and meta-analysis to inform cancer screening guidelines in idiopathic inflammatory myopathies. Rheumatology 2021; 60(6): 2615-28 7 Oldroyd AGS et al.: International Guideline for Idiopathic Inflammatory Myopathy-Associated Cancer Screening: an International Myositis Assessment and Clinical Studies Group (IMACS) initiative. Nat Rev Rheumatol 2023; 19(12): 805-17
Das könnte Sie auch interessieren:
Neue Therapieansätze für Arthrose
Dass Zellen altern, könnte eine entscheidende Rolle bei der Entstehung von Arthrose spielen. Welche Mechanismen dahinterstecken und welche Ansätze sich für neue Therapien ergeben, ...
Fertilität und Schwangerschaft bei entzündlicher Arthritis
Auf der 13. International Conference on Reproduction, Pregnancy and Rheumatic Diseases (RheumaPreg 2025) in Wien präsentierte Prof. Dr. Radboud Dolhain (Rotterdam, NL) aktuelle ...
Therapieauswahl nach pulmonalem Inflammations- und Fibrosemuster
Da Fibrose und Entzündung in unterschiedlichem Ausmaß zu Lungenbeteiligungen bei rheumatologischen Erkrankungen beitragen, werden im klinischen Alltag Methoden gebraucht, um beide ...