Viele Studien zeigen Fortschritt mit Verlängerung des Gesamtüberlebens
Bericht:
Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine Verlängerung des Überlebens ist für die meisten Krebspatient:innen das wichtigste Therapieziel. In diversen Studien konnten mit experimentellen Medikationen Fortschritte bezüglich dieses Patient:innenwunsches gezeigt werden. Bei dem ASCO Genitourinary Cancers Symposium (ASCO GU) wurden finale Auswertungen, Studien-Updates und Ergebnisse neuer Studien zu urologischen Entitäten präsentiert, von denen im Folgenden eine Auswahl angeführt wird.
Prostatakarzinom
Ergänzende Radiotherapie bei oligometastasierter Erkrankung
Die randomisierte Phase-II-Studie GROUQ-PCS 9 untersuchte eine Metastasen-gerichtete Therapie zusätzlich zum Therapiestandard Androgendeprivationstherapie (ADT) plus Enzalutamid als neue Erstlinien-Behandlungsoption bei mCRPC-Patient:innen mit einer bis fünf Metastasen.1 Insgesamt 100 Patient:innen erhielten entweder Enzalutamid plus ADT oder zusätzlich eine stereotaktische Radiotherapie (SBRT). Primärer Studienendpunkt war das radiologische progressionsfreie Überleben (rPFS). Im Median waren die Erkrankten 72 Jahre alt und wiesen im Wesentlichen Knochenmetastasen (75,0% bzw. 61,5%) oder Lymphknotenmetastasen auf (21% bzw. 32,5%).
Mit der zusätzlichen Bestrahlung konnte das Risiko für einen radiologischen Progress um 52% reduziert werden (HR: 0,48; 95% CI: 0,27–0,86; p=0,014). Das mediane rPFS lag bei 2,3 Jahren mit Enzalutamid plus ADT vs. 4,6 Jahre mit zusätzlicher SBRT. Einen PSA-Progress erlitten Patient:innen nach median 3,1 vs. 4,6 Jahre (HR: 0,58; 95% CI: 0,32–1,03; p=0,065) und die mediane Zeit bis zur ersten nachfolgenden Therapie betrug 2,9 vs. 5,1 Jahre (HR: 0,42; 95% CI: 0,22–0,80; p=0,009). Der Median für das Gesamtüberleben (OS) war in beiden Studienarmen noch nicht erreicht. Mit einer Reduktion des Risikos zu versterben von 29% wurde ein numerischer Vorteil durch die Metastasen-gerichtete SBRT beobachtet (HR: 0,71; 95% CI: 0,31–1,59; p=0,407). Das Sicherheitsprofil von SBRT plus Enzalutamid und ADT war vergleichbar mit dem der alleinigen hormonellen Behandlung.
Urothelkarzinom
Adjuvantes Nivolumab beim Harnblasenkarzinom
Für die adjuvante Therapie beim muskelinvasiven Urothelkarzinom (MIUC) mit Hochrisiko nach radikaler Operation wurde in der randomisierten, doppelblinden Phase-III-Studie CheckMate 274 Nivolumab vs. Placebo geprüft.2 Randomisiert wurden 709 Patient:innen mit Tumoren im Stadium ypT2–ypT4a oder ypN+ MIUC mit vorangegangener neoadjuvanter Chemotherapie sowie im Stadium pT3–pT4a oder pN+ MIUC ohne vorangegangene neoadjuvante Chemotherapie. Primärer Studienendpunkt waren das krankheitsfreie Überleben (DFS) innerhalb der ITT-Population sowie das DFS bei Patient:innen mit PD-L1-Expression ≥1%.
Bei 79% der Erkrankten handelte es sich bei dem Primärtumor um ein muskelinvasives Harnblasenkarzinom (MIBC). In einer explorativen Analyse wurde nur diese Patient:innenkohorte mit MIBC ausgewertet. Mit einer medianen Nachbeobachtungszeit von 36,1 Monaten für die ITT-Population und 34,5 Monaten für die MIBC-Population wurde mit Nivolumab das mediane Überleben von 8,5 auf 25,6 Monate mehr als verdreifacht. Das Risiko für ein Fortschreiten der Erkrankung wurde mit der adjuvanten Nivolumab-Gabe um 37% gegenüber Placebo reduziert (HR: 0,63; 95% CI: 0,51–0,78). Mit vorangegangener neoadjuvanter Chemotherapie lag das mediane DFS bei Patient:innen mit MIBC bei 19,6 vs. 8,3 Monate (HR: 0,58; 95% CI: 0,43–0,79). Hatten die Betroffenen keine neoadjuvante Chemotherapie erhalten, betrug das mediane DFS 25,9 vs. 13,7 Monate (HR: 0,69; 95% CI: 0,50–0,94). Für das OS wurde eine 30%ige Reduktion des Sterberisikos in der MIBC-Population berechnet (HR: 0,70; 95% CI: 0,55–0,90). Nach 24 Monaten lebten 75,3% der Patient:innen mit Nivolumab vs. 66,2% im Placeboarm und nach 36 Monaten 64,2% vs. 53,7%. Zeigten die MIBC-Patient:innen einen positiven PD-L1-Status (≥1%) vergrößerte sich der Anteil der Patient:innen mit einem OS von mindestens zwei Jahren auf 82,6% vs. 67,4% und von mindestens drei Jahren auf 71,8% vs. 52,0% (HR: 0,48; 95% CI: 0,29–0,77).
Enfortumab Vedotin plus Pembrolizumab als Erstlinientherapie
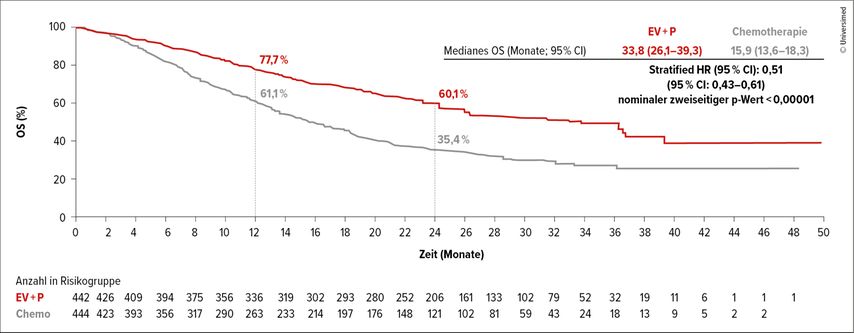
Mit einem weiteren Jahr Nachbeobachtungszeit wurden auch die aktualisierten Daten der Phase-III-Studie EV-302/KEYNOTE-A39 beim ASCO GU präsentiert.3 Der randomisierte Vergleich von Enfortumab Vedotin plus Pembrolizumab vs. Chemotherapie in der Behandlung therapienaiver Patient:innen mit lokal fortgeschrittenem oder metastasiertem Urothelkarzinom hatte eine Verdopplung des medianen PFS von 6,3 auf 12,5 Monate und des medianen OS von 16,1 auf 31,5 Monate gezeigt.
Mit nunmehr 2,5 Jahren Nachbeobachtungszeit blieben PFS (HR: 0,48; 95% CI: 0,41–0,57) und OS (HR: 0,51; 95% CI: 0,43–0,61) konsistent vorteilhafter mit der chemotherapiefreien Kombinationstherapie (Abb. 1). Die 2-Jahres-Raten für das PFS lagen bei 37,1% vs. 12,6% und für das OS bei 60,1% vs. 35,4%. Subgruppenanalysen zeigten den PFS- und OS-Vorteil für alle präspezifizierten Patient:innengruppen. Ein Ansprechen zeigten 67,5% vs. 44,2% (p<0,00001) mit kompletten Remissionen bei 30,4% vs. 14,5% der Patient:innen. Die Dauer des Ansprechens lag bei 23,3 vs. 7,0 Monate. Nach 24 Monaten hatten 49,4% vs. 24,0% der ansprechenden Patient:innen eine anhaltende Remission. 74,3% vs. 43,2% der Patient:innen mit komplettem Ansprechen waren auch nach 24 Monaten noch in Remission.
Abb. 1: Gesamtüberleben (OS) unter Enfortumab Vedotin (EV) plus Pembrolizumab (P) vs. Chemotherapie (modifiziert nach Powles T et al.)3
Nierenzellkarzinom
Verlängertes PFS mit TKI und doppelter Immunblockade
In der COSMIC-313-Studie erhielten RCC-Patient:innen Cabozantinib in Kombination mit Nivolumab und Ipilimumab. Beim ASCO GU wurden die finalen Ergebnisse der randomisierten, placebokontrollierten Phase-III-Studie präsentiert.4 Insgesamt wurden 855 Betroffene randomisiert, von denen, mit einer medianen Nachbeobachtungszeit von 45,0 Monaten, 734 die Studienmedikation beendet hatten. Die Erkrankten waren median 60–61 Jahre alt und wiesen zu 75% ein mittleres und zu 25% ein hohes Progressionsrisiko laut IMDC auf.
Mit der längeren Nachbeobachtungszeit wurde ein Vorteil bezüglich des PFS durch die zusätzliche Cabozantinib-Gabe zu Nivolumab plus Ipilimumab bestätigt. Der Median lag bei 16,6 vs. 11,2 Monate, die 24-Monats-PFS-Rate bei 44% vs. 37%. Der Unterschied zwischen den Kurven war statistisch signifikant (HR: 0,82; 95% CI: 0,69–0,98). Subgruppenanalysen bestätigten den PFS-Vorteil mit Cabozantinib insbesondere bei mittlerem Progressionsrisiko (HR: 0,76; 95% CI: 0,62–0,93). Patient:innen mit einem hohen Risiko für einen Krankheitsprogress zeigten keinen Vorteil durch die zusätzliche Cabozantinib-Gabe (HR: 1,04; 95% CI: 0,73–1,48).
Mit einer Hazard-Ratio von 1,02 (95% CI: 0,85–1,23; p=0,84) waren die Kaplan-Meier-Kurven zum OS für beide Studienarme vergleichbar. Im Median lebten die Patient:innen 41,9 vs. 42,0 Monate. Subgruppenanalysen identifizierten keine Gruppe mit erhöhtem Nutzen, ausgenommen Patient:innen ohne Viszeralmetastasierung (HR: 0,53; 95% CI: 0,29–0,97). In beiden Therapiearmen erhielt etwa die Hälfte der Betroffenen mindestens eine weitere Therapielinie. Die Zeit bis zur ersten nachfolgenden systemischen Therapie betrug 14,5 Monate mit Cabozantinib vs. 9,7 Monate ohne Cabozantinib. Therapie-assoziierte Nebenwirkungen traten häufiger im Verumarm auf und führten bei 49% vs. 26% der Erkrankten zum Abbrechen mindestens einer der Wirksubstanzen.
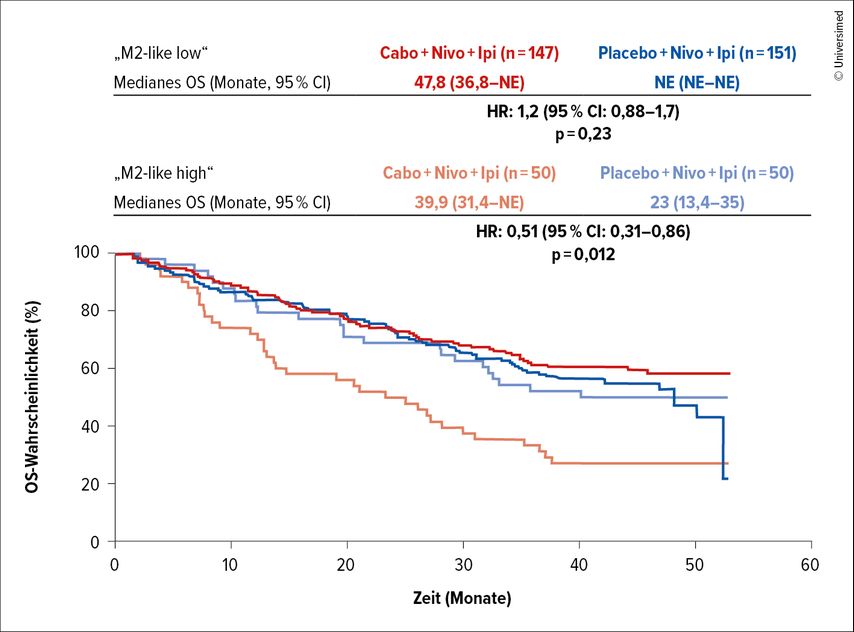
Explorative Biomarker-Analysen der RNA-Sequenzen zeigten keinen eindeutigen Zusammenhang zwischen den molekularen Gruppen und dem Therapieerfolg. Ein Effekt von Cabozantinib auf verschiedene Immunzelltypen wurde ebenfalls untersucht und zeigte, dass „M2-like“ Makrophagen die Immunantwort unterdrücken. Patient:innen mit einem höheren Progressionsrisiko und mit Viszeralmetastasen wiesen höhere Spiegel von „M2-like“ Makrophagen auf. Die zusätzliche Gabe von Cabozantinib zur Immunkombination hob die schlechtere Prognose durch die durch „M2-like“ Makrophagen vermittelte Immunsuppression auf (Abb. 2).
Abb. 2: Gesamtüberleben (OS) unter Therapie mit Nivolumab (Nivo) plus Ipilimumab (Ipi) mit oder ohne Cabozantinib (Cabo) bei niedriger oder hoher Ausprägung von „M2-like“ Makrophagen (modifiziert nach Albiges L et al.)4
Gute Wirksamkeitsergebnisse für Lenvatinib plus Belzutifan
Nach einer PD-(L)1-Inhibitor- und VEGF-Tyrosinkinase-Inhibitor(TKI)-Therapie ist die Datenlage für Kombinationstherapieoptionen unklar. Die offene Phase-I/II-Studie KEYMAKER-U03 untersuchte daher im Umbrella-Design Kombinationstherapien bei vorbehandelten Patient:innen. Beim ASCO GU wurden die Ergebnisse für die Regime Pembrolizumab plus Belzutifan (n=62), Lenvatinib plus Belzutifan (n=64) und Pembrolizumab plus Lenvatinib (n=73) präsentiert.5 Der primäre Endpunkt für die einzelnen Studienarme war die Ansprechrate (ORR), es waren formell keine Vergleiche zwischen den Studienarmen vorgesehen. Im Median lagen die Nachbeobachtungszeiten für die Studienarme bei 16,6, 17,6 und 19,4 Monaten.
Die Patient:innen waren median zwischen 60 und 63 Jahre alt. Ein gutes Drittel (36–37%) hatte in der ersten Therapielinie einen CTLA-4-Inhibitor erhalten. 36–37% der Patient:innen waren mit zwei Therapielinien und 42–57% mit ≥3 Therapielinien behandelt worden.
Die Prognose laut IMDC-Risikoscore war bei 21–23% der Betroffenen vorteilhaft, bei 60–69% mittelmäßig und bei 11–17% schlecht. Im Ergebnis wurde mit Lenvatinib plus Belzutifan die höchste ORR (46,9%) und mit Pembrolizumab plus Belzutifan die niedrigste ORR (19,4%) erreicht. Auf Pembrolizumab plus Lenvatinib sprachen 39,7% der Patient:innen an. Die mediane Dauer des Ansprechens war mit Pembrolizumab plus Belzutifan noch nicht erreicht und lag unter Lenvatinib plus Belzutifan bei 22,1 Monaten sowie mit Pembrolizumab plus Lenvatinib bei 8,3 Monaten.
Nach sechs Monaten lebten progressionsfrei 41,8% der Patient:innen im Arm mit Pembrolizumab plus Belzutifan, 63,1% im Arm mit Lenvatinib plus Belzutifan und 66,7% im Arm mit Pembrolizumab plus Lenvatinib. Nach zwölf Monaten betrug die PFS-Rate für die drei Studienarme 28,6%, 51,8% sowie 34,5%. Der Median lag bei 5,4, 12,5 und 9,4 Monaten. Für das OS wurden 12-Monats-Raten von 67,9%, 79,5% und 81,7% und 18-Monats-Raten von 57,6%, 74,4% und 73,2% beobachtet. Hier lag der Median bei 27,4 und 32,3 Monaten für die Belzutifan-Kombinationen und war für Pembrolizumab plus Lenvatinib noch nicht erreicht.
Therapie-assoziierte Nebenwirkungen Grad 3–5 wurden am häufigsten für Lenvatinib plus Belzutifan berichtet (60,3%). Für Pembrolizumab plus Lenvatinib lag die Häufigkeit bei 49,3% und für Pembrolizumab plus Belzutifan bei 41,9%. Die Kombination Lenvatinib plus Belzutifan wird nun in der randomisierten Phase-III-Studie LITESPARK-011 gegen Cabozantinib verglichen.
Quelle:
ASCO Genitourinary Cancers Symposium (ASCO GU), 14.–16. Februar 2025, San Francisco, USA
Literatur:
1 Niazi T et al.: Metastases-directed therapy in addition to standard systemic therapy in oligometastatic castration resistant prostate cancer: a randomized phase II trial (GROUQ-PCS 9). ASCO GU 2025; Abstr. #22 2 Milowsky MI et al.: Adjuvant nivolumab vs placebo for high-risk muscle-invasive urothelial carcinoma (MIUC): additional efficacy outcomes including overall survival in patients with muscle-invasive bladder cancer (MIBC) from CheckMate 274. ASCO GU 2025; Abstr. #658 3 Powles T et al.: EV-302: Updated analysis from the phase 3 global study of enfortumab vedotin in combination with pembrolizumab vs chemotherapy in previously untreated locally advanced or metastatic urothelial carcinoma (la/mUC). ASCO GU 2025; Abstr. #664 4 Albiges L et al.: Cabozantinib in combination with nivolumab and ipilimumab in previously untreated advanced renal cell carcinoma (aRCC): final results of COSMIC-313. ASCO GU 2025; Abstr. #438 5 Beckermann KE et al.: KEYMAKER-U03 Substudy 03B: Pembrolizumab and targeted therapy combinations for advanced clear cell renal carcinoma (ccRCC). ASCO GU 2025; Abstr. #440