Was steckt hinter dem Delir?
Bericht:
Martha-Louise Storre
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Delir-Erkrankung ist eine akute Enzephalopathie mit zahlreichen potenziellen Mechanismen. Um das Delir effektiv zu vermeiden, zu behandeln und langfristige Komplikationen zu verhindern, ist das Verständnis der Pathophysiologie essenziell.
Keypoints
-
Die Delirentstehung ist gekennzeichnet durch 33 prädisponierende und 112 auslösende Faktoren.
-
Das Verständnis der Pathophysiologie des Delirs kann dazu beitragen, eine bessere Prävention und Therapie zu entwickeln.
-
30 bis 40 Prozent der Delirien sind vermeidbar.
Die Epidemiologie des Delirs ist weit, erläuterte PD Dr. Annerose Mengel, Leitende Oberärztin an der Klinik für Neurologie des Universitätsklinikums Tübingen. So seien davon 15 bis 20 Prozent aller hospitalisierten Personen betroffen. Betrachte man unterschiedliche Bereiche in den Kliniken, so weisen 30 Prozent der Patientinnen und Patienten über 65 Jahre in der zentralen Notaufnahme, 40 bis 60 Prozent der Erkrankten auf Intensivstationen sowie 50 Prozent im Palliativbereich ein Delir auf. Aus eigenen Erhebungen berichtete Mengel, dass 24 bis 40 Prozent der Schlaganfallpatientinnen und -patienten ein Delir entwickeln. Dies geschehe schnell: „Der erste Score ist meist schon nach 24 bis 72 Stunden nach dem Schlaganfall positiv und die Betroffenen sind oftmals delirant“, so die Expertin. Problematisch seien die Konsequenzen – eine erhöhte Mortalität, verlängerter Krankenhausaufenthalt und eine erhöhte Wiederaufnahmerate.
Ein 2023 publiziertes, großes systematisches Review hat 33 prädisponierende Faktoren identifiziert:2 Neben höherem Alter, kognitiven Einschränkungen und Demenz sind demnach vor allem auch funktionelle Einschränkungen mit dem Delir assoziiert – seien sie motorischer Art sowie das Gehör oder die Sehfähigkeit betreffend. Es folgen Erkrankungen des zentralen Nervensystems sowie kumulative Komorbiditäten internistischer Natur. Darüber hinaus beschreiben die Autorinnen und Autoren 112 behandlungsassoziierte Faktoren, die zu einem Delir führen können. Diese sind nicht ausschließlich operativ, sondern können auch primär bedingt sein, beispielsweise durch eine vorliegende Hypoxämie, Schlaganfall oder Schmerz.2 Es stelle sich daher die Frage, was ein Delir konkret sei beziehungsweise wie sich dabei die Pathophysiologie gestalte. Ein Verständnis dessen könne dazu beitragen, eine bessere Prävention und Therapie anbieten zu können. „30 bis 40 Prozent der Delirien sind vermeidbar“, so Mengel.
Mögliche Mechanismen
Es gibt verschiedene Hypothesen die Pathophysiologie des Delirs betreffend. Die laut der Expertin älteste und bekannteste von ihnen ist die Neurotransmitterhypothese: Man geht davon aus, dass zum Beispiel eine metabolische Störung wie eine Hypoglykämie zu einer gesamtmetabolischen Störung des Gehirns führen kann. Dies resultiert in einer reduzierten Synthese von Neurotransmittern und in der Folge in einer Dysbalance. Es kommt zum Delir.3 Auch Medikamente wie dopaminerge Substanzen können die Dysbalance der Neurotransmitter begünstigen.
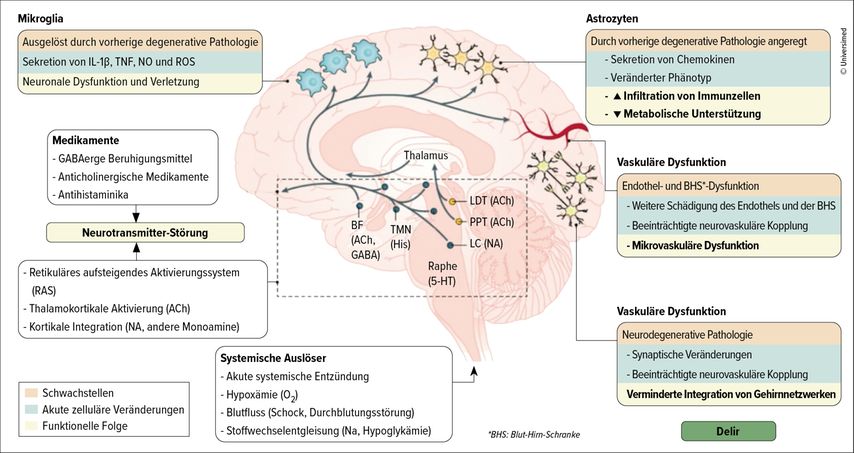
Eine zweite Hypothese stellt die Neuroinflammation in den Fokus der pathophysiologischen Prozesse. Systemische Infektionen führen zu einer Erhöhung von Zytokinen wie Interleukin(IL)-1, IL-6 und TNF-α. Über die Aktivierung von Mikroglia kommt es zu einem Zytokinsturm im Gehirn und in der Folge zum Delir. „Dass die Neuroinflammationshypothese real ist, zeigt die Tatsache, dass wir während eines Delirs intrathekal ein erhöhtes IL-8 messen können“, führte Mengel aus. Medikamentöse Ansätze zur Therapie der Inflammation seien bereits untersucht worden, hätten bislang jedoch noch nicht zum Erfolg geführt.
Die dritte wichtige Hypothese befasst sich mit der metabolischen Dysregulation, auch als „Oxidativer Stress“-Hypothese bekannt. Hier geht man davon aus, dass freie Radikale im Gehirn nicht abgebaut werden können und es dadurch zu einer Veränderung der neuronalen Lipidmembranen und einer neuronalen Dysfunktion kommt.4 Verschiedene Arbeiten untersuchten diesen Ansatz bereits, unter anderem eine Studie mit kardiologischen Patientinnen und Patienten:5 Hier zeigte sich, dass intraoperative oxidative Schäden mit einem stärkeren postoperativen Delirium und größeren neuronalen Schäden in Verbindung gebracht werden können. Der Zusammenhang zwischen oxidativen und neuronalen Schäden war zudem bei einer erhöhten Störung der Blut-Hirn-Schranke stärker.
„An jeder dieser drei Hypothesen ist etwas dran und vermutlich liegt ein Zusammenspiel aus ihnen vor“, so Mengel. Zusammengefasst komme es zu einer Mikroglia-aktivierung, die wahrscheinlich durch Interleukine getriggert wird. Darüber hinaus liegt eine Veränderung der Astrozyten durch eine erhöhte Sekretion von Chemokinen vor. Dabei wechseln die Astrozyten ihren Phänotyp und führen zu einer vermehrten Inflammation im Gehirn, hob die Expertin hervor. Eine vaskuläre Dysfunktion scheine durch die metabolischen Veränderungen bedingt zu werden. In der Summe führe dies dazu, dass neuronale Netzwerke durch die Veränderungen an den Synapsen gestört würden und ein Delir entstehe (Abb.1).
Es stelle sich daher die Frage, ob das Delir nicht eine Störung der zerebralen Konnektivität sei – die vierte Hypothese. Die zerebrale Konnektivität lässt sich u.a. durch ein EEG sichtbar machen: Bei Delir-Betroffenen zeigt sich im frontalen Kortex eine erhöhte α-Power und im parietalen Kortex eine verminderte α-Power.6 Ein EEG zeige laut Mengel immer nur den Istzustand. Es lasse sich jedoch nicht ablesen, wie die Neurone miteinander kommunizieren. Daher führte die Forschungsgruppe um Mengel in einer Studie bei 33 Schlaganfallpatientinnen und -patienten nach zerebraler Ischämie, aber noch vor Delir eine transkranielle Magnetstimulation (TMS) durch – und stimulierten mittels transkranieller Magnetstimulation frontal und parietal.7 Es zeigte sich, dass bei Betroffenen, die später ein Delir entwickelten, bereits die lokale Stimulation gestört war. Auch der PCIst, ein Marker für die zerebrale Komplexität, war bei dieser Gruppe bereits vor dem Delir reduziert. Die sogenannte „natural frequency“ war ebenfalls vorab vermindert, berichtete die Expertin. Da das Delir nicht nur mit Schlaganfällen in Verbindung stehe, sondern ein globales Phänomen sei, laufe aktuell eine Studie an über 400 Delir-Betroffenen jeden Alters mit unterschiedlichen Auslösern. Erste Auswertungen ergaben, dass sich unabhängig von der Delirätiologie im EEG erhöhte Delta- und Theta-Aktivität beobachten lassen. Das EEG sowie das TMS-EEG scheinen laut Mengel demnach wichtige Biomarker zu sein, um die zerebrale Konnektivität zu messen.
Quelle:
Symposium „Das Delir in der Neurologie“ im Rahmen des DGN-Kongresses am 8. November 2023 in Berlin
Literatur:
1 Slooter AJC et al.: Updated nomenclature of delirium and acute encephalopathy: statement of ten societies. Intensive Care Med 2020; 46(5): 1020-2 2 Ormseth CH et al.: Predisposing and precipitating factors associated with delirium: a systematic review. JAMA Netw Open 2023; 6(1): e2249950 3 Fong TG et al.: Delirium in elderly adults: diagnosis, prevention and treatment. Nat Rev Neurol 2009; 5(4): 210-20 4 Karlidag R et al.: The role of oxidative stress in postoperative delirium. Gen Hosp Psychiatry 2006; 28(5): 418-23 5 Lopez MG et al.: Intraoperative oxidative damage and delirium after cardiac surgery. Anesthesiolog 2020; 132(3): 551-61 6 van Montfort SJT et al.: Brain network disintegration as a final common pathway for delirium: a systematic review and qualitative meta-analysis. Neuroimage Clin 2019; 23: 101809 7 Bai Y et al.: Cortical reactivity to transcranial magnetic stimulation predicts risk of post-stroke delirium. Clin Neurophysiol 2023; 148: 97-108 8 Wilson JE et al.: Delirium. Nat Rev Dis Primers 2020; 6(1): 90
Das könnte Sie auch interessieren:
Angepasste Therapien und Biomarker verbessern den Krankheitsverlauf bei MS
Neue Biomarker und sensitivere Analysemethoden erleichtern die Behandlungsauswahl bei Multipler Sklerose und bilden den Krankheitsverlauf unter den Therapien immer verlässlicher ab. Auf ...
Interdisziplinäre Therapie der intrazerebralen Blutung
Aktuelle Studienergebnisse brachten erstmals einen positiven Effekt operativer Therapieverfahren auf das funktionelle Outcome bei Patient:innen mit intrazerebraler Blutung. Für die ...
Wenn das Sprechen schwerfällt – Dysarthrien verstehen und behandeln
Dysarthrien sind erworbene neurogene Störungen der Sprechmotorik, die die Ausführung und Koordination der für das Sprechen benötigten Bewegungen beeinträchtigen. Neben bekannten, ...