Highlights der ÖPG-Jahrestagung 2025
Bericht:
Dipl.-Ing. Dr. Manuel Spalt-Zoidl
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Vom 22. bis 24. Oktober 2025 fand die Jahrestagung der Österreichischen Parkinson-Gesellschaft in Graz statt. Tagungspräsidentin Assoc. Prof.in Dr.in Petra Schwingenschuh, Medizinische Universität Graz, und führende Expert:innen berichteten von den neuesten Erkenntnissen bei biologischen Diagnosekriterien, krankheitsmodifizierenden Therapien und der Behandlung von Begleitsymptomen der Parkinsonkrankheit (PD).
Keypoints
-
Eine biomarkergestützte Diagnostik (u.a. mit SAAs) könnte den Weg für die Erfassung von prodromalen oder präklinischen Stadien der PD in der Zukunft ebnen.
-
Therapeutische Targets für krankheitsmodifizierende Therapien umfassen u.a. Signalwege des Insulins und der α-Synuklein-Proteostase. Belastbare Evidenz zur Wirksamkeit verschiedener Arzneimittel muss jedoch noch generiert werden.
-
Die NEURODEG-Leitlinie ermöglicht Neurolog:innen eine strukturierte Abklärung und Behandlung von Blasenfunktionsstörungen bei Patient:innen mit PD.
-
Der Parkinsontremor unterscheidet sich signifikant vom essenziellen Tremor im TSI. MRgFUS könnte eine interessante nichtinvasive Behandlungsoption bei therapierefraktärem Tremor darstellen.
Biologische Krankheitsdefinition und Biomarker der PD
Für die klinische Diagnose der PD müssen drei Schlüsselkriterien erfüllt sein, eröffnete Prof. em. Univ-Prof. Werner Poewe, Medizinische Universität Innsbruck, seinen Vortrag. Diese umfassen das Vorliegen eines Kardinalsymptoms und weiterer supportiver Zeichen sowie die Abwesenheit von Ausschlusskritieren.1 Diese Kriterien sind für den klinischen Alltag nützlich, haben aber ihre Grenzen. So zeigten retrospektive Studien bei 267 Patient:innen, dass die Diagnosegenauigkeit von Neurolog:innen 90% kaum überschreitet.2 Außerdem ist die PD durch zahlreiche klinische und genetische Subtypen gekennzeichnet, welche die Diagnose auf motorischer Basis erschweren. Auch können durch die vorliegenden Diagnosekriterien weder prodromale oder präklinische Stadien erkannt noch das Parkinsonrisiko beziffert werden.
Angelehnt an die Alzheimerkrankheit wurden daher biologische Diagnosekriterien definiert, um die PD bereits vor dem Auftreten der ersten klinischen Symptome zu klassifizieren.3,4 So werden Menschen mit einer Variante des Synuclein-alpha-Gens (SNCA) Stadium 0 zugeteilt. Stadium 1A/B umfasst Menschen mit einer α-Sy-nuklein-Pathologie und einer dopaminergen Dysfunktion. Ab Stadium 2 zeigen Patient:innen erste klinische Symptome und werden von Stadium 3 bis 6 anhand des Schweregrads ihrer funktionellen Einschränkungen eingeteilt.4
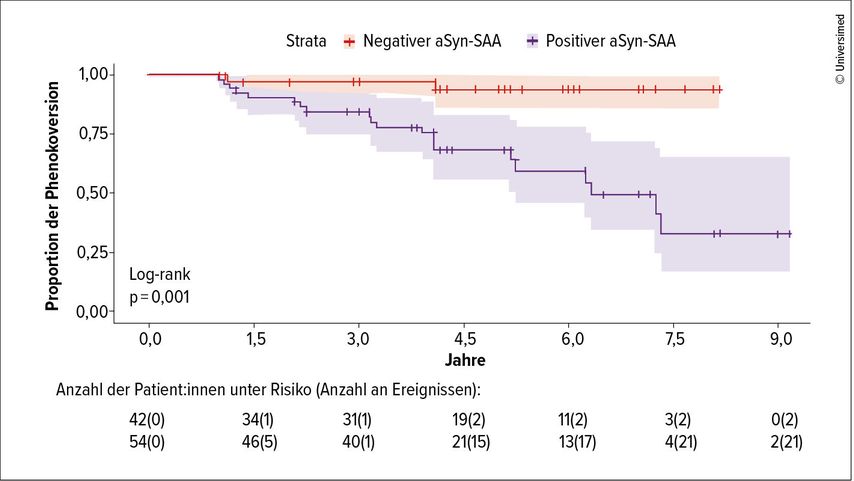
Als biologischer Marker kommt unter anderem der Nachweis von α-Synuklein mit sogenannten Seed-Amplification-Assays (SAAs) aus Liquor- oder Plasmaproben infrage. So untersuchten Siderowf et al. α-Synuklein-SAAs von 51 Personen im prodromalen Stadium mit Hyposmie und REM-Schlaf-Verhaltensstörungen und von 310 asymptomatischen Träger:innen der Risikogene für die „leucine rich repeat kinase 2“(LRRK2) oder die Glucocerobrosidase (GBA). In der Studie wiesen 86% der prodromalen PD-Risikopatient:innen einen positiven α-Synuklein-SAA-Befund auf, während dies nur bei 8% der Genträger:innen der Fall war, bei denen sich die Erkrankung nicht manifestierte.5 Eine weitere Studie bei 96 Menschen im prodromalen Stadium belegte eine signifikant höhere Phänokonversion zu PD bei α-Synuklein-Positivität im Vergleich zu Teilnehmenden mit einem negativen Befund (p=0,001; Abb. 1).6
Abb. 1: Anteil der Menschen im prodromalen Stadium, die im Verlauf von 9 Jahren eine Phänokonversion zu PD erlitten (modifiziert nach Coughlin DG et al.)6
Poewe betonte allerdings, dass nur 23% der asymptomatischen Personen mit einem positiven α-Synuklein-Nachweis eine PD innerhalb von vier bis fünf Jahren entwickeln. Zudem bildet der Biomarker nicht alle Formen der PD ab. SAAs sind zum Zeitpunkt des Vortrags noch nicht für den Routineeinsatz verfügbar.7,8
Krankheitsmodifizierende Therapien bei der Parkinsonerkrankung
Von den 136 klinischen Studien, welche im Jahr 2024 Arzneimittel für die Behandlung der PD beurteilten, waren 44% krankheitsmodifizierende Therapieansätze, berichtete Univ.-Prof. Dr. Klaus Seppi, Medizinische Universität Innsbruck.9 Dabei werden unterschiedliche therapeutische Targets evaluiert.
In den letzten Jahren hat sich ein Zusammenhang zwischen Typ-2-Diabetes (T2D) und dem Parkinsonrisiko herauskristallisiert. Anhand einer Metaanalyse mit 15 Kohortenstudien und 29,0 Millionen Teilnehmer:innen zeigte sich, dass das relative PD-Risiko bei Patient:innen mit T2D statistisch signifikant um 27% gegenüber der gesunden Bevölkerung erhöht ist (RR 1,27; 95% CI: 1,20–1,35). Auch Menschen mit Prädiabetes weisen ein 4% erhöhtes PD-Risiko auf (RR: 1,04; 95% CI: 1,02–1,07).10 Therapieansätze mit Glukagon-like-Peptide-1-Rezeptor-Agonisten (GLP-1-RA) lieferten in klinischen Studien bis dato keine konklusiven Ergebnisse.11–14 Anders sieht es bei Inhibitoren des „sodium-glucose cotransporter 2“ (SGLT2) aus. Registerdaten bei 86229 Menschen mit T2D und einem Follow-up von 760459 Patient:innenjahren belegten eine deutliche Reduktion des Risikos für die Entwicklung einer PD, wenn sie für die Behandlung des T2D SGLT2-Inhibitoren anstelle von Metformin erhielten (HR: 0,15; 95% CI: 0,10–0,21; p<0,001).15
Die α-Synuklein-Proteostase stellt ein weiteres therapeutisches Target für krankheitsmodifizierende Therapien dar. Hier werden Ansätze zur Reduktion, Hemmung der Aggregation oder Förderung des Abbaus von α-Synuklein in klinischen Studien evaluiert. Ferner wird die Blockade der neuronalen Aufnahme von α-Synuklein durch aktive oder passive Immuntherapien beurteilt.9,16 Letztere lieferten zum Zeitpunkt des Vortrags keine statistisch signifikanten Ergebnisse des primären Endpunkts, zeigten jedoch positive Trends bei sekundären und Post-hoc-Analysen und werden gegenwärtig in weiteren Studien evaluiert.17–19
Beeinflussbare „Risikofaktoren“ der PD
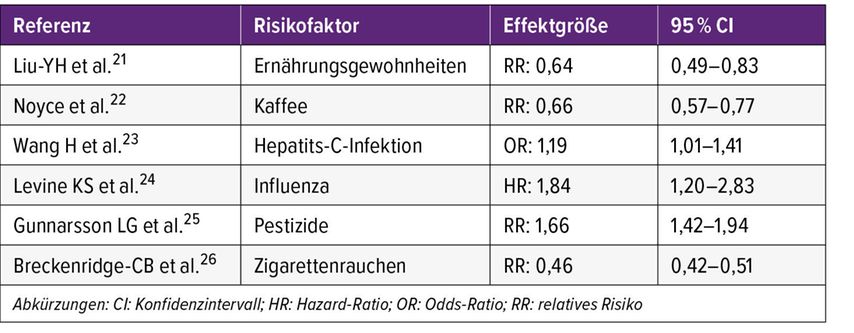
Erfreulich ist, so Seppi, dass die PD mit beeinflussbaren „Risikofaktoren“ einhergeht. Eine Metaanalyse bei 544336 Menschen zeigte, dass Personen, die mindestens mäßiggradige körperliche Aktivität betreiben, ein etwa 20% beziehungsweise 30% niedrigeres Risiko haben, innerhalb von 12 Jahren an PD zu erkranken.20 Eine Auswahl weiterer modifizierbarer Risikofaktoren ist in Tabelle 1 dargestellt.
Seppi schloss seinen Vortrag mit einer Forderung an die Politik, das Gesundheitswesen, aber auch an die Gesellschaft, sowohl großflächige wie auch individuelle Maßnahmen für die Reduktion des Parkinsonrisikos zu fördern. Beispiele umfassen eine Steigerung des Bewusstseins für einen gesunden Lebensstil, bessere Schutzmaßnahmen für die Bevölkerung, gesunde Ernährung und viel körperliche Aktivität.
Diagnose und Behandlung von Blasenfunktionsstörungen bei PD
Blasenfunktionsstörungen stellen eine mit dem Parkinsonsyndrom eng vergesellschaftete Belastung für Patient:innen dar, präsentierte Dr. Fabian Leys, Medizinische Universität Innsbruck. Bei etwa 53–71% der Parkinsonpatient:innen treten suprapontine Läsionen auf und manifestieren sich klinisch in einer überaktiven Blase.27 Um evidenzbasierte Leitlinien zur Behandlung dieser Symptome für Neurolog:innen zur Verfügung zu stellen, wurde das Projekt zur Erstellung der „Guidelines for the practicing neurologist on neurogenic urogenital dysfunction management“ (NEUROGED) ins Leben gerufen.28
Diese beinhalten unter anderem einen Abklärungs- und Behandlungsleitfaden für Blasenfunktionsstörungen bei PD. Die klinische Beurteilung wird durch eine ausführliche Anamnese eingeleitet, bei der Symptome einer vorliegenden Blasenfunktionsstörung erfragt und der komplette neurologische Status erhoben werden. Anschließend sollten die Behandelnden eine Urinanalyse und in weiterer Folge Bluttests durchführen. Abschließend ist eine Messung des Restharns nach der Blasenentleerung (PVR) angezeigt. Bei einer konsistenten relevanten PVR von ≥150ml werden initial exazerbierende Faktoren wie Anticholinergika, trizyklische Antidepressiva oder Opioide ausgeschlichen und der Restharn mittels Katheter entfernt.28
Nichtpharmakologische Maßnahmen für die Behandlung der Blasenfunktionsstörungen bei Menschen mit PD umfassen Blasentraining, eine Evaluierung der Flüssigkeitseinnahme, Physiotherapie des Beckenbodens und eine tibiale Nervenstimulation. Ergänzend können pharmakologische Therapien eingesetzt werden. Im Rahmen der Erstlinienbehandlung sind hier Antidiuretika oder, bei Speichersymptomen, Muskarinrezeptor-Antagonisten angezeigt. Weitere Behandlungslinien schließen Beta-3-Adrenozeptor-Agonisten oder eine Kombination dieser Arzneimittel ein. Handelt es sich um eine Blasenentleerungssymptomatik empfiehlt die Leitlinie Alpha-Blocker. Abschließend sollte die befriedigende Kontrolle der Symptome regelmäßig überwacht und, falls diese nicht erreicht wird, eine interdisziplinäre Zusammenarbeit mit Urolog:innen angestrebt werden.28
Besonderheiten des Parkinsontremors
Im Rahmen einer Online-Umfrage wurden 790 Teilnehmende befragt, bei welchen drei Aspekten sie sich am meisten eine Beschwerdelinderung erhoffen würden. Parkinsontremor wurde hier als primäre Beschwerde bei Menschen mit einer Erkrankungsdauer ≤2–10 Jahren angegeben, so Schwingenschuh.29
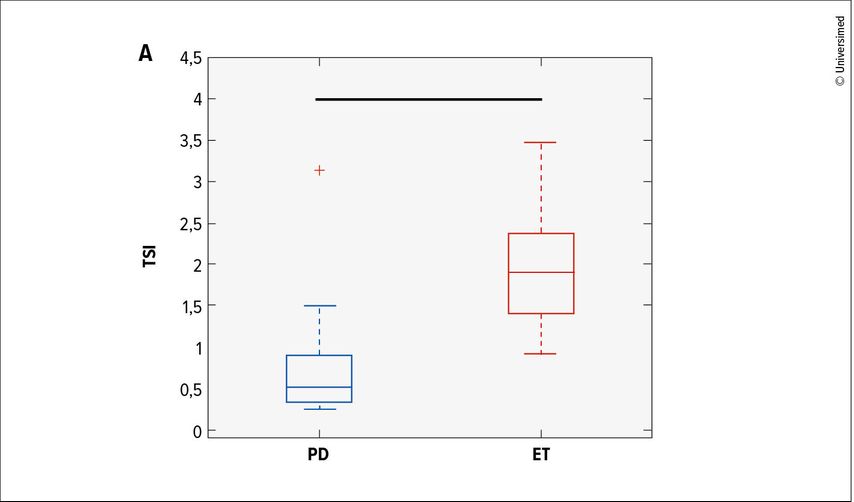
Grundsätzlich wird jede pathologische Form von Tremor bei Patient:innen mit PD als Parkinsontremor klassifiziert.30 Eine Besonderheit sind seine Stabilität über eine breite Frequenzspanne und seine Toleranz gegenüber Frequenzänderungen. Aus diesem Grund stellt der sogenannte Tremorstabilitätsindex (TSI) einen wertvollen neuropsychologischen Parameter dar. Dieser erreicht bei der Unterscheidung zwischen essenziellem Tremor und Parkinsontremor eine signifikante Trennschärfe (p<0,001; Abb. 2) mit einer Sensitivität von 95% und einer Spezifität von 88%. Ein TSI-Wert <1,05 deutet dabei auf einen Parkinsontremor hin, während darüber liegende Werte einen essenziellen Tremor beschreiben.31
Abb. 2: Box-Plot der Verteilung im Tremorstabilitätsindex (TSI) zeigt eindeutige Unterschiede zwischen Parkinsontremor und essenziellem Tremor (modifiziert nach di Biase L et al.)31
Eine von anderen Symptomen der PD unabhängige pharmakologische Behandlung des Parkinsontremors kann laut Leitlinien nicht bewertet werden.30 Dr. Christof Brücke, Medizinische Universität Wien, betonte, dass in der Regel alle drei Kardinalsymptome der PD gleich gut auf Levodopa ansprechen.32 In Einzelfällen kann ein therapierefraktärer Tremor durch eine Erhöhung der Levodopa-Tagesdosis, hohe Levodopa-Einzeldosen oder eine Mono- oder Kombinationstherapie mit Dopaminagonisten behandelt werden.30
Für Patient:innen, bei denen die herkömmliche medikamentöse Therapie nicht wirksam ist oder vertragen wird, könnte laut dem Vortragenden der Magnetresonanztomografie-gezielte fokussierte Ultraschall (MRgFUS) eine interessante Behandlungsoption darstellen. Dabei werden unter laufender MRT-Kontrolle fokussierte Ultraschallwellen auf ein Gehirnareal gerichtet. Die entstehende Wärme induziert eine kleine Läsion und unterbricht pathologische Schaltkreise. Durch diese nichtinvasive Methode konnten Maragkos et al. bei 96% von 29 Patient:innen eine direkte Verbesserung ihres Tremors bei PD erreichen. Zu beachten ist jedoch, dass eine anhaltende Besserung nur bei 63% aufgetreten ist, wie ein Follow-up nach 18 Monaten zeigte. Bei 17% der Patient:innen kam es zu einem Wiederauftreten des Tremors und zu Gleichgewichts- und Gangstörungen, schloss Brücke seinen Vortrag.33
Quelle:
Jahrestagung der Österreichischen Parkinson-Gesellschaft, 22.–24.Oktober 2025, Graz
Literatur:
1 Postuma RB et al.: MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord 2015; 30(12): 1591-601 2 Virameteekul S et al.: Clinical diagnostic accuracy of Parkinson’s disease: where do we stand? Mov Disord 2023; 38(4): 558-66 3 Höglinger GU et al.: A biological classification of Parkinson’s disease: the SynNeurGe research diagnostic criteria. Lancet Neurol 2024; 23(2): 191-4 4 Simuni T et al.: A biological definition of neuronal α-synuclein disease: towards an integrated staging system for research. Lancet Neurol 2024; 23(2): 178-90 5 Siderowf A et al.: Assessment of heterogeneity among participants in the Parkinson‘s Progression Markers Initiative cohort using α-synuclein seed amplification: a cross-sectional study. Lancet Neurol 2023; 22(5): 407-17 6 Coughlin DG et al.: α-synuclein seed amplification assay amplification parameters and the risk of progression in prodromal Parkinson disease. Neurology 2025; 104(5): e210279 7 Kovacs GG et al.: Biomarker-based approach to α-synucleinopathies: lessons from neuropathology. Mov Disord 2024; 39(12): 2173-9 8 Villain N et al.: Disentangling clinical and biological trajectories of neurodegenerative diseases. Nat Rev Neurol 2024; 20(12): 693-4 9 McFarthing K et al.: Parkinson’s disease drug therapies in the clinical trial pipeline: 2024 update. J Parkinsons Dis 2024; 14(5): 899-12 10 Aune D et al.: Diabetes mellitus, prediabetes and the risk of Parkinson’s disease: a systematic review and meta-analysis of 15 cohort studies with 29.9 million participants and 86,345 cases. Eur J Epidemiol 2023; 38(6): 591-604 11 McGarry A et al.: Safety, tolerability, and efficacy of NLY01 in early untreated Parkinson’s disease: a randomised, double-blind, placebo-controlled trial. Lancet Neurol 2024; 23(1): 37-45 12 Meissner WG et al.: Trial of lixisenatide in early Parkinson’s disease. N Engl J Med 2024; 390(13): 1176-85 13 Hogg E et al.: A phase II, randomized, double-blinded, placebo-controlled trial of liraglutide in PD. SSRN 2022. Preprint: https://doi.org/10.2139/ssrn.4212371 14 Vijiaratnam N et al.: Exenatide once a week vs placebo as a potential disease-modifying treatment for PwP in the UK: a phase 3 placebo-controlled trial. Lancet 2025; 405: 627-36 15 Rozani V et al.: Anti-diabetic drug use and reduced risk of Parkinson‘s disease: a community-based cohort study. Parkinsonism Relat Disord 2024; 128: 107132 16 Mahlknecht P et al.: Pharmacotherapy for disease modification in early Parkinson’s disease: how early should we be? J Parkinsons Dis 2024; 14(s2): S407-21 17 Lang AE et al.: Trial of cinpanemab in early Parkinson’s disease. N Engl J Med 2022; 387(5): 408-20 18 Pagano G et al.: Trial of prasinezumab in early-stage Parkinson’s disease. N Engl J Med 2022; 387(5): 421-32 19 Nikolcheva T et al.: PADOVA: topline results from a phase IIb study of prasinezumab in early-stage pd participants on stable symptomatic treatment. Präsentation bei der AD/PD 2025, Wien, 1.–5.April 2025 20 Fang X et al.: Association of levels of physical activity with risk of parkinson disease: a systematic review and meta-analysis. JAMA Netw Open 2018; 1(5): e182421 21 Liu M et al.: Potential crosstalk between Parkinson’s disease and energy metabolism. Aging Dis 2021; 12(8): 2003-15 22 Noyce AJ et al.: Meta-analysis of early nonmotor features and risk factors for parkinson disease. Ann Neurol 2012; 72(6): 893-901 23 Wang H et al.: Bacterial, viral, and fungal infection-related risk of Parkinson’s disease: meta-analysis of cohort and case-control studies. Brain Behav 2020; 10(3): e01549 24 Levine KS et al.: Virus exposure and neurodegenerative disease risk across national biobanks. Neuron 2023; 111(7): 1086-93.e2 25 Gunnarsson LG et al.: Occupational exposures and neurodegenerative diseases—a systematic literature review and meta-analyses. Int J Environ Res Public Health 2019; 16(3): 337 26 Breckenridge CB et al.: Association between parkinson’s disease and cigarette smoking, rural living, well-water consumption, farming and pesticide use: systematic review and meta-analysis. PLoS One 2016; 11(4): e0151841 27 Panicker JN et al.: Lower urinary tract dysfunction in the neurological patient: clinical assessment and management. Lancet Neurol 2015; 14(7): 720-32 28 Panicker JN et al.: European Academy of Neurology (EAN)/European Federation of Autonomic Societies (EFAS)/International Neuro-Urology Society (INUS) guidelines for practising neurologists on the assessment and treatment of neurogenic urinary and sexual symptoms (NEUROGED guidelines). Eur J Neurol 2025; 32(4): e70119 29 Port RJ et al.: People with Parkinson’s disease: what symptoms do they most want to improve and how does this change with disease duration? J Parkinsons Dis 2021; 11(2): 715-24 30 Höglinger G et al.: Parkinson-Krankheit, S2k-Leitlinie, 2023, in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. Online: www.dgn.org/leitlinien (abgerufen am 12.11.2025) 31 Di Biase L et al.: Tremor stability index: a new tool for differential diagnosis in tremor syndromes. Brain 2017; 140(7): 1977-86 32 Frequin HL et al.: Levodopa response in patients with early Parkinson disease: further observations of the LEAP study. Neurology 2023; 100(4): e367-76 33 Maragkos GA et al.: Patient-reported outcomes after focused ultrasound thalamotomy for tremor-predominant Parkinson’s disease. Neurosurgery 2023; 93(4): 884-91
Das könnte Sie auch interessieren:
Optische Kohärenztomografie bei Multipler Sklerose – wie viel ist genetisch?
Mit der optischen Kohärenztomographie kann durch die Messung retinaler Schichtatrophie die neuroaxonale Schädigung bei Multipler Sklerose erfasst werden. Eine neue Studie gibt Einblick ...
APOE und Anti-Amyloid-Therapien: Genetik im klinischen Alltag
Mit der Zulassung der ersten krankheitsmodifizierenden Therapien hat ein Paradigmenwechsel in der Behandlung der Alzheimerkrankheit begonnen. Anti-Amyloid-Antikörper können den ...
Neue globale Daten zur Epidemiologie von Kopfschmerzerkrankungen
Eine neue Studie des „Global Burden of Disease Collaborator“-Netzwerks hat nun die globale Krankheitslast durch die häufigsten Kopfschmerzerkrankungen beziffern können.1 Dabei fielen ...