Herausforderungen und Möglichkeiten für die Behandlung der Alzheimerkrankheit
Bericht: Dipl.-Ing. Dr. Manuel Spalt-Zoidl
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Jahrestagung der Österreichischen Alzheimer Gesellschaft (ÖAG) 2025 war geprägt von dem stattfindenden Paradigmenwechsel in der Therapie der Alzheimererkrankung. Durch die Zulassung von Anti-Amyloid-Antikörpern werden behandelnde Fachärzt:innen für Neurologie, Psychiatrie, Radiologie und Allgemeinmedizin vor neue Möglichkeiten, aber auch nie dagewesene Herausforderungen gestellt.
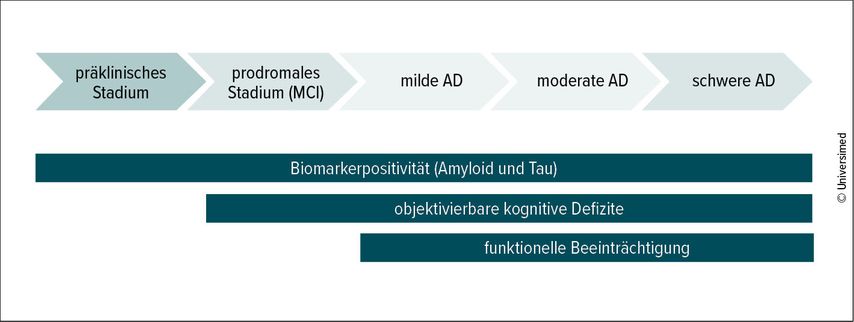
Forschende der Alzheimerkrankheit (AD) sind sich heute einig, dass die Erkrankung nicht erst mit dem Auftreten der ersten Symptome, sondern bereits in einem asymptomatischen Stadium beginnt und im Verlauf zu fortschreitenden kognitiven und schließlich funktionellen Einschränkungen führt (Abb.1).1
Der Patient:innen-Pathwayin Österreich
In Österreich beginnt mit den ersten kognitiven Defiziten ein komplexer und herausfordernder Weg in der Behandlung und Nachsorge der AD für Betroffene, deren Angehörige und Mediziner:innen. Um eine schnelle und präzise Diagnostik mit hoher Genauigkeit und mit patient:innenzentrierten und interdisziplinären Ansätzen zu fördern, publizierte die ÖAG unter der Leitung von Prof. Priv.-Doz. Dr. Elisabeth Stögmann, Medizinische Universität Wien, und Univ.-Prof. Dr. Thomas Benke, Medizinische Universität Innsbruck, einen Diagnosepfad.1
Angelehnt an die S3-Leitlinie Demenzen der Deutschen Gesellschaft für Neurologie (DGN) sieht dieser Pfad drei Stufen für die Diagnose der AD vor. Er beginnt mit der syndromalen Abklärung durch niedergelassene Allgemeinmediziner:innen. Neben einer Anamnese und klinischen Untersuchung stehen hierfür Screening-Kurztests wie der Mini-Mental-Status-Test (MMST) und der Montreal Cognitive Assessment Test (MoCA) zur Verfügung. Die zweite Stufe dient dem Ausschluss anderer Ursachen für Demenz mittels bildgebender und Labordiagnostik. Im fachärztlichen Bereich muss abschließend eine ätiologische Diagnose anhand einer Biomarkeranalyse im Liquor, Blut (Aβ42, Aβ42/40-Ratio, p-Tau-181, Total tau, p-Tau 217) oder über Positronenemissionstomografie (Amyloid-PET, Tau-PET) durchgeführt werden.1,2
In der klinischen Praxis sieht Stögmann jedoch große Herausforderungen. Durch die Zulassung neuer Therapieoptionen zur Behandlung der AD könnte es zu mehr Therapieanfragen und Überweisungen aus dem niedergelassenen Bereich in spezialisierte Zentren kommen, wodurch diese überlastet würden. Gleichzeitig besteht weiterhin die Notwendigkeit, auch anderweitige Demenzformen wie frontotemporale Demenz und komplexe Mischformen adäquat zu versorgen. Besonders wichtig ist, die Rechte der Patient:innen dabei nicht außer Acht zu lassen. So darf eine Diagnostik nur mit informierter Zustimmung erfolgen. Außerdem muss auch das Recht auf Nichtwissen gewahrt werden.1
Eine gezielte Fortbildung, eine Erweiterung der Infrastruktur und niederschwellige Angebote im niedergelassenen Bereich sind für den Erfolg neuer Therapien zwingend erforderlich, betont die Vortragende. Eine individualisierte und sorgfältige Kommunikation mit Betroffenen und deren Angehörigen sowie die Schaffung standardisierter Vorgehen nehmen somit eine Schlüsselrolle im Diagnosepfad der AD ein.
Etablierung eines Alzheimer-Boards in Niederösterreich
Die flächendeckende und wohnortnahe Versorgung von Patient:innen mit AD sei vor allem im ländlichen Bereich nur schwer umzusetzen, eröffnete Univ.-Doz. Dr. Christian Bancher, Landesklinikum Horn, seinen Vortrag. In Niederösterreich, dem flächenmäßig größten Bundesland Österreichs, besteht eine dezentralisierte Krankenhausstruktur, welche lediglich zwei Zentral- und fünf Schwerpunktkliniken umfasst. Vor allem für ältere, immobile Patient:innen ist die Behandlung mit neuen Arzneimitteln fast unerreichbar.
Nach dem Vorbild der Onkologie etablierten Bancher und Kolleg:innen ein zentrales Memory-Board, welches die Indikationen und Therapiemöglichkeiten diskutiert und anschließend die Behandlung dezentral organisiert. Konkret könnten Patient:innen in einer Schwerpunktklinik auf Anti-Amyloid-Antikörper eingestellt, über einen Zeitraum von sechs Monaten behandelt und anschließend für die weitere Therapie in lokale Infusionszentren oder den niedergelassenen Bereich in ihrer Nähe überwiesen werden.
Offen ist, so Bancher, allerdings die Kostenfrage, da Kliniken stationär verabreichte Therapien selbst tragen müssen, während Gesundheitskassen für ambulante Behandlungen aufkommen. Hier werden unter anderem Cost-Sharing-Modelle nach dem Vorbild von MS-Therapien ausgewertet.
ARIA als besondere Herausforderung
Neben der frühzeitigen Diagnose und der flächendeckenden Versorgung in der Praxis ist die Anti-Amyloid-Antikörpertherapie selbst auch mit spezifischen Herausforderungen verknüpft. Allen voran nennt Dr. Raphael Wurm, Medizinische Universität Wien, hier die sogenannten „amyloid-related imaging abnormalities“ (ARIA).
Diese potenziell tödlichen Nebenwirkungen treten höchstwahrscheinlich aufgrund einer immunvermittelten Entzündung an amyloidbeladenen Gefäßwänden im Gehirn auf. Durch die Bindung der Antikörper an Amyloid-Plaques kommt es so zu einer unerwünschten Gefäßfragilität und -permeabilität. Bei kleinen Löchern und niedrigem Hirndruck tritt Wasser in das Parenchym ein und führt zu Ergüssen oder Ödemen (ARIA-E). Bei größeren Leckagen kann dagegen Plasma austreten und zu Hämosiderinablagerungen oder superfiziellen Siderosen führen (ARIA-H).4
Ein Hauptrisikofaktor für das Auftreten der Nebenwirkung ist der APOEε4-Trägerstatus. Tatsächlich weisen homozygote Träger des Allels ein um etwa 20% erhöhtes Risiko für ARIA-E und ARIA-H auf.5 Weitere Risikofaktoren umfassen eine hohe Anzahl von Mikrohämorrhagien, die Anwesenheit von superfiziellen Siderosen, hoher Blutdruck und eine hohe Amyloidlast.6 Die Symptome der ARIA präsentieren sich, so der Vortragende, unspezifisch. Patient:innen klagen in der Regel über Kopfschmerzen (50%), eine Veränderung des Bewusstseins (15%), subakute kognitive Verschlechterungen (15%), Schwindel (10%) und Sehstörungen (10%). Eine definitive Diagnose der Nebenwirkung ist nur über MRT möglich und die Evidenz zur Akuttherapie ist derzeit noch begrenzt.
Wichtig ist, dass eine Thrombolyse, beispielsweise bei einem Schlaganfall, unter der Antikörpertherapie eine eindeutige Kontraindikation darstellt, sodass es zwingend erforderlich ist, entsprechende Risikopatient:innen zu identifizieren.
ARIA-Diagnose setzt MRT voraus
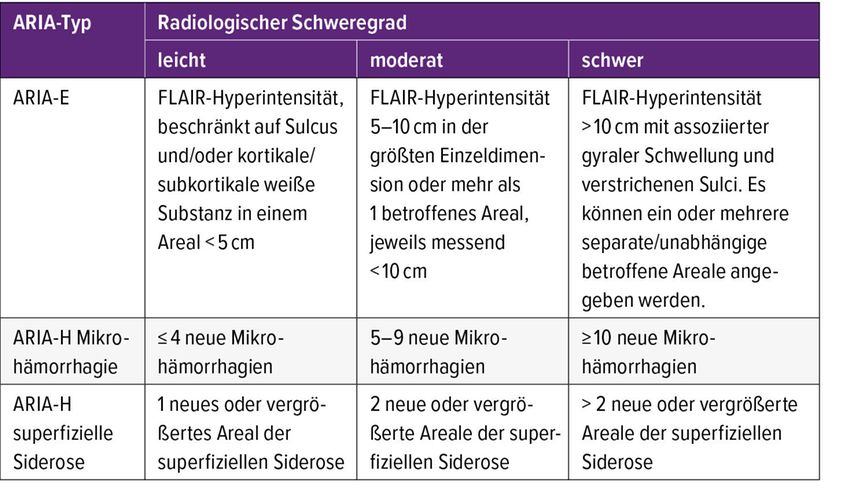
Aus praktischer radiologischer Sicht können ARIA-Ereignisse entweder über T2* Gradient Recall Echo (GRE) oder Suszeptibilitäts-gewichtete (SWI) Sequenzen detektiert werden, erörterte Priv.-Doz. Dr. Lukas Haider, Medizinische Universität Wien. Zum Zeitpunkt des Vortrags führt die T2*-GRE-Sequenz zu einem leitliniengerechten und reproduzierbaren Nachweis von ARIA. Dennoch weist die SWI eine bis zu dreimal höhere Sensitivität auf. Das Nebenwirkungsmanagement von ARIA basiert auf deren klinischem und radiologischem Schweregrad (Tab. 1).7 Bei leichten, asymptomatischen ARIA-E oder ARIA-H kann eine Unterbrechung der Antikörpertherapie in Erwägung gezogen werden. Bei symptomatischen leichten sowie moderaten ARIA-E oder ARIA-H sollte die Therapie unabhängig vom Auftreten von Symptomen unterbrochen, bei schweren Fällen abgebrochen werden.8
Bei moderater Demenz sollten Antikörper abgesetzt werden
Die Frage, ob eine Anti-Amyloid-Antikörpertherapie bei einem Übergang in eine moderate AD beendet werden sollte, ist laut Dr. Matthias Zeller, Kepler Universitätsklinikum, Linz, mit einem klaren Ja zu beantworten. Dies wird auch von der Europäischen Arzneimittelagentur (EMA) empfohlen, da die Sicherheit und Wirksamkeit der Arzneimittel in diesem Stadium nicht belegt sind.9
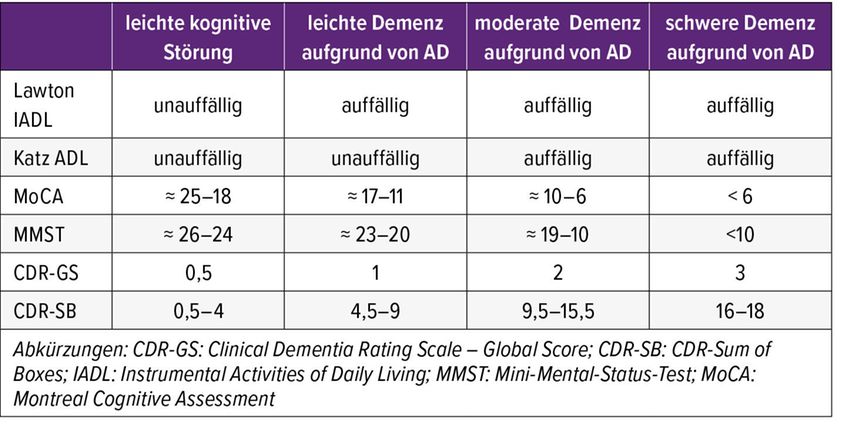
Die Einschätzung, zu welchem Zeitpunkt Patient:innen in ein moderates Stadium der Alzheimerdemenz übergehen, ist allerdings nicht trivial. Screeningtests, wie der MMST, sind laut Zeller dafür häufig nicht ausreichend. Vielmehr ist eine sorgfältige und regelmäßige Beurteilung der kognitiven Leistung sowie der Alltagsfunktion notwendig. So definiert die International Classification of Diseases in der elften Revision (ICD-11) moderate Alzheimerdemenz unter anderem durch Einschränkungen basaler Aktivitäten des täglichen Lebens und schwere Gedächtnisstörungen, die häufig für Außenstehende klar zu erkennen sind.10
In der klinischen Praxis stehen für die Beurteilung der Alltagsfunktionen verschiedene Skalen zur Verfügung. Zeller nennt hier den Katz Index of Independence in Activities of Daily Living (ADL) oder die Lawton & Brody Instrumental ADL, welche in einer deutschen Version zur Verfügung stehen. Diese ermitteln Fähigkeiten wie Nahrungsmittel einkaufen, Wäsche waschen oder Tabletten einnehmen. Um reproduzierbare und valide Ergebnisse zu erhalten, ist ein strukturiertes Interview mit einer Vertrauensperson des Patienten oder der Patientin erforderlich. Dieses muss, mit Einwilligung, in Abwesenheit der betroffenen Person geführt werden und sollte gezielte Fragestellungen und detaillierte Beschreibungen der Alltagssituationen umfassen.
Zeller empfahl, ergänzend zu den ADL-Skalen auch die Kognition anhand des MoCA und optimalerweise auch die Klinik anhand der Clinical Dementia Rating Scale (CDR) zu erheben. Die Kombination der Parameter kann eine relativ einfache Einschätzung des Schweregrads ermöglichen (Tab. 2). Die Beurteilung der Alltagsfunktionen verdeutlicht für Zeller auch, dass der klinische Nutzen von neuen Antikörpertherapien im moderaten Stadium beschränkt ist. Ziel der Arzneimittel sei, den Übergang in fortgeschrittene Erkrankungsstadien, bei denen Patient:innen nicht mehr selbstständig ihren alltäglichen Aktivitäten nachgehen können, hinauszuzögern. Im fortgeschrittenen Stadium ist dies pharmakologisch jedoch nicht mehr möglich.
Komorbide Depression erfordert sorgfältige Beobachtung
Die Demenz ist häufig mit Depression vergesellschaftet, berichtete Dr. Christian Jagsch, Medizinische Universität Graz. Tatsächlich bezifferten Lenouvel et al. anhand eines systematischen Reviews deren Häufigkeit bei leichter Demenz mit 22,1% und bei mittelschwerer Demenz mit 11,6%.11 Umgekehrt gelten die Depression und die damit verknüpfte soziale Isolation als Risikofaktoren für Demenz.12
Zusätzlich kann es zwischen Depression und Demenz zu zahlreichen Überlappungen oder Mischformen kommen. Beispiele umfassen die kognitive Beeinträchtigung als Symptom einer Depression („depressive Pseudodemenz“) oder das depressive Syndrom als Symptom einer Demenz („pseudodepressive Demenz“). Darüber hinaus können beide Krankheitsbilder auch als Folge eines dritten Krankheitsfaktors auftreten.13 Die Definitionskriterien der Depression laut ICD-11 umfassen nun auch den sogenannten kognitiven Cluster, in den auch verminderte Konzentration und Aufmerksamkeit als Teil des Symptomspektrums depressiver Störungen aufgenommen wurden.9 Ähnlich wie für die Beurteilung der Kognition und Alltagsfunktionen stehen auch für die Beurteilung der Depression verschiedene Skalen, wie die geriatrische Depressions-Skala (GDS), zur Verfügung.14
Klinisch unterscheiden sich die Syndrome in unterschiedlichen Aspekten. So beginnt eine Depression eher plötzlich, kognitive Defizite stehen im Hintergrund, Patient:innen sind orientiert und ihre Alltagskompetenz bleibt in der Regel erhalten. Bei Demenzen ist das Gegenteil der Fall.14 Traditionell wurde, so Jagsch, immer zuerst die Depression behandelt und anschließend die Restsymptomatik bewertet.15 Auch die S3-Leitlinie Demenzen schlägt vor, bei Personen mit leichter kognitiver Störung oder Demenz die Symptome einer Depression standardisiert zu erfassen und Maßnahmen wie Bewegungstherapie, kognitive Verhaltenstherapie oder Tanztherapie anzubieten.2
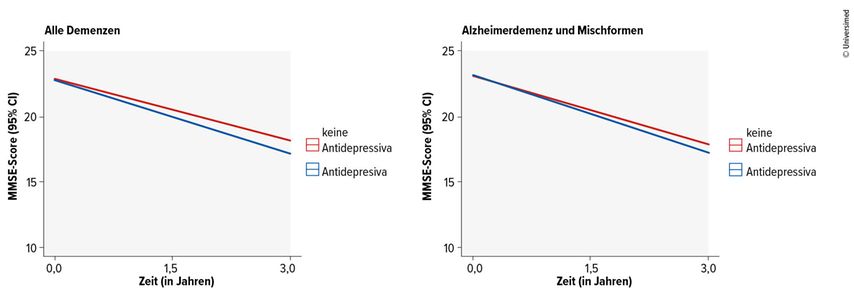
Letztlich schlagen die Leitlinien auch vor, Arzneimittel zur Behandlung von Depressionen bei Alzheimerdemenz einzusetzen.2 Tatsächlich ist die Datenlage, so der Vortragende, in dieser Situation aber limitiert. Anhand systematischer Reviews konnte zwischen verschiedenen Antidepressiva und Placebo kein signifikanter Effekt auf depressive Symptome, kognitive Leistungen, die Lebensqualität oder die Funktionalität nachgewiesen werden.10,16 Hinzu kommt, dass eine schwedische Registerstudie bei knapp 19000 Menschen im Alter von durchschnittlich 78 Jahren mit neu diagnostizierter Demenz feststellte, dass höhere Dosen von selektiven Serotonin-Wiederaufnahmehemmern (SSRI) mit einem höheren Risiko für eine schwere Demenz und Knochenbrüche und einer höheren Gesamtmortalität assoziiert sind (Abb. 2).3
Abb. 2: Kognitive Verschlechterung bei allen Patient:innen mit Demenzsyndrom (links) und bei Patient:innen mit Alzheimerdemenz sowie gemischter Demenz (rechts) unter Behandlung mit Antidepressiva (blau) bzw. ohne Antidepressiva (rot) (modifiziert nach Mo M et al.)3
Jagsch schließt, dass eine ausführliche Abklärung der Depression bei Demenz dringend erforderlich und eine nichtpharmakologische Therapie, vor allem bei älteren Menschen, zu bevorzugen sei. Außerdem sollten Antidepressiva wohlüberlegt eingesetzt und ihre Anwendung sollte engmaschig kontrolliert werden. Der Psychiater hofft, dass in Zukunft blutbasierte Biomarker eine bessere Differenzialdiagnose zwischen Depression und Demenz ermöglichen werden.
Fazit
Die Fortschritte in der Diagnostik und Therapie der AD eröffnen neue Chancen, stellen das Gesundheitssystem aber auch vor erhebliche Herausforderungen. Ein strukturierter Diagnosepfad, spezialisierte Versorgungsstrukturen mit Alzheimer-Boards sowie standardisierte Abläufe sind zentrale Voraussetzungen, um eine rechtzeitige und patient:innenzentrierte Betreuung sicherzustellen. Gleichzeitig erfordert der Einsatz neuer Antikörpertherapien ein sorgfältiges Nebenwirkungsmanagement und klare Kriterien für Beginn und Ende der Behandlung. Entscheidend bleiben eine enge interdisziplinäre Zusammenarbeit, die Berücksichtigung der Patient:innenrechte sowie der Ausbau von Infrastruktur und Fortbildungsangeboten, um nachhaltig eine wirksame und sichere Versorgung zu gewährleisten.
Quelle:
Jahrestagung der Österreichischen Alzheimer Gesellschaft (ÖAG), 17.–19. September 2025, Graz.
Literatur:
1 Benke T, Stögmann E: Diagnosepfad bei Alzheimer-Krankheit und anderen Demenzen. Verfügbar online unter: https://alzheimer-gesellschaft.at/wp-content/uploads/ 2025/05/OAG-Diagnosepfad.pdf , zuletzt abgerufen am 21.09.2025 2 DGN e. V. & DGPPN e. V. (Hrsg.) S3-Leitlinie Demenzen, Version 5.2, 17.07.2025, verfügbar unter: https://register.awmf.org/de/leitlinien/detail/038-013 , zuletzt abgerufen am 21.09.2025 3 Mo M et al.: Antidepressant use and cognitive decline in patients with dementia: a national cohort study. BMC Med 2025; 23(1): 82 4 Sperling R et al.: Amyloid-related imaging abnormalities in patients with Alzheimer‘s disease treated with bapineuzumab: a retrospective analysis. Lancet Neurol 2012; 11(3): 241-9 5 Greenberg SM et al.: Amyloid-related imaging abnormalities: manifestations, metrics and mechanisms. Nat Rev Neurol 2025; 21(4): 193-203 6 Greenberg S et al.: ARIA insights from the donanemab trials (P1-9.001). Neurology 2024; 102(7_supplement_1) 7 Cogswell PM et al.: Alzheimer disease anti-amyloid immunotherapies: imaging recommendations and practice considerations for monitoring of amyloid-related imaging abnormalities. AJNR Am J Neuroradiol 2025; 46(1): 24-32 8 Rabinovici GD et al.: Donanemab: appropriate use recommendations. J Prev Alzheimers Dis 2025; 12(5): 100150 9 Leqembi® aktuelle Fachinformation. Stand Juni 2025 10 ICD-11. Verfügbar online: https://icd.who.int/en/ , zuletzt abgerufen am 25.09.2025 11 Lenouvel E et al.: Antidepressants for treating depression among older adults with dementia: a systematic review and meta-analysis. Psychiatry Res 2024; 340: 116114 12 Livingston G et al.: Dementia prevention, intervention, and care: 2024 report of the lancet standing commission. Lancet 2024; 404(10452): 572-628 13 Wolter DK: Depressionen im höheren Lebensalter, Teil 1. Z Gerontol Geriatr 2016; 49(4): 335-48 14 Sheikh JI et al.: Geriatric depression scale (GDS): recent evidence and development of a shorter version. Clin Gerontol 1986; 5(1-2): 165-73 15 Jagsch C: Altersdepression kommt selten alleine. Ärztekrone; 2022; 23: 16-7 16 He Y et al.: Efficacy of antidepressant drugs in the treatment of depression in Alzheimer disease patients: a systematic review and network meta-analysis. J Psychopharmacol 2021; 35(8): 901-9
Das könnte Sie auch interessieren:
Epilepsie: «Wir können heute die Therapie viel mehr individualisieren»
Jahrhundertelang versuchte man, Epilepsiekranken mit Exorzismus ihre angeblichen «Dämonen» auszutreiben. Heute gibt es mehr als 30 wirksame Medikamente, präzisere Diagnostik und neue ...
Am Wendepunkt für Alzheimer? Global Launch der Landmarkstudien der Lancet Commission on dementia
Die Hôpitaux Universitaires Genève (HUG) und The Lancet luden nach Genève, um die neuen Landmarkstudien zur Therapie und Diagnose der Alzheimerdemenz vorzustellen. Die Studien sollen die ...
Late-breaking News zur Multiplen Sklerose vom ECTRIMS-Kongress 2025
Der 41. ECTRIMS-Kongress fand dieses Jahr in Barcelona statt. Etwa 9600 Teilnehmer tauschten sich über die neuesten Studiendaten zu Multipler Sklerose und assoziierten Erkrankungen aus. ...