Plus de chair sur les os: détection et traitement de la sarcopénie
Auteures:
Dr clin. nutr. Caroline Kiss
Ernährungstherapie/-beratung
Leiterin Klinische Ernährung
Universitäre Altersmedizin FELIX PLATTER, Basel
E-mail: caroline.kiss@felixplatter.ch
Nadine Beerli
Fachverantwortliche Physiotherapie
Universitäre Altersmedizin FELIX PLATTER, Basel
E-mail: nadine.beerli@felixplatter.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Avec l’âge, la masse et la force musculaires diminuent, c’est un processus physiologique. Si ce phénomène se produit de manière excessive, on parle de sarcopénie. Les personnes touchées n’ont pas la force de se lever ou de monter les escaliers et peuvent perdre leur autonomie. Pour faire face au vieillissement de la population, la santé musculaire revêt une importance particulière. C’est pourquoi il convient de dépister précocement les patients présentant une probable sarcopénie et de prendre des mesures afin de préserver le plus longtemps possible leurs capacités d’autosuffisance. Le traitement de la sarcopénie repose sur deux grands facteurs: l’entraînement musculaire et l’alimentation riche en protéines.
Keypoints
-
Pour le traitement de la sarcopénie, l’intervention la plus efficace consiste à combiner l’entraînement musculaire et une alimentation riche en protéines.
-
En cas de sarcopénie, il est recommandé de suivre un entraînement à plusieurs composantes adapté à chaque patient, comprenant un entraînement en force combiné à des composantes d’équilibre et d’endurance.
-
Protéines pour la synthèse musculaire: de 25 à 35g de protéines lors de chaque repas principal et un supplément de protéines de lactosérum ou de protéines de lactosérum enrichies en leucine à proximité dans le temps de la séance d’entraînement.
La perte musculaire liée à l’âge est une problématique complexe pour la santé publique en raison de son impact sur la mobilité et l’autonomie des personnes âgées. En particulier, la sarcopénie, une perte de force, de masse et de fonction musculaires, entraîne un risque nettement accru de chute.1 Ce n’est qu’en 2016 que l’Organisation mondiale de la Santé (OMS) a reconnu la sarcopénie comme une maladie. En 2018, l’European Working Group on Sarcopenia in Older People (EWGSOP2) a publié une révision de sa précédente définition consensuelle.1 La sarcopénie est codifiable en Suisse (CIM-10-GM, M62.50) et est prise en compte en tant que «bilan gériatrique» dans le cadre d’un traitement complexe gériatrique aigu stationnaire.
Les causes de la sarcopénie sont multifactorielles: parmi les facteurs sur lesquels il est possible d’agir figurent l’inactivité physique ainsi que la malnutrition et la sous-alimentation. En revanche, les facteurs comme les changements endocrinologiques liés à l’âge, les processus inflammatoires chroniques et les mécanismes neurodégénératifs ne peuvent être influencés que de manière limitée.
La prévalence globale de la sarcopénie varie entre 10 et 27% selon la définition utilisée et la population étudiée.2 Le taux d’incidence augmente avec l’âge. Dans une étude de prévalence du Centre universitaire de médecine gériatrique Felix Platter (n=305 patient·es; âge médian: 84 ans), la sarcopénie a été diagnostiquée chez une personne hospitalisée sur quatre.3
Recherche de cas et diagnostic
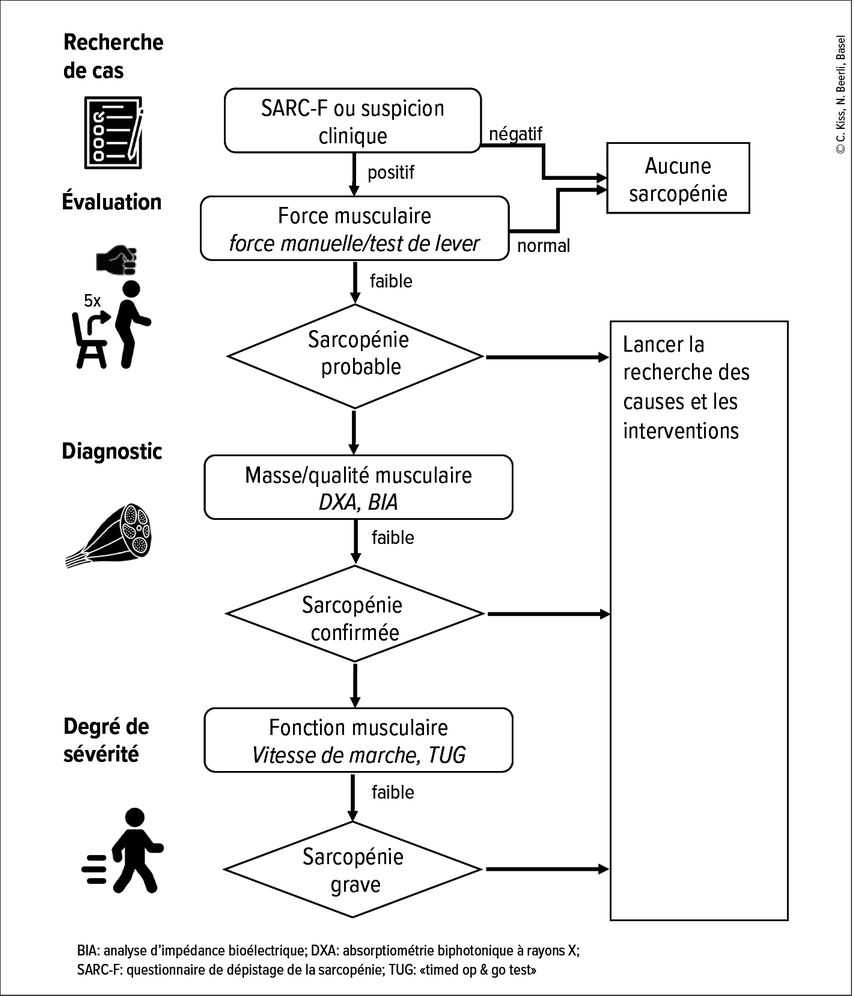
La mise à jour des recommandations consensuelles européennes prévoit un algorithme diagnostique pour reconnaître la présence de sarcopénie (Fig.1). Il est recommandé d’effectuer une recherche de cas en cas de suspicion clinique ou d’utiliser le questionnaire de dépistage SARC-F. Ce questionnaire comporte cinq questions évaluant les difficultés éventuelles rencontrées dans les activités quotidiennes, comme monter les escaliers ou se lever. Le SARC-F a une très grande spécificité et une sensibilité de faible à modérée,4 qui permet de détecter principalement les cas graves. En présence d’un manque de force signalé ou de chutes, ou chez les patients gériatriques, la force musculaire doit être évaluée de manière représentative en évaluant la force manuelle ou en effectuant le test du lever de chaise («chair stand test»). Le test de lever de chaise permet de détecter environ deux fois plus de cas de sarcopénie probable que la mesure de la force manuelle.5 Pour la mesure de la force manuelle, le vigorimètre Martin avec balle à pression est préféré au dynamomètre Jamar par les personnes âgées en raison de son utilisation intuitive et de l’absence de douleur.6 En cas de perte de force musculaire, une sarcopénie est probable, ce qui doit conduire à la détermination des causes et à la mise en place d’interventions. Une quantification de la masse musculaire est nécessaire pour confirmer le diagnostic de sarcopénie. Pour ce faire, la pratique clinique utilise la DXA (absorptiométrie biphotonique à rayons X) et la BIA (analyse d’impédance bioélectrique). La gravité de la sarcopénie est finalement établie en évaluant la fonction musculaire au moyen d’évaluations de la vitesse de marche (p.ex. le test de marche de 10 mètres) ou avec le TUG («timed op & go test»).
Fig. 1: Algorithme de détection et de diagnostic de la sarcopénie dans la pratique clinique (adapté d’après Cruz-Jentoft, 2019)
Parmi les difficultés rencontrées dans la mise en œuvre du diagnostic de la sarcopénie figurent la disponibilité limitée de méthodes instrumentales pour déterminer la masse musculaire et l’absence de valeurs limites en cas d’obésité. Cependant, le rôle prépondérant de la fonction musculaire a maintenant été démontré, ainsi que l’absence de corrélation étroite entre la masse musculaire et l’apparition de déficits fonctionnels. La masse musculaire n’explique que de 30 à 70% de la force musculaire et, outre la masse musculaire, la qualité des muscles est également importante. Les directives proposent comme marqueur de substitution la détermination de la circonférence du mollet en l’absence de méthode instrumentale. La valeur limite proposée de 31cm semble toutefois trop faible, car une circonférence du mollet <34cm chez les hommes et <33cm chez les femmes est déjà associée à une masse musculaire réduite.7 Des recherches supplémentaires sont nécessaires pour objectiver de manière simple la masse et la qualité musculaires dans la pratique clinique quotidienne.
Il existe un premier consensus sur la définition et les critères diagnostiques de l’obésité sarcopénique, mais les seuils et leur validation restent à définir.8 Un indice de masse corporelle élevé s’accompagne d’une masse grasse et musculaire plus importante et peut donc masquer la présence d’une sarcopénie.
Thérapie: entraînement musculaire et alimentation spécifique
La thérapie vise à améliorer la fonction musculaire dans la vie quotidienne. Les approches les plus étudiées pour traiter la sarcopénie sont l’entraînement physique et les mesures nutritionnelles. Une revue publiée récemment conclut que l’entraînement structuré chez les personnes âgées atteintes de sarcopénie permet d’améliorer la force manuelle, la force et la masse musculaire des membres inférieurs, ainsi que la vitesse de marche et la mobilité.9 Une autre revue sur l’entraînement combiné à une quantité adéquate de protéines chez les patients atteints de sarcopénie montre que cette intervention permet d’augmenter la masse et la force musculaire.10
Perte musculaire et prévention
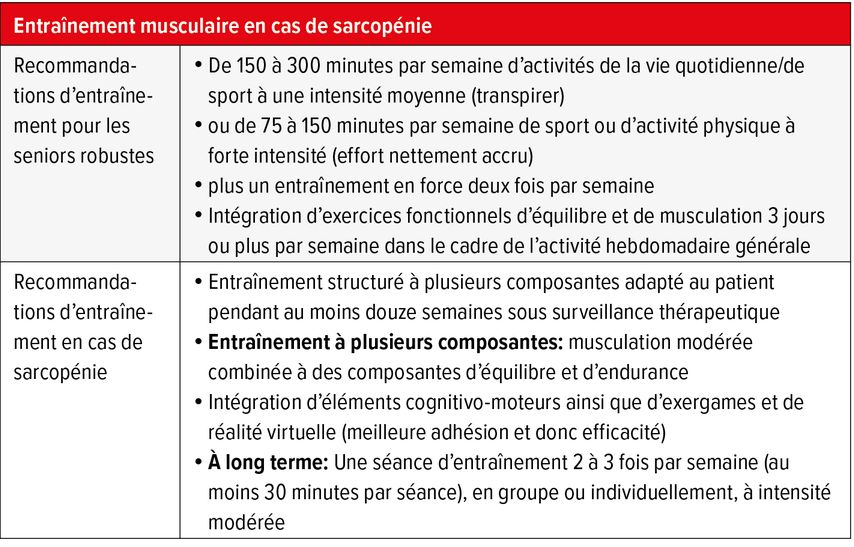
Il est généralement admis que la dégradation musculaire au fil du temps entraîne une perte progressive de la capacité d’effectuer des activités de la vie quotidienne (AVQ) de manière autonome.1,11 L’inactivité physique renforce le processus de dégradation musculaire physiologique lié à l’âge. Dès le plus jeune âge, un mode de vie sédentaire contribue à accélérer cette dégradation, qui s’accentue ensuite avec l’âge. C’est pourquoi la prévention, de préférence dès le plus jeune âge, joue un rôle important. L’Organisation mondiale de la Santé a défini des lignes directrices pour l’activité physique et un mode de vie actif.12 Il est recommandé aux adultes d’effectuer chaque semaine 150 à 300 minutes d’activités de la vie quotidienne ou de sport à une intensité moyenne (associé à une transpiration) ou, à défaut, 75 à 150 minutes de sport ou d’activité physique à une intensité élevée (effort nettement plus soutenu) par semaine. Des combinaisons sont possibles. En outre, un entraînement en force doit être effectué deux fois par semaine. En plus de ces directives, il est recommandé aux adultes de plus de 65 ans de pratiquer un entraînement à plusieurs composantes axé sur l’équilibre fonctionnel et la musculation trois jours ou plus par semaine dans le cadre de leur activité hebdomadaire générale (Tab. 1).
Entraînement musculaire en cas de sarcopénie
Il est recommandé aux patients gériatriques présentant une perte accrue de la force musculaire de suivre un entraînement individuel à plusieurs composantes. Celui-ci repose sur la théorie générale de l’entraînement et doit être effectué de manière guidée pendant au moins douze semaines. Chez les patients sarcopéniques, l’entraînement consiste en une musculation individuelle modérée combinée à des composantes d’équilibre et d’endurance (Tab. 1). Chez les personnes âgées sarcopéniques, un tel entraînement améliore significativement la fonction musculaire.9 Dans les soins gériatriques aigus, l’entraînement individuel à plusieurs composantes décrit ci-dessus permet également d’obtenir des améliorations significatives de la capacité fonctionnelle chez les patients hospitalisés très âgés.13 À long terme, on vise une séance d’entraînement (en groupe ou individuelle) à intensité modérée deux à trois fois par semaine.
L’intégration à l’entraînement musculaire d’éléments cognitivo-moteurs ainsi que d’exergames et de réalité virtuelle est recommandée comme composante supplémentaire. Ceux-ci améliorent la commande neuronale des muscles et donc les mouvements entraînés, ainsi que la motivation et l’adhésion au programme d’entraînement.
Gros plan sur les protéines – besoins et répartition
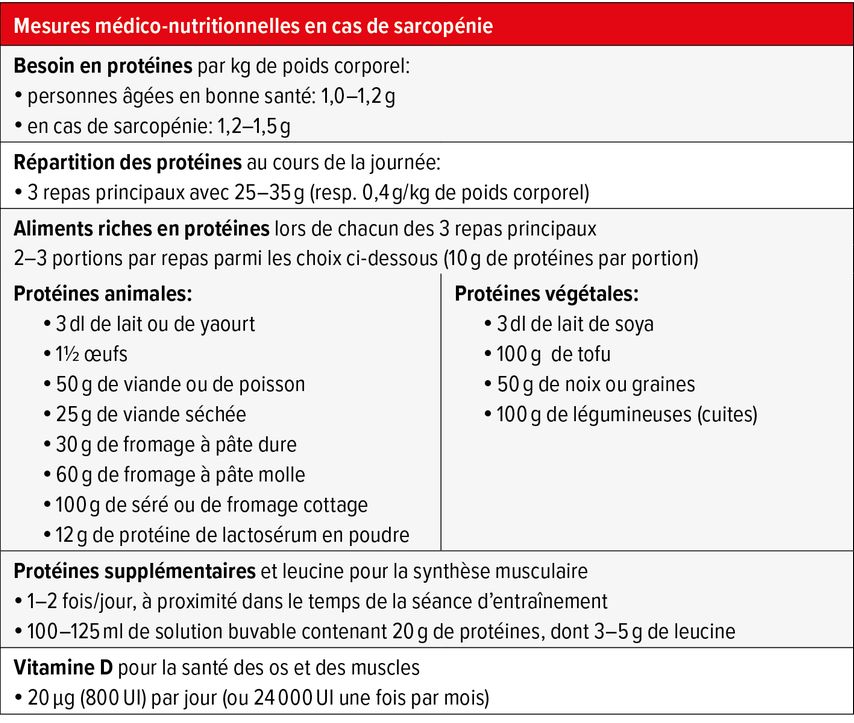
L’apport quotidien recommandé en protéines pour les seniors en bonne santé est de 1,0 à 1,2g/kg de poids corporel (PC) (Tab. 2). Pour un développement musculaire et le traitement de la sarcopénie, les besoins en protéines se situent entre 1,2 et 1,5g/kgdePC. Jusqu’à l’âge moyen, la couverture des besoins en protéines ne pose généralement pas de problème. Cependant, avec l’âge, il devient plus difficile de couvrir les besoins accrus en protéines malgré des besoins énergétiques réduits. Ceux-ci diminuent d’un quart entre les âges de 25 ans et 75 ans. Selon l’étude «MenuCH», une étude transversale représentative de la Suisse, moins de la moitié des seniors ont atteint les recommandations d’au moins 1,0g/kgdePC et seuls 30% ont atteint les recommandations de 1,2g/kgdePC.14 En cas de maladie aiguë et de convalescence, les besoins en protéines sont encore plus élevés.15 Cependant, en raison de l’anorexie liée à la maladie, il est encore plus difficile pour les personnes concernées de couvrir ces besoins. Dans une grande étude suisse, l’apport en protéines n’était que de 0,7g/kgdePC en moyenne au cours de la première semaine d’hospitalisation.16 Il convient donc de procéder à un dépistage standard et, en cas de risque accru de malnutrition, de mettre en place des mesures individuelles appropriées.7
Outre la couverture des besoins, la répartition de la quantité de protéines au cours de la journée est également essentielle. Comparativement aux adultes plus jeunes, la stimulation de la synthèse des protéines musculaires chez les personnes âgées nécessite une quantité totale de protéines nettement plus importante par repas principal, c’est pourquoi il est préférable de répartir la quantité journalière de manière égale sur les trois repas principaux. Chaque repas contenant au moins 25g de protéines a un effet anabolisant, même à un âge avancé. Chaque repas principal devrait donc contenir 25 à 35g de protéines (soit 0,4g/kgdePC).17 Pour contrer la dégradation des protéines pendant la nuit, il est utile de prendre un repas tardif riche en protéines.
Protéine de lactosérum et leucine
Les produits à base de protéines de lactosérum sont particulièrement indiqués en cas de faible appétit et de sensation de satiété précoce. Selon les connaissances actuelles, c’est surtout la leucine (acide aminé) qui est responsable du maintien d’un taux optimal de synthèse des protéines musculaires. Un taux plasmatique de leucine élevé favorise un taux de synthèse musculaire suffisant.18 Idéalement, la prise de protéines devrait avoir lieu à proximité dans le temps d’une séance d’entraînement.19 La protéine de lactosérum a fait ses preuves comme «protéine rapide», car elle est facile à digérer, c’est-à-dire qu’elle traverse rapidement l’estomac, est décomposée en acides aminés individuels et atteint les muscles en peu de temps. La consommation d’une boisson protéinée riche en leucine contribue donc à augmenter considérablement la synthèse musculaire induite par l’entraînement. De plus, la leucine aide le muscle à réparer les microdéchirures causées par l’entraînement et favorise le processus de récupération. Il est donc recommandé de prendre une boisson protéinée à base de lactosérum (contenant de 20 à 30g de protéines) ou un produit protéiné à base de lactosérum enrichi en leucine (contenant de 10 à 20g de protéines, dont 3 à 5g de leucine) dans les 20 à 30 minutes précédant et/ou suivant l’entraînement.
Il est particulièrement intéressant de noter qu’en ajoutant de la leucine à la protéine de lactosérum, la synthèse des protéines musculaires est plus élevée qu’avec deux fois plus de protéines provenant de la caséine. Il existe aujourd’hui sur le marché des formules buvables enrichies en leucine et contenant une faible quantité de glucides et de lipides. Avec environ 150kcal, 20g de protéines par 100ml, elles facilitent la prise pour les patients atteints de maladies liées à l’âge. Cette quantité réduit à peine l’absorption des repas normaux et peut être bue en cinq gorgées. Elles conviennent toutefois aussi aux personnes qui, en raison de leur immobilité ou d’une obésité préexistante, ont des besoins énergétiques réduits et des besoins en protéines accrus. En présence de malnutrition, les formules buvables hypercaloriques enrichies en leucine en petits volumes ont fait leurs preuves, par exemple 125ml à 300kcal et 20g de protéines, deux fois par jour.
Idéalement, cette pratique doit être poursuivie pendant la convalescence, durant au moins trois mois après l’hospitalisation. En Suisse, les formules d’alimentation buvable sont prises en charge par l’assurance de base pour des indications médicales bien définies. On trouve sur le site Internet de la Société Suisse de Nutrition Clinique (www.geskes.ch) des informations à ce sujet, des formulaires de garantie de prise en charge et des prestataires de soins à domicile pour la livraison à domicile.
Conclusion
Un programme d’entraînement et de nutrition structuré et combiné pendant au moins 12 semaines peut entraîner un gain musculaire de 0,5 à 1kg et une augmentation de la force musculaire et de l’endurance d’environ 10%. À première vue, cela semble peu. Toutefois, si l’on considère qu’à partir de l’âge de 50 ans, la masse musculaire diminue de 1 à 2% et la force musculaire, d’environ 1,5%, et même jusqu’à 3% par an à partir de l’âge de 70 ans, cette augmentation est remarquable, voire souvent décisive pour un maintien suffisant des capacités fonctionnelles chez les personnes âgées.
Littérature:
1 Cruz-Jentoft AJ et al.: Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019; 48: 16-31 2 Petermann-Rocha F et al.: Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle 2022; 13: 86-99 3 Bertschi D et al.: Sarcopenia in hospitalized geriatric patients: insights into prevalence and associated parameters using new EWGSOP2 guidelines. Eur J Clin Nutr 2021; 75: 653-60 4 Beaudart C et al.: Sarcopenia in daily practice: assessment and management. BMC Geriatr 2016; 16: 170 5 Johansson J et al.: Differences in sarcopenia prevalence between upper-body and lower-body based EWGSOP2 muscle strength criteria: the Tromsø study 2015-2016. BMC Geriatr 2020; 20: 461 6 De Dobbeleer L et al.: Martin Vigorimeter assesses muscle fatigability in older adults better than the Jamar Dynamometer. Exp Gerontol 2018; 111: 65-70 7 Gomes F et al.: ESPEN guidelines on nutritional support for polymorbid internal medicine patients. Clin Nutr 2018: 37: 336-53 3 8 Donini LM et al.: Definition and diagnostic criteria for sarcopenic obesity: ESPEN and EASO Consensus Statement. Obes Facts 2022; 15: 321-35 9 Wang Het al.: Efficacy of exercise on muscle function and physical performance in older adults with sarcopenia: an ipdated systematic review and meta-analysis. Int J Environ Res Public Health 2022; 19: 8212 10 Kirwan RP et al.: Protein interventions augment the effect of resistance exercise on appendicular lean mass and handgrip strength in older adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr 2022; 115: 897-913 11 Clark BC, Manini TM: Functional consequences of sarcopenia and dynapenia in the elderly. Curr Opin Clin Nutr Metab Care 2010; 13: 271-6 12 WHO guidelines on physical activity and sedentary behaviour. 2020. https://www.who.int/publications/i/item/ 9789240015128 ; zuletzt aufgerufen 9.12.2022 13 Martínez-Velilla N et al.: Effect of exercise intervention on functional decline in very elderly patients during acute hospitalization: a randomized clinical trial. JAMA Intern Med 2019; 179: 28-36 14 Kopf-Bolanz K, Walther B: Proteinkonsum in der Schweiz – Auswertung des menuCH Datensatzes Schweizer Ernährungsbulletin 2021; 130-46 15 Phillips SM et al.: Optimizing adult protein intake during catabolic health conditions. Adv Nutr 2020; 11: 1058-69 16 Schuetz P et al.: Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial. Lancet 2019; 393: 2312-21 17 Rondanelli M et al.: Where to find leucine in food and how to feed elderly with sarcopenia in order to counteract loss of muscle mass: practical advice. Front Nutr 2021; 7: 622391 18 Devries MC et al.: Protein leucine content is a determinant of shorter- and longer-term muscle protein synthetic responses at rest and following resistance exercise in healthy older women: a randomized, controlled trial. Am J Clin Nutr 2018; 107: 217-26 19 Trommelen J et al.: The muscle protein synthetic response to meal ingestion following resistance-type exercise. Sports Med 2019; 49: 185-97
Das könnte Sie auch interessieren:
Tachycardie supraventriculaire
Les tachycardies paroxystiques supraventriculaires régulières apparaissent généralement chez des patients sans cardiopathie structurelle. Dans cet article, nous discutons de l’importance ...
Risques du tabagisme pour la santé – sevrage tabagique
«Un fumeur avide qui lit et relit l’importance des risques du tabagisme pour sa santé cesse dans la plupart des cas ... de lire», avait déclaré Winston Churchill. «Le tabac est le seul ...
Diabète et foie
De nombreuses personnes souffrant d’obésité ou de diabète de type 2 (DT2) développent au cours de leur vie une maladie hépatique stéatosique associée à un dysfonctionnement métabolique ( ...