«Treat-to-target» dans le traitement de l’asthme
Compte-rendu:
Reno Barth
Journaliste médical
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La prise en charge de l’asthme bronchique sévère demeure un défi. Un document de consensus appelle désormais à l’adoption du concept «treat-to-target», issu de la rhumatologie, afin de pouvoir intervenir mieux et plus tôt à l’avenir et ainsi prévenir le développement d’un asthme sévère.
Selon le Prof. Celeste Porsbjerg de l’Hôpital Bispebjerg de Copenhague, l’asthme sévère est généralement une situation «terminale» dans la pratique clinique, dont les patients se remettent rarement complètement. Il est donc très important d’empêcher toute évolution vers un asthme sévère. Pour ce faire, il est essentiel de mieux comprendre les mécanismes qui aboutissent au développement d’un asthme sévère. La Tasmanian Health Population Study, qui a identifié différentes trajectoires de l’asthme dans une vaste cohorte, fournit des informations importantes pour aider à répondre à cette question.1 Entre autres résultats, on a constaté que les patients souffrant d’asthme précoce présentaient un risque significativement plus élevé de BPCO plus tard dans la vie. Bien que d’autres formes d’asthme présentent également un risque accru de développer une obstruction permanente des voies aériennes par rapport à la population normale, ce risque n’était pas aussi élevé, et de loin, que dans le cas de l’asthme précoce. On suppose que la cause en est un développement insuffisant des poumons chez les enfants asthmatiques. En revanche, l’asthme tardif était associé au diabète, à la dyslipidémie et à d’autres comorbidités.
Modifications chroniques des voies aériennes
Ces risques accrus sont dus au fait que l’asthme se caractérise non seulement par une obstruction épisodique mais aussi par une obstruction continue croissante des voies aériennes, laquelle prédispose aux exacerbations.2 Une susceptibilité particulière aux infections virales a été identifiée comme un facteur de risque important responsable des exacerbations sévères que connaissent certains patients asthmatiques. La cause: une immunoréactivité accrue des voies aériennes, qui se développe de manière analogue à l’hyperréactivité et qui est responsable des épisodes inflammatoires sévères au cours des exacerbations de l’asthme. Selon C. Porsbjerg, cet effet est absent chez les patients dont l’asthme est stable et bien traité. Il est donc important, dans la pratique clinique, de demander aux patients asthmatiques comment ils font face aux infections banales et si leur traitement a une influence sur celles-ci.
Des études récentes fournissent également des indices précieux quant à des modifications de l’épithélium des voies aériennes, lesquelles peuvent contribuer à l’exacerbation des symptômes. Par exemple, une inflammation T2 persistante entraîne une augmentation des cellules productrices de mucus ainsi qu’un dysfonctionnement des mécanismes de réparation de l’épithélium, ce qui limite la guérison des inflammations. De tels phénomènes ont été mis en évidence dans diverses formes d’asthme. Il peut en résulter un cercle vicieux fait d’une inflammation croissante, d’une augmentation de la production de mucus et, finalement, d’une restriction à long terme de la fonction pulmonaire.3 Ce qui soulève la question de savoir comment ces nouvelles découvertes peuvent influencer la gestion pratique de la maladie. Dans ce contexte, C. Porsbjerg souligne l’importance des nouveaux agents biologiques qui permettent une intervention ciblée dans certaines voies inflammatoires.
À la recherche d’une définition de la rémission
Dans l’ensemble, les preuves vont dans le sens des effets positifs à long terme d’un contrôle de l’asthme le plus efficace possible. Ainsi, le principe du «treat-to-target», connu en rhumatologie, se prête également à la pneumologie. «Treat-to-target» signifie que le traitement doit viser à atteindre des objectifs définis dans des délais déterminés. Si les objectifs – de préférence la rémission – ne sont pas atteints, le traitement doit être intensifié ou, si les options d’intensification ont été épuisées, varié. L’objectif de cette procédure est la prévention à long terme des dommages structurels. En rhumatologie, un grand nombre de médicaments dits modificateurs de la maladie (DMARD) sont désormais disponibles à cet effet. Dans le traitement de l’asthme, le choix est encore beaucoup plus restreint. De plus, la rémission n’est pas encore un objectif thérapeutique établi, dit C. Porsbjerg. Par conséquent, il n’existe actuellement aucune définition généralement acceptée de la rémission.
Une déclaration de consensus récemment publiée vise à apporter des éclaircissements. À cette fin, les définitions de la rémission dans d’autres maladies inflammatoires ainsi que les définitions de la rémission de l’asthme spontané ont d’abord été analysées. On a ensuite tenté de définir la rémission clinique de l’asthme dans le cadre d’un traitement à partir de ces définitions. Sont requis:
-
au moins 12 mois sans symptômes et exacerbations significatifs (en faisant appel à des instruments validés),
-
optimisation et stabilisation de la fonction pulmonaire,
-
constatation concordante de la rémission par le patient et le praticien,
-
pas d’utilisation de corticostéroïdes systémiques.
De surcroît, il existe également une nouvelle définition de la rémission complète, pour laquelle un contrôle stable des marqueurs inflammatoires et un test de provocation négatif sont en outre requis. À l’avenir, ces définitions seront également utilisées comme critères d’évaluation pour les essais cliniques.4 Selon C. Porsbjerg, une rémission complète signifie un contrôle total de l’inflammation au stade T2. Cependant, la validation de ces critères dans des essais cliniques n’est toujours pas intervenue. À l’heure actuelle, il y a encore plus de questions que de réponses. Avant tout, une question qui demeure sans réponse est, selon elle, de savoir quel degré de rémission est nécessaire pour améliorer le pronostic à long terme.
GINA: escalade et désescalade progressives
Dans la lignée du concept «treat-to-target», le Prof. Marco Idzko de l’Université médicale de Vienne a souligné l’importance de l’inflammation dans le développement et la progression de l’asthme bronchique. L’inflammation étant à l’origine de l’hyperréactivité des voies aériennes et des symptômes de l’asthme, il est nécessaire de maîtriser cette inflammation le plus tôt possible dans l’évolution de la maladie. C’est pourquoi la recommandation actuelle de la Global Initiative for Asthma (GINA) d’utiliser des corticostéroïdes inhalés (CSI) dès le début de la maladie revêt une importance particulière. Les bronchodilatateurs à courte durée d’action (SABA), qui augmentent le risque de réactions asthmatiques tardives et d’inflammation chronique, doivent être considérés de manière très critique dans ce contexte. En revanche, l’utilisation de CSI pour le contrôle des symptômes réduit ces effets à long terme et donc aussi le risque d’exacerbations sévères. M. Idzko déconseille généralement l’utilisation des SABA, sans exception.
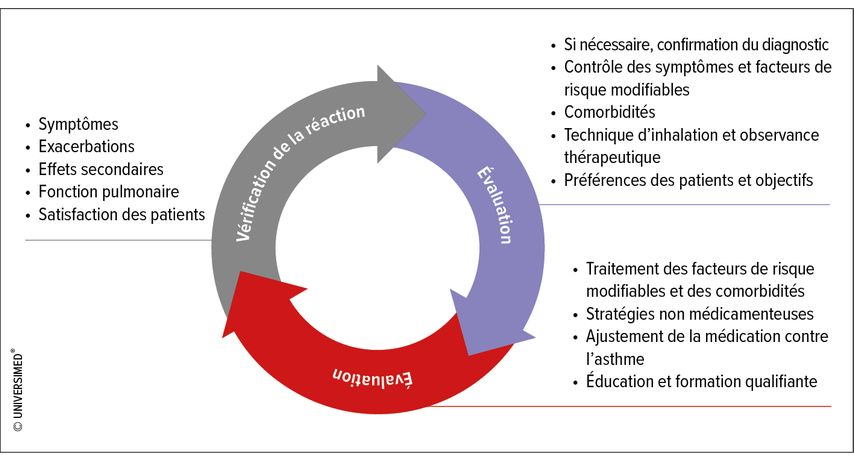
Pour le traitement de l’asthme, GINA a défini en 2020 l’«asthma management cycle»,5 qui n’est pas différent du concept «treat-to-target» et prévoit des ajustements du traitement en fonction des symptômes, des exacerbations, de la fonction pulmonaire, etc. (Fig. 1). Le diagnostic doit également être remis en question et réexaminé à plusieurs reprises au cours de ce cycle. Les ajustements du traitement s’effectuent en fonction du schéma de niveaux de GINA, et les mesures non médicamenteuses prennent de plus en plus d’importance. GINA recommande non seulement l’escalade du traitement si elle s’avère nécessaire, mais aussi la désescalade si elle est possible. Si la maîtrise de l’asthme se détériore lors de cette désescalade, le traitement doit à nouveau être monté en puissance. En outre, il faut se demander si de nouveaux facteurs, comme l’exposition à des allergènes, ne contribuent pas à l’aggravation des symptômes.
M. Idzko insiste sur la mise en œuvre simple des recommandations de GINA aux niveaux 1 à 4. Si aucun contrôle suffisant n’est obtenu avec un CSI ou un CSI plus un LABA (bêta-agoniste à longue durée d’action), le traitement doit être complété par un LAMA (anticholinergique à longue durée d’action). En outre, une recommandation est émise en faveur des antagonistes des récepteurs des leucotriènes, M. Idzko soulignant le peu de preuves pour ces substances en association avec LAMA/LABA et insistant sur le fait qu’il ne les utilise pas dans cette indication.
Asthme sévère contre asthme difficile à traiter
Si le contrôle de l’asthme n’est pas obtenu avec les CSI/LABA/LAMA ou si des corticostéroïdes oraux doivent être utilisés, on parle d’asthme sévère (niveau 5 de GINA). À ce niveau, cependant, GINA recommande de faire d’abord la différence entre l’asthme sévère et l’asthme difficile à traiter. Ce dernier est établi si, par exemple, une mauvaise observance ou des erreurs dans la technique d’inhalation sont à l’origine du manque de contrôle. Si ces limitations peuvent être exclues et que l’asthme est effectivement sévère, l’étape suivante est le phénotypage basé sur les biomarqueurs, qui est une condition préalable à l’utilisation de thérapies ciblées. On distingue l’asthme allergique sévère – «high T(h)2» – de l’asthme T2 éosinophile non allergique, le premier se caractérisant, entre autres, par des taux d’IgE élevés, tandis que dans le second, le nombre d’éosinophiles est constamment élevé, quelle que soit la saison. En outre, on pense qu’il existe également un asthme de type «low T2», mais son existence en tant qu’entité distincte a récemment fait l’objet de discussions. L’asthme allergique sévère est traité par l’omalizumab, un anticorps IgE. Pour l’asthme éosinophilique, l’anticorps anti-récepteur de l’IL-5, le benralizumab, ou les anticorps anti-IL-5, le mépolizumab et le reslizumab, peuvent être envisagés. Une option relativement nouvelle dans l’asthme éosinophilique aussi bien allergique que non allergique est l’anticorps dupilumab dirigé contre la chaîne alpha du récepteur de l’IL-4 (IL-4Ra). Le traitement de l’asthme «low T2» est difficile. Les options possibles sont les immunomodulateurs tels que l’acithromycine ou les inhibiteurs de la PDE-4 connus pour le traitement de la BPCO.
Source:
Satellites virtuels de l’ERS, 2 mars 2021
Littérature:
1 Bui DS et al.: Lancet Respir Med 2021; 9: 387-96 2 Gauvreau GM et al.: Eur Respir J 2015; 46: 819-31 3 Vieira Braga FA et al.: Nat Med 2019; 25: 1153-63 4 Menzies-Gow A et al.: J Allergy Clin Immunol 2020; 145: 757-65 5 https://ginasthma.org/ ; dernier accès 30.3.2021
Das könnte Sie auch interessieren:
Tachycardie supraventriculaire
Les tachycardies paroxystiques supraventriculaires régulières apparaissent généralement chez des patients sans cardiopathie structurelle. Dans cet article, nous discutons de l’importance ...
Risques du tabagisme pour la santé – sevrage tabagique
«Un fumeur avide qui lit et relit l’importance des risques du tabagisme pour sa santé cesse dans la plupart des cas ... de lire», avait déclaré Winston Churchill. «Le tabac est le seul ...
Diabète et foie
De nombreuses personnes souffrant d’obésité ou de diabète de type 2 (DT2) développent au cours de leur vie une maladie hépatique stéatosique associée à un dysfonctionnement métabolique ( ...