Warum es eine kardiologische Lipidambulanz braucht
Autor:
OA Dr. Jürgen Nowy
3. Med. Abteilung Universitätsklinik
St. Pölten und Ordination Herz im Zentrum
Alte Bahngasse 1/11,
3034 Maria Anzbach
E-Mail: nowy@herzimzentrum.com
Vertrauen des Patienten in das Behandlungskonzept für eine rasche, aggressive und langfristige Lipidkontrolle ist ein entscheidender Therapiefaktor. Dies erfordert ein hohes Ausmaß an ärztlicher Aufklärung und Nachsorge im Zusammenspiel aller behandelnden Ärzt:innen sowohl innerklinisch wie auch im niedergelassenen Bereich. Lipidambulanzen spielen dabei eine wichtige Rolle.
Keypoints
-
Herz-Kreislauf-Erkrankungen sind weiterhin die häufigste Todesursache und erhöhtes LDL-Cholesterin einer der wichtigsten Faktoren in der Entstehung der Atherosklerose.
-
Es steht ein breites und kombinierbares medikamentöses Arsenal zur Verfügung, um eine aggressive Lipidkontrolle zu erreichen.
-
Das verfügbare Spektrum zur evidenzbasierten medikamentösen Kontrolle weiterer Lipidparameter wird sich in naher Zukunft erweitern.
Laut Todesursachenstatistik der Statistik Austria sind im Jahr 2022 32000 Personen in Österreich an Herz-Kreislauf-Erkrankungen gestorben, damit sind diese für knapp 34% aller Sterbefälle verantwortlich. Obwohl die Mortalität durch die Erkrankung von ca. 800/100000 Einwohnern im Jahre 1980 bis auf ca. 345/100000 im Jahr 2022 gesenkt werden konnte, bleibt sie die häufigste Todesursache in Österreich.12 Die wichtigsten dafür verantwortlichen Risikofaktoren sind:
arterieller Hypertonus
-
Diabetes mellitus
-
Nikotinkonsum
-
Hyperlipidämie
-
chronische Niereninsuffizienz
-
männliches Geschlecht
steigendes Lebensalter
Das kardiovaskuläre Risiko ist definiert durch das Zusammenspiel mehrerer Risikofaktoren unterschiedlicher Gewichtung. Je früher, konsequenter und anhaltender es gelingt, die Risikofaktoren zu kontrollieren, umso höher ist die Wahrscheinlichkeit, ein höheres Lebensalter gesund zu erreichen. Mit der Kombination mehrerer im etwa gleichen Ausmaß erhöhter Risikofaktoren steigt die Wahrscheinlichkeit für ein negatives Ereignis; es kann aber auch ein überproportional stark ausgeprägter Risikofaktor bestimmend für das Risiko sein.
LDL-Cholesterin als Risikofaktor
Leider ist ein – genetisch determinierter – erhöhter Spiegel an LDL-Cholesterin (LDL-C) bei einem hohen Prozentsatz der Bevölkerung vorhanden. LDL-C-Spiegel >150mg/dl sind häufig zu finden und erfüllen keinen physiologischen Zweck, umgekehrt haben sehr niedrig liegende LDL-C-Werte keinen negativen biologischen Effekt. Die Höhe des LDL-C-Spiegels hängt nur in geringem Ausmaß von Ernährung, Bewegung und Körpergewicht ab. Es besteht ausreichend Evidenz, um den kausalen Zusammenhang von erhöhtem LDL-C und anderen Apolipoprotein-B-tragenden Molekülen in der Entstehung und Progression der Atherosklerose als gegeben anzusehen. Sowohl die Dauer der Exposition wie auch deren Größenordnung bestimmen das Risiko.11
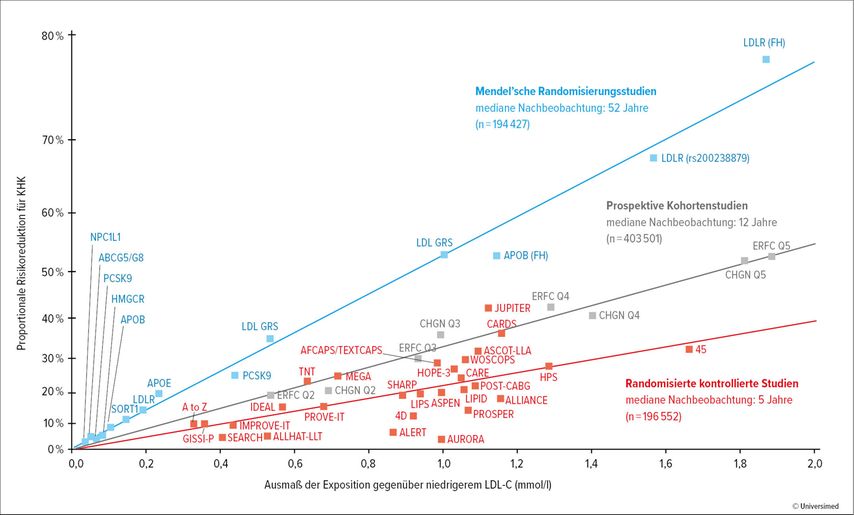
Die Analyse von genetisch bedingt niedrigen LDL-C-Spiegeln im Rahmen von Mendel’schen Randomisierungsstudien zeigt, das ein lebenslang niedriges LDL-C mit einer sehr geringen Wahrscheinlichkeit, ein atherosklerotisches Folgeereignis zu erleiden, einhergeht. Daraus ergibt sich, dass je früher und aggressiver LDL-C-Spiegel gesenkt werden, desto größer der Effekt der kardiovaskulären Risikoreduktionist. Es wurde gezeigt, dass eine Senkung des LDL-C-Spiegels um 38,6mg/dl zu einer jährlichen kardiovaskulären relativen Risikoreduktion von 22% führt (Abb. 1).1
Abb. 1: Logarithmisch-linearer Zusammenhang zwischen der Veränderung des Low-Density-Lipoprotein-Cholesterins (LDL-C) und dem kardiovaskulären Risiko in der Metaanalyse der Cholesterol Treatment Trialists’ (CTT) Collaboration (modifiziert nach Baigent C et al. 2010)1
Lange Zeit war es gelebte Praxis und Empfehlung, erst nach einem stattgehabten kardiovaskulären Ereignis eine aggressive LDL-C-Senkung zu beginnen. Heutzutage dagegen sollte nicht nur nach einem erfolgten Ereignis eine schnelle und aggressive Senkung des LDL-C-Spiegels auf Werte <55mg/dl erzielt werden, sondern bereits in der Primärprophylaxe das individuelle kardiovaskuläre Risiko anhand definierter Berechnungsmodelle bestimmt werden(Tab. 1). Dieses soll mit dem Patienten besprochen und gegebenenfalls frühzeitig medikamentös interveniert werden.2
Daraus ergibt sich, bei zunehmender Spezialisierung der medizinischen Fachbereiche, die Notwendigkeit, die Evaluierung und Einleitung einer Therapie auch in die Mitverantwortung der behandelnden medizinischen Fachgruppen zu geben. Denn beispielsweise wird eine Koronarangiografie, die ohne PCI bzw. Stentimplantation endet, in der medizinischen Außenwahrnehmung oft als „Ausschluss-Angiografie“ bezeichnet. Und es mögen dabei auch tatsächlich hämodynamisch signifikante Stenosen ausgeschlossen worden sein, dennoch können je nach Gefäß und Lokalisation bereits mittel- bis hochgradige Stenosen vorliegen, die aber (noch) keiner Intervention bedürfen. Somit liegt kein „Ausschluss“ einer koronaren Herzkrankheit (KHK), sondern oft bereits eine ausgeprägte KHK vor, deren Progression es zu stoppen gilt. Die richtige Einschätzung kardiologischer Befunde und das Ziehen therapeutischer Konsequenzen ist Metier der Kardiologie.
Der mit Abstand wichtigste und am besten erforschte Parameter ist LDL-C, es ist der Hauptproponent der Lipoprotein-B-tragenden Lipoproteine. Es wird zumeist indirekt als LDL-C berechnet – in bestimmten Fällen, wie zum Beispiel einer exzessiven Triglyzeriderhöhung, muss es direkt gemessen werden. Zu beachten gilt es, dass aktuell die Kosten für eine Bestimmung von LDL-C von den meisten österreichischen Krankenkassen einmal pro Quartal übernommen werden, was bedeutet, dass bei häufigeren Kontrollen im Rahmen von Therapieänderungen die Bestimmung als Privatleistung gefordert ist, welche jedoch um wenige Euro zu haben ist.
Behandlungsziele und Therapiemöglichkeiten
Im Laufe der letzten Jahre wurden im Einklang mit dem wissenschaftlichen Erkenntnisgewinn hinsichtlich der Bedeutung einer aggressiven Lipidkontrolle für die Krankheitskontrolle des atherosklerotischen Kontinuums sowohl die Behandlungsziele immer weiter nach unten revidiert als auch die Indikationsstellungen für einen Therapiebeginn ausgeweitet. Dies führt immer wieder zu Verwirrung bei Patienten, da Werte, die in Arzt-Patienten-Gesprächen vorher als „normal“ bewertet wurden, nun als krankhaft und therapiebedürftig eingeschätzt werden. Hier bedarf es viel Auf- und Erklärung, um die Notwendigkeit einer lipidsenkenden Therapie auf eine robuste Basis im Arzt-Patienten-Verhältnis zu stellen.
Kardiovaskuläre Risikoabschätzung
Patienten mit entweder vorbekannter koronarer Herzkrankheit, Diabetes mellitus 1 oder 2, chronischer Niereninsuffizienz oder individuell besonders stark ausgeprägten Risikofaktoren haben definitionsgemäß ein hohes oder sehr hohes kardiovaskuläres Risiko. Für diese Patienten wird eine systematische Risikoabschätzung nicht empfohlen, da eine Behandlung sämtlicher kardiovaskulärer Risikofaktorenbereits obligat ist. Bei offensichtlich Gesunden wird empfohlen, Männer ab dem 40. Lebensjahr und Frauen ab dem 50. Lebensjahr routinemäßig einer kardiovaskulären Risikoabschätzung mittels evaluierter Methoden wie des SCORE2 zu unterziehen. Dieser wird regelmäßig weiterentwickelt und istonline unter https://www.heartscore.org/en_GB bzw. als App verfügbar und praktikabel.
Kardiovaskuläres Risiko und LDL-C-Ziel
Sehr hohes kardiovaskuläres Risiko Ziel: Absenken des LDC-Spiegels um über 50% und LDL-C <55mg/dl
Ein sehr hohes kardiovaskuläres Risiko liegt vor nach einem stattgehabten kardiovaskulären Ereignis oder sehr hohes Risiko, ein solches zu erleiden, besteht bei:
-
DM 2 mit Endorganschaden oder mindestens 3 kardiovaskulären Risikofaktoren
-
DM 1 seit >20 Jahren
-
hochgradige chronische Niereninsuffizienz, eGFR <30ml/min/1,73m2
-
familiäre Hyperlipidämie mit mind. einem weiteren kardiovaskulären Risikofaktor
-
mittels SCORE2errechnetes sehr hohes altersabhängiges kardiovaskuläres Risiko
Hohes kardiovaskuläres RisikoZiel: LDL-C <70mg/dl
-
stark erhöhte einzelne Risikofaktoren (imBesonderen Cholesterin gesamt >310mg/dl, LDL-C >190mg/dl, RR syst >180/110mmHg)
-
mittelgradig eingeschränkte Nierenfunktion, eGFR 30–59ml/min/1,73m2
-
DM 2 ohne Endorganschaden, aber Dauer >10 Jahre oder weiterem Risikofaktor
-
mittels SCORE2 kalkuliertes hohes altersabhängiges kardiovaskuläres Risiko, familiäre Hyperlipidämie ohne weiteren Risikofaktor
Moderates kardiovaskuläres Risiko Ziel: LDL-C <100mg/dl
-
junge Patienten mit Typ-1-Diabetes unter 35 Jahren bzw. Typ-2-Diabetes unter 50 Jahren und einer Erkrankungsdauer <10 Jahren ohne weiteren Risikofaktor
-
mittels SCORE2 errechnetes altersabhängig moderates kardiovaskuläres Risiko
Geringes kardiovaskuläres Risiko Ziel: LDL-C <116mg/dl
-
mittels SCORE2 errechnetes altersabhängig geringes kardiovaskuläres Risiko
Medikamentöse Therapie
Es besteht weitgehender Konsens, dass der Effekt der kardiovaskulären Risikoreduktion durch die Amplitude der LDL-C-Senkung erreicht wird und unabhängig von der verwendeten Medikamentengruppe ist. Eine Kombination verschiedener Wirkmechanismen ist zu bevorzugen. Welche Substanzgruppen aktuell zur Verfügung stehen, zeigt die folgende Aufstellung.
Cholesterolsynthese-Medikamente
Statine
Statine hemmen die Cholesterolsynthese in der Leber durch Inhibierung der HMG-CoA-Reduktase als geschwindigkeitsbestimmendes Enzym des Cholesterinaufbaus. Dies führt zu einer Hochregulierung der LDL-C-Rezeptoren an der Leberzelle mit vermehrter Aufnahme von LDL-C und damit Absinken des LDL-C-Spiegels. Empfohlen ist die Verwendung hochpotenter Statine; aktuell zugelassen in Österreich sind Atorvastatin und Rosuvastatin. Es ist zu beachten, dass Rosuvastatin bei hochgradig eingeschränkter Nierenfunktion mit einer GFR <30ml/min kontraindiziert ist und bei mittelgradiger Niereninsuffizienz mit einer GFR 30–59ml/min die maximale Dosis 20mg beträgt. Die lipidsenkende Wirkung der Statine ist zwar dosisabhängig, aber nicht linear, sodass bereits mit geringen Dosen ein Großteil der möglichen Wirkung erzielt werden kann:3
Rosuvastatin:
5mg – LDL-C minus 30–40%
20mg – LDL-C minus 50–55%
40mg – LDL-C minus 55–60%
Atorvastatin:
10mg – LDL-C minus 30–40%
40mg – LDL-C minus 45–50%
80mg – LDL-C minus 50–55%
Nachdem auch die am häufigsten wahrgenommene Nebenwirkung, die statininduzierten Muskelschmerzen (SAM),dosisabhängig ist, werden bei intraktablen Muskelschmerzen nach Ausschluss anderer Gründe ein Auslassversuch und Wiederbeginn mit einem alternativen Hochpotenzstatin in geringerer Dosis empfohlen.3 SAM sind selten und werden oft, aber nicht immer, von einem Nocebo-Effekt ausgelöst. Die sehr seltene statininduzierte Myopathie, die mit Schmerzen und/oder Schwäche und einer signifikanten Erhöhung der Serumkreatininkinase (CK) und einer Inzidenz von ca. 1:20000 einhergeht, bedingt die sofortige Absetzung des Statins, da das Fortführen der Therapie zum Vollbild der Rhabdomyolyse (Inzidenz 1:100000) führen kann.3
Ezetimib
Ezetimib hemmt die intestinale Cholesterinaufnahme, bewirkt eine LDL-C-Senkung von 15–20% und erreicht dies auch in Kombinationstherapie mit Cholesterinsynthesehemmern. Ezetimib ist ein unerlässlicher Pfeiler der lipidsenkenden Therapie und insbesondere als Kombinationspartner sehr sinnvoll. Im Rahmen der IMPROVE-IT-Studie konnte die additive Gabe von 10mg Ezetimib zu 40mg Simvastatin bei Patienten nach akutem Koronarsyndrom nicht nur LDL-C auf 55mg/dl (Kontrollgruppe 70mg/dl) senken, sondern auch eine signifikante Reduktion der Ereignisrate bewirken.4 Gerade im Sinne, das LDL-C nicht nur effektiv, sondern auch schnell abzusenken, empfiehlt es sich daher, bei der Initiation einer lipidsenkenden Therapie im Rahmen eines kardiovaskulären Akutereignisses gleich mit der Kombination eines Hochpotenzstatins und Ezetimib zu beginnen. Ein laborchemisches Monitoring ist nicht notwendig, Nebenwirkungen sind rar.
Bempedoinsäure
Bempedoinsäure ist aktuell als Mono- (Nilemdo®) oder als Kombinationspräparat mit Ezetimib 10mg (Nustendi®) in der Einheitsdosis von 180mg zur einmal täglichen Einnahme verfügbar. Bempedoinsäure ist ein Inhibitor der Adenosintriphosphat-Citrat-Lyase und hemmt – wie auch Statine – die Cholesterolsynthese. Bempedoinsäure ist eineProdrug, die in der Leber aktiviert wird und damit kaum Wirkung an anderen Organen zeigt. Seit Kurzem liegt ein klinischer Wirksamkeitsnachweis in der Verringerung kardiovaskulärer Endpunkte bei Patienten mit Statinintoleranz vor, wo der LDL-C-Spiegel von durchschnittlich 100mg/dl durch 180mg Bempedoinsäure um 20% reduziert werden konnte.5 Bempedoinsäure kommt sowohl als Alternative zu Statinen bei Statinunverträglichkeit,als auch additiv zu Statinen bei Nichterreichen der Zielwerte zum Einsatz. Zu beachten ist, dass Bempedoinsäure nicht die gleiche Effektivität wie Hochpotenzstatine, Inclisiran oder PCSK9-Hemmer aufweist und in der Kombinationstherapie den Wirkspiegel von Statinen erhöht, welche in diesem Fall auf die Hälfte der maximal zugelassenen Dosis reduziert werden müssen.
PCSK9-aktive Substanzen
PCSK9 (Proproteinkonvertase Subtilisin/Kexin 9) ist ein Enzym, das zu einer irreversiblen Bindung von LDL mit seinem Rezeptor und nach Internalisierung im Rahmen der Aufnahme in die Leberzelle zum Abbau des LDL-Rezeptors führt.
Inclisiran
Inclisiran (Leqvio® 284mg) ist ein durch medizinisches Fachpersonal subkutan zu verabreichendes m-RNA-Analogon, das über seinen Wirkmechanismus mit der für die Synthese von PCSK9 verantwortlichen m-RNA interferiert und dessen Produktion reduziert. Dies bedeutet, dass ein höherer Prozentsatz der LDL-Rezeptoren nach Internalisierung recycelt werden kann und mehr LDL-C in die Leberzelle aufgenommen werden kann. Inclisiran ist zweimal jährlich zu verabreichen; einzig der Abstand von der ersten zur zweiten Gabe beträgt 3 Monate. Es konnte eine weitgehend konstante Absenkung von LDL-C über mehrjährige Beobachtungszeiträume von ca. 50% nachgewiesen werden, bei gleichzeitig guter Verträglichkeit. Es bestehen Hinweise für einen klinischen Vorteil; aktuell laufen Studien, die hoffentlich auch die signifikante Wirksamkeit auf kardiovaskuläre Endpunkte und v.a. die Mortalität beweisen können. Zu beachten ist, dass es bei familiärer homozygoter Hypercholesterinämie zwar zu einem Absinken der PCSK9-Spiegel, aber zu keiner Reduktion des LDL-C-Spiegels kommt.6
PCSK9-Hemmer:
PCSK9-Hemmer sind monoklonale Antikörper, die subkutan verabreicht werden und sich selektiv und irreversibel an das PCSK9-Molekül binden, wodurch sie dieses seiner Funktion berauben. Wie beschrieben stehen durch PCSK9-Hemmer mehr „wiederverwendete“ LDL-Rezeptoren zur Verfügung, was zu einer stabilen und hochsignifikanten Absenkung von LDL-C führt. Als positiver Nebeneffekt ist auch eine Abnahme des Lipoproteinspiegels von ca. 25% zu erwähnen.8
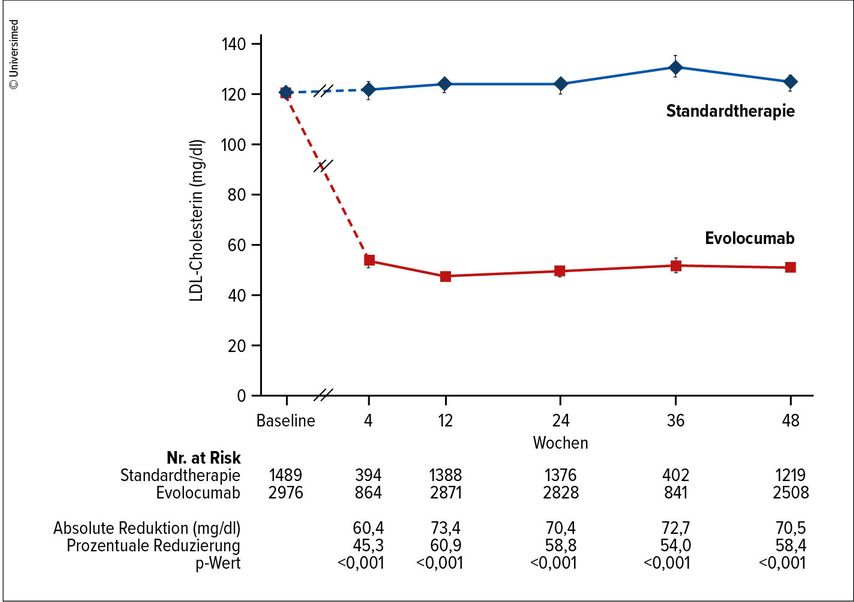
Aktuell stehen 2 Präparate zur Verfügung. Evolocumab (Repatha®) wird in der Dosierung 140mg alle 2 Wochen und 420 mg alle 4 Wochen angeboten. Alirocumab (Praluent®) ist mit 75mg sc. alle 2 Wochen, 150mg sc. alle 2 Wochen und 300 mg sc. alle 4 Wochen am Markt vertreten. Nach Einschulung werden PCSK9-Hemmer von den Patienten selbst verabreicht. Hervorzuheben sind die ausgesprochen gute Verträglichkeit mit einem Nebenwirkungsprofil auf Placeboniveau und die gute Akzeptanz der Patienten. Sowohl die 14-tägigen wie auch die monatlichen Gaben haben sich bisher als sehr praktikabel erwiesen. Für beide Substanzen liegen nicht nur Daten vor, die konsistent eine anhaltende LDL-C-Senkung von ca. 60% additiv zu vorbestehender Statintherapie, sondern auch eine signifikante Senkung kardiovaskulärer Endpunkte zeigen (Abb. 2).7,8, 9 Weiters zeigt sich in Studien sowohl eine Plaquevolumenreduktion sowie Dickenzunahme der fibrösen Kappe koronarer Plaques als Surrogat für eine Stabilisierung der Plaquemorphologie.10Die erreichten LDL-C-Werte lagen teils deutlich unter 30mg/dl ohne Hinweis für adverse Effekte einer starken LDL-C-Absenkung.
Abb. 2: LDL-C-Reduktion am Beispiel des PCSK9-Antikörpers Evolocumab, OSLER-Studie (modifiziert nach Sabatine MS et al. 2015)8
Alle Substanzen, die PCSK9 als Ziel haben, sind aufgrund des unterschiedlichen Wirkmechanismus ausgezeichnete Kombinationspartner mit Cholesterolsynthesehemmern (bevorzugt Atorvastatin oder Rosuvastatin) sowie Ezetimib. Eine Monotherapie ist nach Möglichkeit zu vermeiden. Bei Indikationsstellung einer PCSK9-Hemmertherapie im Falle eines statininduzierten Muskelschmerzes ohne CK-Erhöhung wäre zum Beispiel eine gute Option, Ezetimib 10mg + ein niedrig dosiertes Statin (z.B. Atorvastatin 10mg oder Rosuvastatin 5mg) zu belassen – darunter besteht deutlich bessere Verträglichkeit bei exzellenter Wirkung auf das Lipidprofil in Kombination mit dem PCSK9-Hemmer.
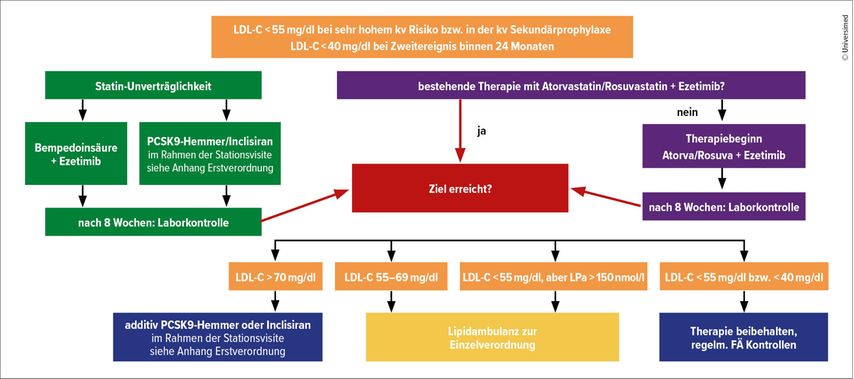
Die Erstverordnung von PCSK9-Hemmern ist aktuell gemäß Vereinbarung der Sozialversicherungsträger nur in definierten Zentren an diabetologischen, kardiologischen oder neurologischen Abteilungen möglich. An der kardiologischen Abteilung der Universitätsklinik St. Pölten wird der in Abbildung 3 dargestellte Behandlungsalgorithmus gewählt. Dies ist unser Zugang, Patientenzu behandeln, die in der Regel einem kardiovaskulären Hochrisikokollektiv angehören.
Abb. 3: Therapiealgorithmus der Lipidambulanz St. Pölten, erstellt von Dr. Jürgen Nowy, geprüft und freigegeben von Prim. Univ.-Prof. Dr. Julia Mascherbauer. Abkürzungen: LDL-C = LDL-Cholesterin, kv = kardiovaskulär
Fazit
Es lässt sich festhalten, dass die kausale Ursache von LDL-C in der Pathogenese der Atherosklerose unumstritten ist. Das Ausmaß und die Dauer der Exposition bestimmen das Risiko. Eine frühzeitige und aggressive Senkung verhindert eine Progression der Erkrankung. Wir haben ein großes Armamentarium an lipidsenkenden Medikamenten mit guter Wirksamkeit, Verträglichkeit und Kombinierbarkeit zur Verfügung, sodass eine leitliniengerechte Lipidsenkung in der Regel erreichbar ist. Dies erfordert ein hohes Ausmaß an ärztlicher Aufklärung und Nachsorge im Zusammenspiel aller behandelnden Ärzt:innen sowohl innerklinisch wie auch im niedergelassenen Bereich. Es gilt, das anhaltende Vertrauen des Patienten in das Behandlungskonzept zu gewinnen, denn nur eine rasche, aggressive und vor allem langfristige Lipidkontrolle ist sinnvoll. Die angegebenen Zielwerte sind obere Grenzwerte und eine Therapie sollte nie abgeschwächt werden, wenn diese Werte unterschritten werden, denn: „the lower, the better“!
Literatur:
1 Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C et al.: Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet 2010; 376(9753): 1670-81 2 Mach F et al.: 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS), European Heart Journal2020; 41(1):111-88. https://doi.org/10.1093/eurheartj/ehz455 3 Stürzebecher PE et al.: [Statin intolerance and statin-associated muscular pain]. Herz 2022; 47(3): 204-11 4 Cannon CP et al.: Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372(25): 2387-97 5 Nissen SE et al.: Bempedoic acid and cardiovascular outcomes in statin-intolerant patients. N Engl J Med 2023; 388(15): 1353-64 6 Raal F et al.: Efficacy, safety, and tolerability of inclisiran in patients with homozygous familial hypercholesterolemia: results from the ORION-5 randomized clinical trial. Circulation 2023; doi: 10.1161/CIRCULATIONAHA.122.063460 7 Schwartz GG et al.: Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med 2018; 379(22): 2097-2107 8 Sabatine MS et al., for the Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators; N Engl J Med 2015; 372: 1500-9 9 Sabatine MS et al.: Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017; 376(18): 1713-22 10 Nichollset SJ et al.: Effect of evolocumab on progression of coronary disease in statin-treated patients. The GLAGOV randomized clinical trial. JAMA 2016; 316(22): 2373-84 11 Ference BA et al.: Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017; 38(32): 2459-72 12 Österr. Gesundheitsbericht 2022
Das könnte Sie auch interessieren:
Wenn Blutgefäße früher altern
12,2% der Österreicher weisen eine vorzeitige Gefäßalterung auf. Das ergab eine aktuelle Auswertung im Rahmen der Langzeitstudie LEAD. Frauen sind häufiger betroffen als Männer. ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...