Vorhofflimmern – ein Update
Autorin:
Univ.-Prof. Dr. Marianne Gwechenberger
Universitätsklinik für Innere Medizin II
Klinische Abteilung für Kardiologie
Medizinische Universität Wien
Vorhofflimmern (VHF) ist die häufigste Rhythmusstörung und betrifft rund 2–4% der Bevölkerung, mit einer deutlichen Zunahme mit fortschreitendem Alter. Im August 2020 wurden die neuen Guidelines der European Society of Cardiology zur Diagnose und Behandlung von VHF publiziert – hier die wesentlichen Empfehlungen und Neuerungen.
Keypoints
-
Vorhofflimmern ist die häufigste Rhythmusstörung und fast immer mit Komorbiditäten verbunden.
-
Durch die Einführung des 4S- AF-Schemas und des ABC-Pfades soll eine verbesserte Patientenbetreuung erzielt werden.
-
Darüber hinaus wurden zahlreiche Empfehlungen geändert. Künftige Updates sind aufgrund rezenter Studien am Horizont.
Zu den Neuerungen zählen die Einführung des 4S-AF-Schemas zur besseren Charakterisierung des Vorhofflimmer- und Schlaganfallrisikos sowie der ABC-Ansatz in der Therapie. Dies soll zu einer Verbesserung des strukturierten Managements der Patienten und der Therapieergebnisse führen. Für die kommenden Jahren wird eine 2,3-fache Zunahme der Anzahl an Patienten mit VHF prognostiziert, dadurch steigen die mit VHF verbundene Morbidität und Mortalität an. Die globale Prävalenz von VHF variiert regional stark, wobei vor allem Nordamerika, Nordeuropa, aber auch Österreich zu den Regionen mit der höchsten Prävalenz zählen (Prävalenzrate >900/100000). VHF tritt häufiger bei Männern als bei Frauen auf. Rund 1 von 3 Personen erkrankt im Laufe ihres Lebens an VHF. VHF ist mit einer 1,5- bis 3,5-fach höheren Mortalität, einer erhöhten Schlaganfall- und Herzinsuffizienzrate sowie einer höheren Wahrscheinlichkeit für kognitiven Abbau verbunden.
Diagnose und Definition
Für die Diagnose VHF ist eine EKG-Dokumentation für mindestens 30s oder ein 12-Ableitungs-EKG erforderlich. Charakteristisch sind das Fehlen einer erkennbaren P-Welle und unregelmäßige RR-Intervalle, wenn keine Störung der AV-Leitung vorliegt. Es wird zwischen klinischem VHF und atrialen Hochfrequenzepisoden (AHRE) sowie durch kardial implantierte Geräte, wie Schrittmacher oder Looprecorder, detektiertem subklinischem VHF unterschieden.
Unter klinischem VHF versteht man symptomatisches und asymptomatisches VHF, das durch ein Oberflächen-EKG dokumentiert wurde. AHRE und subklinisches VHF weisen auf asymptomatische Episoden von VHF oder AHRE hin, die durch intrakardiale EKGs erkannt und als VHF bestätigt werden, bei denen zuvor kein klinisches VHF auf einem Oberflächen-EKG nachgewiesen wurde. Technologien wie Smartphones und Wearables eröffnen neue Möglichkeiten in der Diagnostik und Therapie von Patienten mit VHF und sind bereits im klinischen Alltag präsent. Diese Technologien wurden in den Leitlinien anerkannt, die Häufigkeit des Screenings ist unklar. Ein opportunistisches Screening auf VHF wird ab dem 65. Lebensjahr empfohlen (Klasse I), neu ist die Empfehlung auch bei Patienten mit Hypertonie (Klasse IB) und obstruktivem Schlafapnoe-Syndrom (Klasse IIaC). Bei Patienten mit hohem Schlaganfallrisiko bzw. Patienten über 75 Jahre soll ein systematisches Screening erwogen werden. Bei Patienten mit Schrittmachern, ICDs oder Looprecordern (CIED) soll ein regelmäßiges Screening auf asymptomatische AHRE-Episoden durchgeführt werden.
Klassifikation
Traditionell wird VHF nach der Dauer und dem Ende der Episoden in paroxysmal, persistierend und permanent unterschieden (Tab. 1). Die Begriffe Lone VHF, valvuläres und chronisches VHF sollten nicht mehr verwendet werden.
Diagnose und Nachsorge
In den neuen Leitlinien wird für die Diagnosestellung ein „Basispaket“ vorgeschlagen, das alle Patienten erhalten sollten. Dazu zählen eine ausführliche Anamnese, die neben der AF-Charakteristik und dem Erheben des Schlaganfallrisikos auch die Begleiterkrankungen erfasst. Des Weiteren zählen ein 12-Kanal-Ableitungs-EKG, eine Laboruntersuchung (Schilddrüse, Nierenfunktion, Elektrolyte, Blutbild) und eine transthorakale Echokardiografie zur Detektion struktureller Herzerkrankungen und zur Vorhofbeurteilung als Basisuntersuchung. Abhängig von Komorbiditäten und Patientencharakteristika können weitere Untersuchungen wie Holter-EKG, transösophageale Echokardiografie, spezielle Laboruntersuchungen (TnT, pro BNP) Koronar-CT, Ischämiediagnostik, Beurteilung der kognitiven Leistung, LGE-Kardio MR, kraniales CT notwendig sein. Eine strukturierte Nachsorge in Zusammenarbeit mit Pflegekräften und Hausärzten muss gewährleistet sein.
4S-AF-Schema
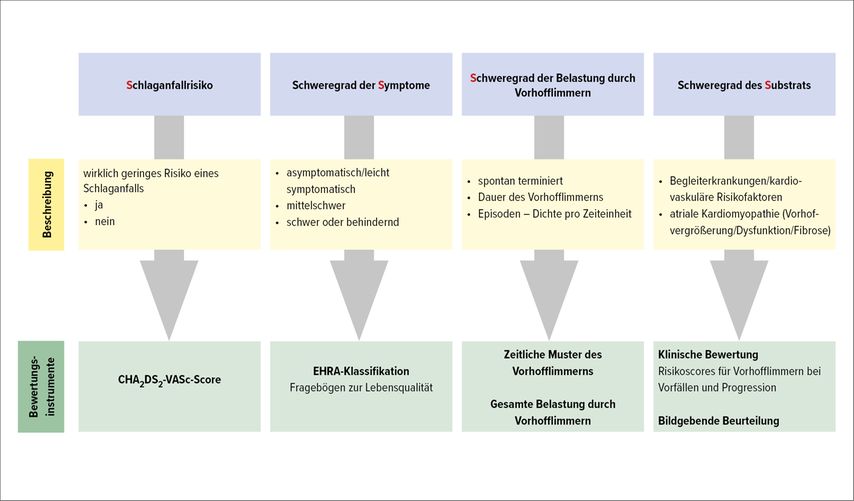
In den neuen Guidelines wird ein Paradigmenwechsel von der rein zeitlichen Klassifikation des VHF zu einer strukturierten Charakterisierung vollzogen. Es werden das Schlaganfallrisiko, der Schweregrad der Symptome, der Schweregrad der Belastung durch VHF sowie der Schweregrad des Substrates erhoben (Abb. 2). Prinzipiell sollen die Symptome, in Anlehnung an die NYHA- bzw CCS-Klassifikation, nach der EHRA-Klassifikation eingeteilt werden (EHRA 1: keine Symptome; 2a: leichte Symptome, die die Alltagstätigkeit nicht beeinträchtigen, 2b: mittelschwere Symptome; 3: schwere Symptome – Alltagstätigkeit durch AF-Symptome beeinträchtigt; 4: behindernd, normale Alltagstätigkeit nicht mehr möglich). Das Substrat für VHF sind eine Vorhofsdilatation und Fibrose mit einer konsekutiven Vorhofdysfunktion. Die Definition der atrialen Kardiomyopathie beinhaltet strukturelle, architektonische oder elektrophysiologische Veränderungen des Vorhofs, die potenziell zu klinisch relevanten Problemen führen. Diese Veränderungen können durch Echokardiografie, MRI und elektrophysiologische Untersuchungen dargestellt werden.
Abb. 2: Strukturierte Charakterisierung des Vorhofflimmerns: 4S-AF-Schema Schlaganfallvermeidung; ESC-Guidelines-modifiziert
Behandlung des Vorhofflimmerns
Für die Behandlung des VHF wird ein integriertes Management empfohlen und im Sinne eines ganzheitlichen Ansatzes das ABC(„atrial fibrillation better care“)-Schema eingeführt: A steht für Antikoagulation/Schlaganfallverhinderung, B für eine bessere Symptomkontrolle und C für Komorbiditäten.
A: Antikoagulation/Schlaganfallverhinderung („Avoid stroke“)
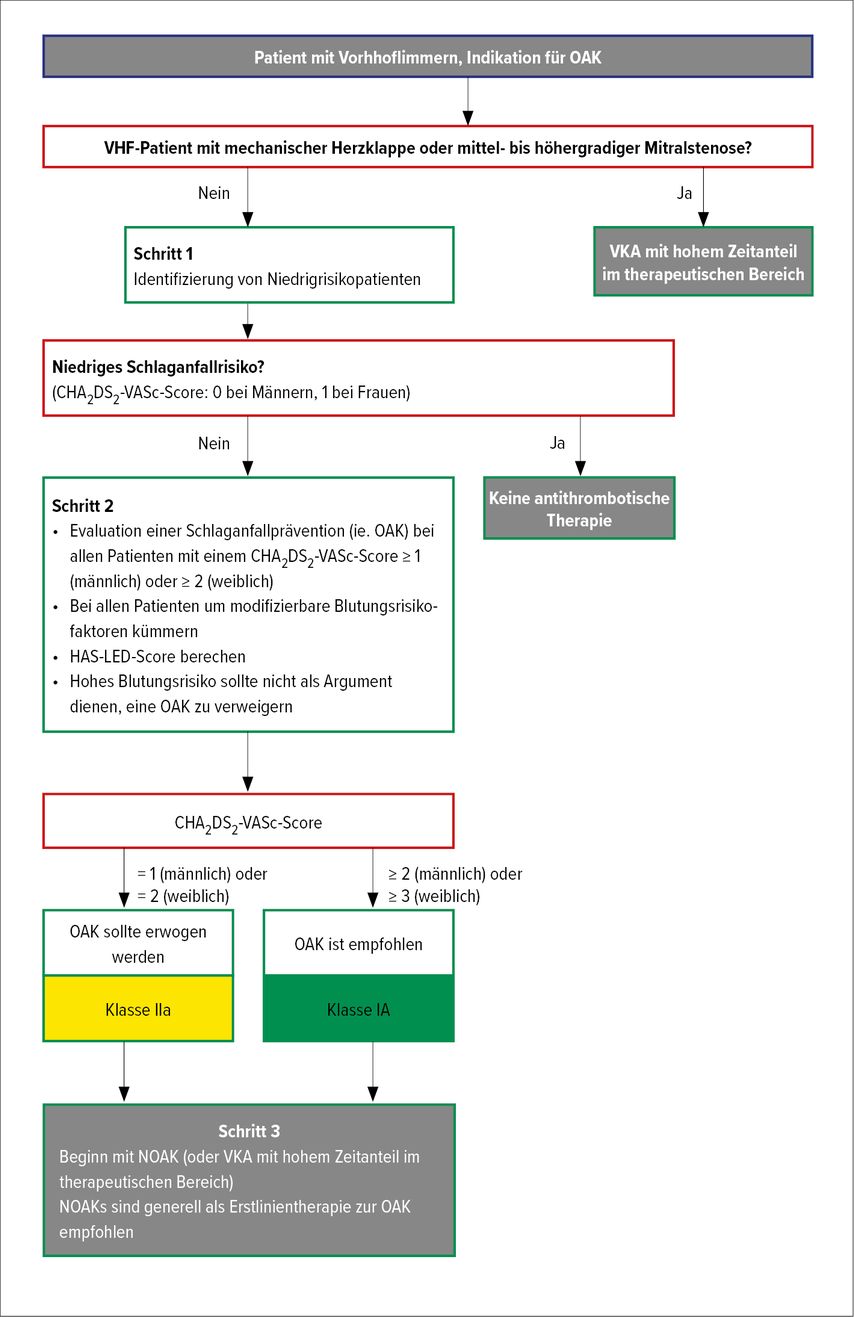
Das Risiko für einen AF-bedingten Schlaganfall hängt von verschiedenen Risikofaktoren ab. Die Bewertung des Schlaganfallrisikos stellt eine zentrale Säule der Behandlung dar. Die Antikoagulation reduziert das Schlaganfallrisiko um zwei Drittel. Es wurden verschiedene Scores entwickelt, wobei einerseits Praktikabilität und andererseits Genauigkeit beachtet werden müssen.
Für die Beurteilung des Schlaganfallrisikos wird weiterhin der CHA2DS2-Vasc-Score empfohlen, auch wenn er in der Vorhersage für Hochrisiko nur mäßig gut abschneidet (Abb. 1). Patienten mit einem niedrigen Schlaganfallrisiko, die keine orale Antikoagulation (OAK) benötigen können damit gut identifiziert werden (CHA2DS2-Vasc-Score 0 bei Männern bzw. 1 bei Frauen). Ab einem CHA2DS2-Vasc-Score von 2 bei Männern und 3 bei Frauen besteht eine Klasse-IA-Indikation für die orale Antikoagulation. Bei einem CHA2DS2-Vasc-Score von 1 bei Männern bzw. 2 bei Frauen sollte eine orale Antikoagulation erwogen werden (Klasse IIaB). Dabei sollte den NOAKs (Nicht-Vitamin-K-Antagonisten) der Vorzug gegenüber Vitamin-K-Antagonisten gegeben werden, sie verringern das Risiko für intrakranielle Blutungen um die Hälfte. Eine Ausnahme bilden Patienten mit einer mechanischen Herzklappe und Patienten mit einer mittel- bis hochgradigen Mitralstenose, diese Patienten werden weiterhin mit Vitamin-K-Antagonisten behandelt. Die Behandlung mit OAK kann bei rund 1–2% der Patienten im klinischen Alltag zu relevanten Blutungen führen. Das Blutungsrisiko wird weiterhin mit dem HAS-BLED-Score erhoben. Ein höheres Blutungsrisiko sollte nicht dazu führen, keine OAK (außer bei absoluter Kontraindikation) zu verabreichen, vielmehr soll nach modifizierbaren Risikofaktoren gefahndet werden und die Patienten sollten mit höherem Blutungsrisiko engmaschig kontrolliert werden. Im Falle einer Kontraindikation gegen eine OAK sollte ein Herzohrverschluss in Betracht gezogen werden (Klasse IIbB).
Abb. 1: „A“-„Avoid Stroke“, Antikoagulation – erste Säule des ABC-Pfads, Schlaganfallvermeidung, ESC-Guidelines-modifiziert
B: Bessere Symptomkontrolle
Die Kontrolle der Symptome stellt die zweite Säule des ABC-Pfades dar. Die zwei prinzipiellen Therapieformen des VHF sind die Frequenzkontrolle und die Rhythmuskontrolle.
Frequenzkontrolle
Zur Frequenzkontrolle stehen verschiedene Medikamente zur Verfügung. Die Wahl der Medikamente hängt von den Begleiterkrankungen ab. Eine Frequenzregulierung sollte bei allen VHF-Patienten als Basistherapie verabreicht werden. Des Weiteren wird es in den Guidelines als erste Wahl bei Patienten ohne Symptome oder nur mit milden Symptomen, als Therapie bei Versagen der rhythmuserhaltenden Therapie oder als Therapie, wenn die Risiken der Wiederherstellung des Sinusrhythmus die Nutzeffekte überwiegen, empfohlen. Die genaue Zielfrequenz ist noch unklar. Bei den meisten Patienten sollte eine Herzfrequenz unter 110/min angestrebt werden. Bestehen weiterhin Symptome und/oder eine LV-Verschlechterung, ist eine Herzfrequenz unter 80/min anzustreben. Bei Patienten mit einem CRT ist natürlich eine kontinuierliche biventrikuläre Stimulation anzustreben. Sollte mit diesen Medikamenten keine ausreichende Frequenzkontrolle erzielen lassen, sind eine AV-Knotenablation und eine CRT-Implantation zu erwägen.
Rhythmustherapie
Die Strategie des Rhythmuserhaltes versucht den Sinusrhythmus wieder herzustellen und zu erhalten. Dazu stehen Kardioversion, Antiarrhythmika und Katheterablation zur Verfügung, diese verschiedenen Therapieformen können auch miteinander kombiniert werden. Neben der Katheterablation besteht auch die Möglichkeit einer chirurgischen Ablation. Diese wird im klinischen Alltag bei Patienten, die sich ohnehin einem herzchirurgischen Eingriff unterziehen müssen, angewendet. Die medikamentöse Therapie richtet sich nach der Grundkrankheit. Dabei sollte wenn möglich Amiodaron vermieden werden. Es ist das potenteste Antiarrhytmikum, hat allerdings die meisten Nebenwirkungen, es kann aber auch bei Patienten mit struktureller Herzerkrankung und Herzinsuffizienz gegeben werden. Dronedaron, Flecainid und Propafenon sollten nur bei Patienten ohne strukturelle Herzerkrankung verabreicht werden (Klasse IA), Sotacor nur mit einer Klasse-IIa-Empfehlung. Dronedaron ist deutlich weniger effektiv als Amiodaron, hat aber ein wesentlich besseres Sicherheitsprofil. Beide haben eine Klasse-IA-Indikation bei Patienten mit KHK, HFpEF und valvulärer Erkrankung, während Sotacor nur eine Klasse-IIb-Empfehlung hat. Bei der HFrEF wird nur Amiodaron empfohlen (IA). Regelmäßige labormedizinische und klinische Kontrollen sind nötig.
Die primäre Indikation zur Rhythmustherapie ist Verbesserung der Symptome und der Lebensqualität. Rezente Studien, die teilweise gleichzeitig mit den ESC-Guidelines veröffentlicht wurden, zeigen signifikante Vorteile hinsichtlich harter Endpunkte, daher wird ein fokussiertes Update erwartet. Die Studie EAST AF Net 4 konnte insgesamt 2789 Patienten in eine Interventionsgruppe (medikamentöse oder interventionell rhythmuserhaltende Therapie) und eine frequenzregulierte Gruppe randomisieren, mit einem mittleren Follow-up von 5,1 Jahren. Bei der letzteren Gruppe konnte bei Fortbestehen der Symptome eine rhythmusstabilisierende Therapie eingeleitet werden. Der kombinierte Endpunkt (kardiovaskulärer Tod, Schlaganfall, Hospitalisierung mit Herzinsuffizienz oder akutem Koronarsyndrom) wurde signifikant gesenkt (HR 0,79; 95% CI: 0,66–0,94; p=0,005). Es wurde gezeigt, dass eine frühe, innerhalb von 12 Monaten begonnene rhythmuserhaltende Therapie zu einer Reduktion der Einzelkomponenten wie des kardiovaskulären Tods, ischämischen Schlaganfalls und ungeplanter Hospitalisierungen um ca 20% führt. Die Gesamtmortalität war nicht unterschiedlich. Es ist wichtig zu betonen, dass sich in dieser Studie nur 17% der Patienten einer Ablation unterzogen hatten. Damit konnte EAST AF Net zum ersten Mal zeigen, dass eine frühe rhythmuserhaltende Therapie zur Verhinderung von kardiovaskulärem Tod und Schlaganfällen beiträgt.
Die Ergebnisse der Studien EARLY AF und STOP AF First zeigten die Vorteile der interventionellen rhythmuserhaltenden Therapie gegenüber der medikamentösen Therapie, bei ähnlicher Sicherheit. Daher sollten sich die neuen Guidelines hinsichtlich einer frühen rhythmuserhaltenden Therapie künftig dahingehend ändern. Während es bei der medikamentösen Therapie keine wesentlichen Änderungen gibt, erfährt die Katheterablation laufend technische Verbesserungen. Die Katheterablation wird nach einem frustranen Rhythmisierungsversuch oder bei Unverträglichkeit eines Antiarrhythmikums der Klasse I/III (Klasse IA) oder eines Betablockers (Klasse IIaB) empfohlen. Sie kann aber auch als First-Line-Therapie bei ausgewählten Patienten in Betracht gezogen. Zur initialen Entscheidungsfindung steht auch der Patientenwunsch in den Leitlinien im Vordergrund.
Die Katheterablation ist der medikamentösen Therapie hinsichtlich Symptomkontrolle und Rezidivfreiheit überlegen. Der Eckpfeiler der Katheterablation ist die Pulmonalvenenisolation. Risikofaktoren für ein Rezidiv nach Ablation sind ein stark vergrößerter Vorhof, eine lange Dauer des Vorhofflimmers, eine Nierenfunktionsstörung und andere kardiovaskuläre Risikofaktoren. In der CASTLE-AF-Studie konnte durch die Ablation ein Mortalitätsvorteil bei Patienten mit Herzinsuffizienz und VHF gezeigt werden. Eine der interessantesten Innovationen ist die Einführung der „pulse field ablation“ (PFA). Die PFA ist derzeit Gegenstand zahlreicher Untersuchungen, sie ist äußerst erfolgversprechend. Es scheint, dass diese Energieform im Vergleich zur konventionellen Radiofrequenztherapie und Kryoablation mit einer geringeren Komplikationsrate und kürzeren Behandlungszeiten verbunden ist. Bei der Katheterablation kann im Vergleich zur medikamentösen Therapie signifikant häufiger der Sinusrhythmus erhalten werden, dies führt bei symptomatischen Patienten zu einer besseren Lebensqualität.
Komorbiditäten
Eine sehr große Mehrheit (>90%) der Patienten mit VHF hat weitere kardiovaskuläre Erkrankungen. Die Identifizierung und Behandlung von Komorbiditäten und kardiometabolischen Risikofaktoren stellen die dritte Säule der Behandlung dar und sind ein integraler Bestandteil der Therapie, ebenso die Modifikation eines ungesunden Lebensstils. Nach der Diagnosestellung von VHF sollte daher nach Begleiterkrankungen gesucht werden und diese sollten konsequent behandelt werden. Eine konsequente Blutdruckeinstellung kann zum Erhalt des Sinusrhythmus beitragen und das Blutungsrisiko bei antikoagulierten Patienten reduzieren. Die RACE-III-Studie zeigte, dass die Behandlung von Risikofaktoren und der Komorbiditäten bei Patienten mit Herzinsuffizienz zu einer Stabilisierung des Sinusrhythmuses führt. In der ARREST-Studie konnte durch ein aggressives Risikofaktormanagement mit Gewichtsreduktion bei adipösen Patienten, körperliche Aktivität, Verringerung des Alkoholkonsums und optimales Management einer obstruktiven Schlafapnoe sowie intensive Risikofaktorentherpie (Diabetes, Hypertonie, Hyperlipidämie) eine signifikant geringere Rezidivrate nach Vorhofflimmerablation erzielt werden.
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Neue Wege in der Diagnostik des Vorhofflimmerns
Vorhofflimmern ist die häufigste Rhythmusstörung unserer Zeit. Die Folgen reichen von eingeschränkter Lebensqualität und Belastbarkeit bis zu schwerwiegenden Komplikationen wie ...