Therapie der chronischen Herzinsuffizienz
Autoren:
DDr. Ewald Kolesnik
Assoz. Prof. PD DDr. Peter P. Rainer, FESC, FAHA, FHFA
Abteilung für Kardiologie
Universitätsklinik für Innere Medizin
Universitäres Herzzentrum
Medizinische Universität Graz
E-Mail: peter.rainer@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei der Herzinsuffizienz handelt es sich um ein klinisches Syndrom, das durch Kardinalsymptome (z.B. Luftnot, Knöchelödeme und Müdigkeit) gekennzeichnet ist, die von bestimmten klinischen Untersuchungsbefunden (z.B. erhöhter Jugularvenendruck, Rasselgeräusche über der Lunge und periphere Ödeme) begleitet sein können. Dies ist auf kardiale Strukturdefekte und/oder Funktionsstörungen zurückzuführen, die zu erhöhten intrakardialen Drücken und/oder einer unzureichenden Herzleistung in Ruhe bzw. bei Belastung führen.1
Keypoints
-
Die Standardtherapie der HFrEF besteht aus einer Kombination von ACE-Hemmer/ARB/ARNI, Betablocker, MRA und SGLT2-Inhibitor.
-
Diese Medikamente sollten innerhalb weniger Wochen etabliert und auftitriert werden.
-
Ein früher Wechsel von ACE-Hemmern bzw. ARB auf ARNI erscheint sinnvoll.
-
Die SGLT2-Inhibitoren Empagliflozin und Dapagliflozin sind unabhängig von der Einteilung nach EF wirksam.
-
Bei Volumenüberladung ist ein früher Einsatz von Diuretika indiziert.
-
Wegen Nebenwirkungen (Hypotonie, Nierenfunktions- und Elektrolytstörungen) sind regelmäßige klinische Kontrollen und Bestimmung der Laborparameter notwendig.
Diese einleitenden Worte finden sich in der deutschen Übersetzung der aktuell gültigen Leitlinie der Europäischen Gesellschaft für Kardiologie (ESC) zum Thema Herzinsuffizienz,sie stellen die aktuell gültige Definition der Erkrankung dar. Die Herzinsuffizienz hat eine geschätzte Inzidenz von 3 pro 1000 Personenjahre in Europa bzw. von 5 pro 1000 Personenjahre, wenn nur die erwachsene Bevölkerung herangezogen wird. Die Prävalenz beträgt dabei ca. 1 bis 2% aller Erwachsenen und steigt auf über 10% bei Personen über 70 Jahre an.2,3 Die Herzinsuffizienz geht mit einer schlechten Prognose einher, große Register berichten eine 5-Jahres-Sterblichkeit von 53% bis 67% nach Diagnosestellung.4,5Einen entsprechend hohen Stellenwert hat die Therapie und die positive Nachricht ist, dass sich die Prognose durch die mittlerweile etablierten Therapieansätze, zumindest bei der Herzinsuffizienz mit reduzierter systolischer Funktion (HFrEF), deutlich verbessert haben.
Einteilung der Herzinsuffizienz
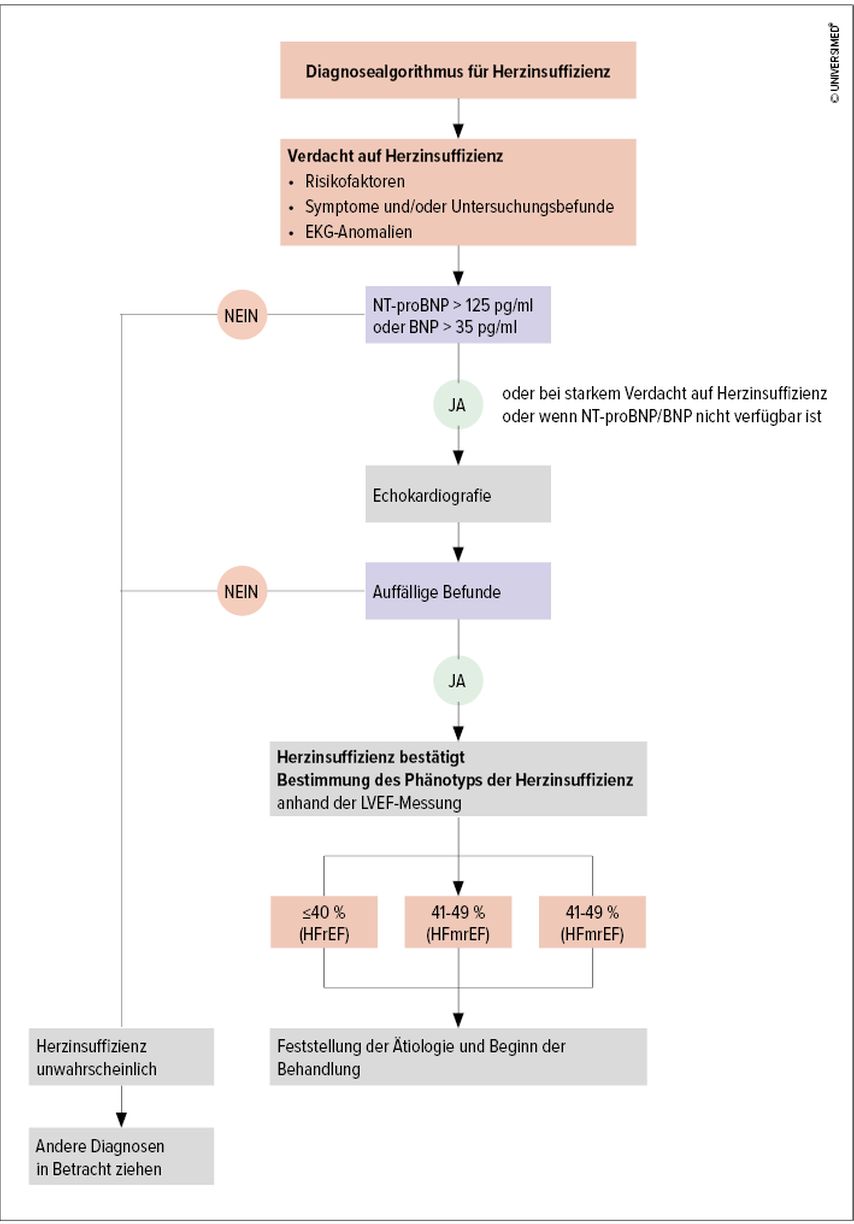
Die Diagnosestellung kann bei entsprechender Symptomatik in Zusammenschau mit erhöhten natriuretischen Peptiden (NT-proBNP) und einer pathologischen Echokardiografie getätigt werden (Abb.1). Die Einteilung der Herzinsuffizienz wird immer noch anhand der linksventrikulären Ejektionsfraktion (LVEF) getroffen. Dieser Parameter wird am einfachsten mittels transthorakaler Echokardiografie erhoben. Dabei gilt, dass eine LVEF von >50% gemeinsam mit strukturellen Abnormalitäten, die mit einer gestörten diastolischen Funktion oder erhöhtem NT-proBNP einhergehen, als Herzinsuffizienz mit erhaltener Auswurfleistung (HFpEF) bezeichnet wird. Bei einer LVEF zwischen 41% und 49% wird von einer Herzinsuffizienz mit leicht reduzierter Auswurfleistung (HFmrEF) und bei einer LVEF von 40% und weniger von einer HFrEF gesprochen. Diese Unterteilung ist nach wie vor wichtig, denn die meiste Evidenz für Therapien der Herzinsuffizienz liegt für die HFrEF vor.
Therapiekonzepte
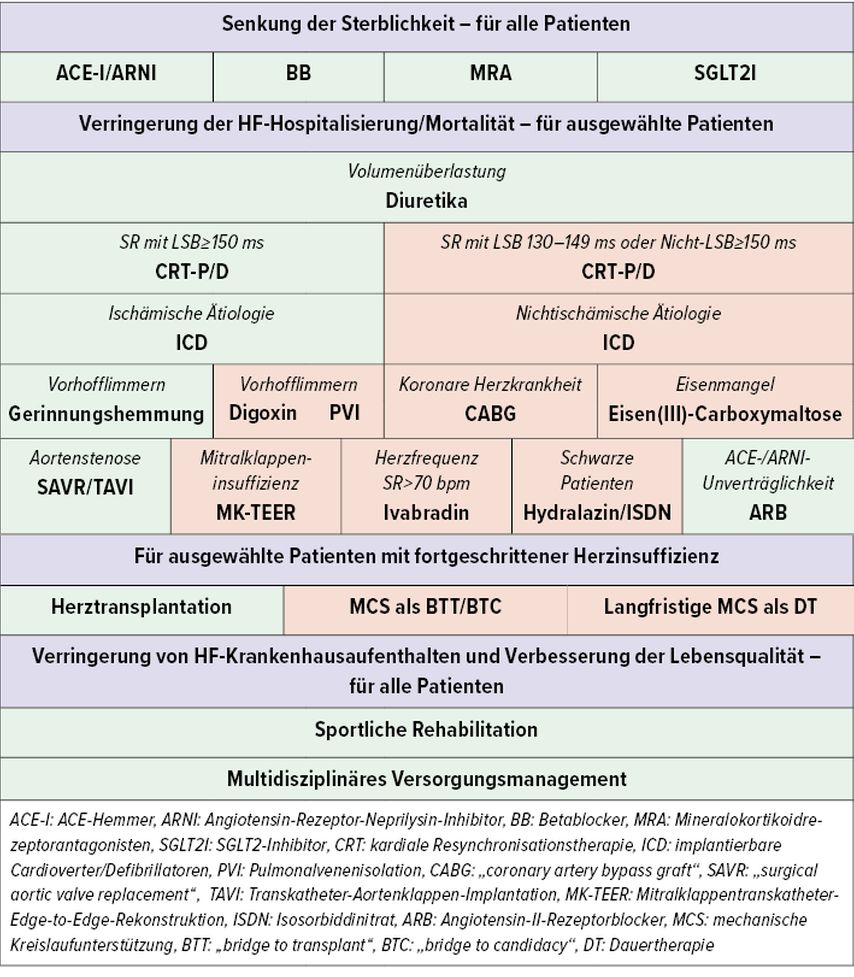
Bis in die 1970er-Jahre war die vorherrschende Meinung, dass lediglich körperliche Schonung, Digitalis und Diuretika einen therapeutischen Nutzen haben. 1975 wurde in einer Fallserie erstmals der positive Effekt von Betablockern bei 7 Patient*innen mit chronischer Herzinsuffizienz beschrieben.6 Dies änderte das grundlegende Verständnis der Erkrankung, führte in der Folge dazu, dass auch das Renin-Angiotensin-Aldosteron-System (RAAS-System) als wichtiger Spieler in der Pathophysiologie erkannt wurde, und leitete schließlich einen Paradigmenwechsel in der Behandlung der chronischen Herzinsuffizienz ein. Es folgten groß angelegte klinische Studien zu Betablockern, ACE-Hemmern, Angiotensin-II-Rezeptorblockern (ARB), Mineralokortikoidrezeptorantagonisten (MRA), Angiotensin-Rezeptor-Neprilysin-Inhibitoren (ARNI) und zuletzt zu SGLT2-Inhibitoren. Dabei wurde für alle genannten Therapien im Spektrum der HFrEF jeweils ein Mortalitätsbenefit gezeigt, was zumindest bei den medikamentösen Therapien in Klasse-I-Empfehlungen in den Leitlinien mündete. Metaanalysen zeigten, dass Kombinationen der einzelnen Wirkstoffe synergistische Effekte haben.7 Da eine Kombination aus einem ACE-Hemmer bzw. ARB oder ARNI, einem Betablocker, einem SGLT2-Inhibitor und einem MRA die besten klinischen Ergebnisse brachte, wurde die Formulierung der „fantastic four“ der HFrEF-Therapie geschaffen. Darüber hinaus qualifizieren sich einige Patient*innen für zusätzliche Therapieoptionen. Beispielsweise sind hier Diuretika bei Hinweisen auf Überwässerung (gestaute Vena cava inferior oder periphere Ödeme), Ivabradin bei einem Sinusrhythmus von >70/min Herzfrequenz trotz auftitriertem Betablocker, implantierbare Cardioverter/Defibrillatoren (ICD) bei LVEF <35% trotz optimaler medikamentöser Therapie bzw. kardialer Resynchronisationstherapie (CRT) bei Linksschenkelblock (mit QRS-Breite >130–150ms) zu nennen (Abb. 2).
Anders sieht es bei der HFmrEF und HFpEF aus. Hier sind lediglich sehr rezent SGLT2-Inhibitoren nach den positiven Studien EMPEROR-Preserved und DELIVER als Therapien etabliert worden, alle anderen vorhin genannten Therapiekonzepte haben einen niedrigen Empfehlungsgrad, und diesen auch nur für eine LVEF von 40% bis 50% aufgrund von neutral oder borderline-signifikant verlaufenden Studien. Wichtig für die Patientengruppe der HFpEF ist die konsequente Behandlung von Begleiterkrankungen, wie es z.B. Diabetes mellitus, Hypertonie oder chronischer Niereninsuffizienz sind.
Wie die Herzinsuffizienztherapie bei HFrEF eingeleitet werden soll, wird rege diskutiert. Grundsätzlich wurde in der ESC-Leitlinie von 2021 von einem stufenweisen Auftitrationsprozess und vom Erweitern der einzelnen Wirkstoffe unter Berücksichtigung der Evaluierung der LVEF Abstand genommen und eine gleichwertige Empfehlung für die „fantastic four“ ausgesprochen. Bei tatsächlich gleichzeitigem Therapiebeginn können aber Nebenwirkungen wie Hypotonie oder ein abrupter Abfall der Nierenfunktion folgen, weswegen die einzelnen Wirkstoffe nach wie vor der Reihe nach erweitert und im Abstand von wenigen Wochen auf die maximal verträgliche Dosis auftitriert werden sollten. Ausgewiesene Experten empfehlen dabei den gleichzeitigen Beginn mit einem Betablocker und SGLT2-Inhibitor und danach die Einleitung eines ACE-Hemmers oder ARB oder ARNI, gefolgt von einem MRA.8 Dieser Prozess sollte innerhalb von 4 Wochen erfolgen. Bei hospitalisierten Patienten kann häufig während des Aufenthaltes eine Therapie mit allen vier Substanzklassen begonnen werden. Die Weiterverordnung sollte unbedingt sichergestellt werden und auf notwendige klinische (Blutdruck, Herzfrequenz etc.) und Laborkontrollen (eGFR, Kreatinin, Kalium etc.) sollte hingewiesen werden (z.B. 2 Wochen nach Beginn bzw. Titration und dann zumindest 4-mal/Jahr). Ein früher Wechsel von ACE auf ARNI erscheint auch bei oligosymptomatischen Patienten (NYHA-II) sinnvoll bzw. bei dekompensierten Patienten nach klinischer Stabilisierung. In der rezent publizierten STRONG-HF-Studie konnte gezeigt werden, dass bei sehr rascher Auftitration der „fantastic four“ innerhalb von 2 Wochen eine signifikante Reduktion von Mortalität und Dekompensationen nach 6 Monaten im Vergleich zu einer Standardgruppe erreicht werden konnte.9 Insgesamt kann festgehalten werden, dass alle Patient*innen mit HFrEF, welche keine Kontraindikation haben, möglichst innerhalb weniger Wochen alle vier Substanzklassen in adäquater Dosis erhalten sollten, um eine früh eintretende Reduktion von Mortalität und Hospitalisierungsrate zu erreichen.
Komplikationsmanagement
Häufig beobachtete Situationen umfassen symptomatische und asymptomatische Hypotonie, einen Anstieg des Serumkreatinins und einen Anstieg des Kaliums. Dies gilt insbesondere für ACE-Hemmer bzw. ARB bzw. ARNI und MRA. Deswegen sollten auch regelmäßige Kontrollen der Nierenfunktion und der Elektrolyte erfolgen, vor allem in der Zeit der Auftitration. Unter genannter Therapie darf das Serumkreatinin um bis zu 50% ansteigen, die eGFR aber nicht um mehr als 25–30mL/min/1,73m2 abfallen. Das Kalium darf grundsätzlich auf 5,5mmol/L ansteigen, wobei idealerweise ein Wert von 5,0mmol/L nicht überschritten wird. Betablocker können eine Bradykardie nach sich ziehen, dabei ist grundsätzlich eine Herzfrequenz von 50/min noch tolerabel, darunter sollte die Dosis des Betablockers reduziert oder gänzlich abgesetzt werden.
Neue Therapiekonzepte
Eine noch größere Erweiterung des Repertoires an Herzinsuffizienztherapien ist in Aussicht und erste positive Studienergebnisse dazu wurden bereits publiziert. In der VICTORIA-Studie konnte eine Mortalitätsreduktion für den sGC-Stimulator Vericiguat nach akut dekompensierter HFrEF und in der GALACTIC-HF-Studie eine Reduktion von einem Kompositendpunkt bestehend aus Dekompensation und Mortalität für den Myosin-Aktivator Omecamtiv Mecarbil bei chronischer HFrEF erreicht werden. Die Ergebnisse dieser und noch laufender Studien werden sich in den regelmäßigen Updates der Leitlinien widerspiegeln.
Literatur:
1 McDonagh TA et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42(36): 3599-726 2 Brouwers FP et al.: Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND. Eur Heart J 2013; 34(19): 1424-31 3 GBD 2017 Disease and Injury Incidence and Prevalence Collaborators: Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet 2018; 392(10159): 1789-1858 4 Gerber Y et al.: A contemporary appraisal of the heart failure epidemic in Olmsted County, Minnesota, 2000 to 2010. JAMA Intern Med 2015; 175: 996-1004 5 Tsao CW et al.: Temporal trends in the incidence of and mortality associated with heart failure with preserved and reduced ejection fraction. JACC Heart Fail 2018; 6(8): 678-85 6 Waagstein F et al.: Effect of chronic beta-adrenergic receptor blockade in congestive cardiomyopathy. Br Heart J 1975; 37(10): 1022-36 7 Tromp J et al.: A systematic review and network meta-analysis of pharmacological treatment of heart failure with reduced ejection fraction. JACC Heart Fail 2022; 10(2): 73-84 8 Packer M, McMurray JJV: Rapid evidence-based sequencing of foundational drugs for heart failure and a reduced ejection fraction. Eur J Heart Fail. 2021; 23(6): 882-94 9 Mebazaa A et al.: Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): A multinational, open-label, randomised trial. Lancet 2022; 400(10367): 1938-52
Das könnte Sie auch interessieren:
Funktionsstörung des Myokards: wenn die Entspannung des Herzens gestört ist
Die hypertropheobstruktive Kardiomyopathie (HOCM) ist dadurch charakterisiert, dass die Entspannung des Myokards funktionsgestört ist. Die Folge ist eine zunehmende Verdickung der ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...