Modernes Lipidmanagement in der Praxis
Autoren:
Dr. Lore Schrutka
Priv.-Doz. Dr. Konstantin Krychtiuk
Assoc. Prof. Dr. Klaus Distelmaier
Assoc. Prof. Dr. Walter Speidl
Medizinische Universität Wien
Universitätsklinik für Innere Medizin II, Klinische Abteilung für Kardiologie
E-Mail: lore.schrutka@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Während die Wichtigkeit der Cholesterinsenkung in der Sekundärprävention von Herz-Kreislauf-Erkrankungen unbestritten ist, erreichen nur etwa 30% der Betroffenen in Österreich ihren LDL-Cholesterin-Zielwert. In der Primärprävention richtet sich der Zielwert nach dem kardiovaskulären Risiko.
Keypoints
-
LDL-C ist ein wesentlicher kausaler Risikofaktor für atherosklerotische kardiovaskuläre Erkrankungen.
-
Eine Nüchternblutabnahme ist nicht erforderlich, die HDL-Ratio dient nicht mehr zur Risikostratifizierung oder als Therapieziel.
-
Patienten mit atherosklerotischen kardiovaskulären Erkrankungen oder signifikanten Plaques im Carotis-Duplex oder Koronar-CT benötigen unabhängig vom LDL-C-Wert ein Hochdosisstatin.
-
Nur 30% der Hochrisikopatienten erreichen ihren LDL-C-Zielwert.
-
Ezetimib senkt das LDL-C um weitere 15–20%.
-
Patienten in der Sekundärprävention mit erhöhtem LDL-C unter Kombinationstherapie oder mit Statinunverträglichkeit sollten an ein PCSK9-Zentrum überwiesen werden.
-
Inclisiran und Bempedoinsäure sind neue Therapieoptionen, mit denen beinahe alle Patienten ihren Zielwert erreichen.
-
Bei LDL-C >190mg/dl und positiver Familienanamnese muss an eine familiäre Hypercholesterinämie gedacht werden und an ein Zentrum überwiesen werden.
Mit der koronaren Herzkrankheit an erster Stelle und dem Schlaganfall an zweiter Stelle sind 25% der Todesursachen weltweit auf eine kardiovaskuläre Ätiologie zurückzuführen. Neben arterieller Hypertonie, Rauchen, Adipositas und Glukosestoffwechselstörungen gehören Fettstoffwechselstörungen zu den wichtigsten Risikofaktoren für die Entstehung der Atherosklerose. Wenn kein Verdacht auf Diabetes mellitus oder familiäre Hypercholesterinämie besteht, empfehlen die neuesten Richtlinien der Europäischen Gesellschaft für Kardiologie (ESC),1 bei Männern ab dem 40. und bei Frauen ab dem 50. Lebensjahr den Lipidstatus zu erheben und ein kardiovaskuläres Risikoscreening durchzuführen. Ein Lipidstatus besteht aus Gesamtcholesterin, Low-Density-Lipoprotein-Cholesterin (LDL-C), High-Density-Lipoprotein-Cholesterin (HDL-C) und Triglyzeriden (TG). Auch das Lipoprotein a (Lp[a]) sollte einmalig bestimmt werden. Entgegen früheren Empfehlungen müssen Patienten bei der Blutabnahme nicht mehr nüchtern sein. Nur bei sehr hohen TG wird empfohlen, eine Nüchternblutabnahme durchzuführen.
Kardiovaskuläres Risiko
Patienten mit sehr hohem Risiko:
Zu den Patienten mit sehr hohem kardiovaskulärem Risiko gehören jene mit einer bereits bestehenden kardiovaskulären Erkrankung oder dem Nachweis signifikanter atherosklerotischer Plaques in einem durchgeführten Carotis-Duplex oder Koronar-CT (>50% Stenose) sowie die Mehrzahl der Menschen mit Diabetes oder Patienten mit chronischer Niereninsuffizienz.
Patienten mit hohem Risiko:
Für die Einstufung eines hohen kardiovaskulären Risikos genügt bereits ein hochsignifikanter Risikofaktor wie ein LDL-C >190 mg/dl oder ein Blutdruck mit Werten >180/110mmHg. Des Weiteren fallen auch Patienten mit einer familiären Hypercholesterinämie, Menschen mit Diabetes ohne Nachweis von Organschäden und Patienten mit leicht eingeschränkter Nierenfunktion in diese Risikogruppe.
Weitere Risikostratifizierung:
Bei allen anderen Personen sollen weitere Risikofaktoren wie Rauchen, Hypertonie (RR >140/90mmHg oder Medikation), eine positive Familienanamnese (männliche Verwandte ersten Grades <55 Jahren, weibliche Verwandte ersten Grades <65 Jahren) und das Alter (Männer >45 Jahre, Frauen >55 Jahre) erhoben werden. Das individuelle 10-Jahres-Risiko für eine tödliche kardiovaskuläre Erkrankung kann mithilfe der SCORE-Tabellen bestimmt werden ( www.heartscore.org ). Die Bestimmung des koronaren Kalziumscores mittels CT kann als Risikomodifikator bei der Bewertung des kardiovaskulären Risikos von asymptomatischen Personen mit niedrigem oder mittlerem Risiko in Betracht gezogen werden. Liegt der Agatston-Score >100 oder gibt es Hinweise auf auch nur geringe Plaques im Carotis-Duplex, gilt man zumindest als Hochrisikopatient.
Therapieziele
Die Zielwerte beziehen sich primär auf das LDL-C und bei hohen TG auf das Apolipoprotein B oder das Non-HDL-C (Gesamtcholesterin minus HDL-C):
-
Der Zielbereich des Non-HDL-C liegt dabei immer 30mg/dl über dem Zielbereich für das LDL-C.
-
Bei Patienten mit sehr hohem Risiko soll zusätzlich zu den LDL-C-Zielwerten von unter 55mg/dl das LDL-C um zumindest 50% gesenkt werden (d.h., beide Ziele müssen erreicht werden). Bei Patienten mit hohem Risiko soll zusätzlich zu den LDL-C-Zielwerten von unter 70mg/dl das LDL-C um zumindest 50% gesenkt werden (d.h., auch hier müssen beide Ziele erreicht werden). Daher muss jeder Patient mit sehr hohem bzw. hohem Risiko unabhängig von seinem LDL-C mindestens ein Hochdosisstatin erhalten.
-
Patienten mit einem erneuten kardiovaskulären Ereignis innerhalb von 2 Jahren, trotz optimaler Lipidtherapie, sollen noch aggressiver behandelt werden, um ein LDL-C <40mg/dl zu erreichen.
-
Bei moderatem Risiko soll ein LDL-C von <100mg/dl angestrebt werden.
-
Bei niedrigem Risiko soll ein LDL-C von <115mg/dl angestrebt werden.
-
HDL-Ratios sollen nicht mehr zur Risikostratifizierung oder als Therapieziel herangezogen werden.
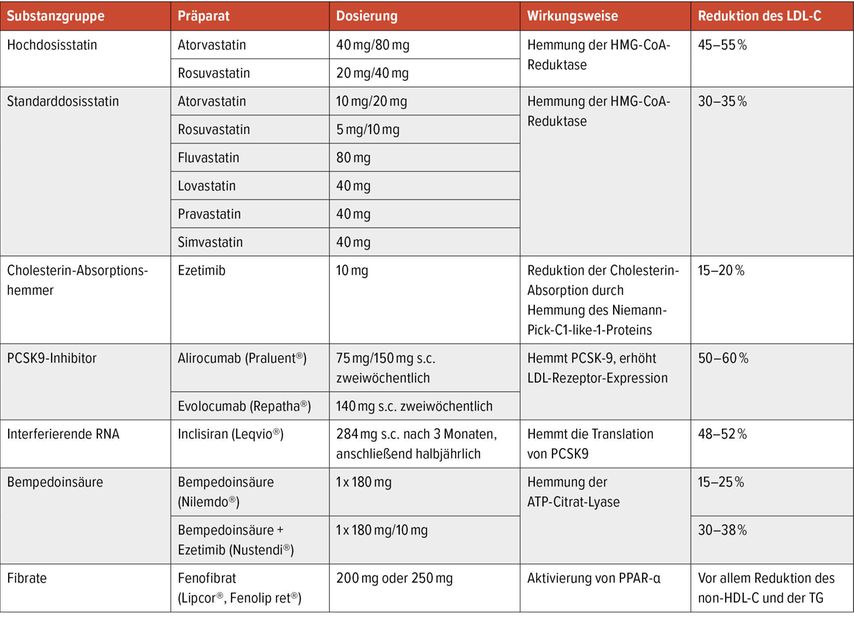
Tab. 1:Aktuell verfügbare Therapien zur Lipidsenkung
Diät und medikamentöse Therapie
Bei Patienten mit moderatem oder geringem Risiko werden in erster Linie Diät und körperliche Aktivität empfohlen. Wenn nach drei Monaten die angegebenen Grenzwerte weiterhin überschritten werden, sollte eine medikamentöse Therapie in Betracht gezogen werden. Bei Hochrisikopatienten muss die medikamentöse Therapie immer unmittelbar begonnen werden. Basierend auf den Daten zahlreicher randomisierter Studien umfasst die derzeitige Basis der LDL-C-Senkung (Tab. 1, Abb.1) zur Reduktion des kardiovaskulären Risikos Statine, Ezetimib und Proprotein-Convertase-Subtilisin-Kexin-Typ-9(PCSK9)-hemmende monoklonale Antikörper. Neue Therapieoptionen sind Inclisiran und die Bempedoinsäure.
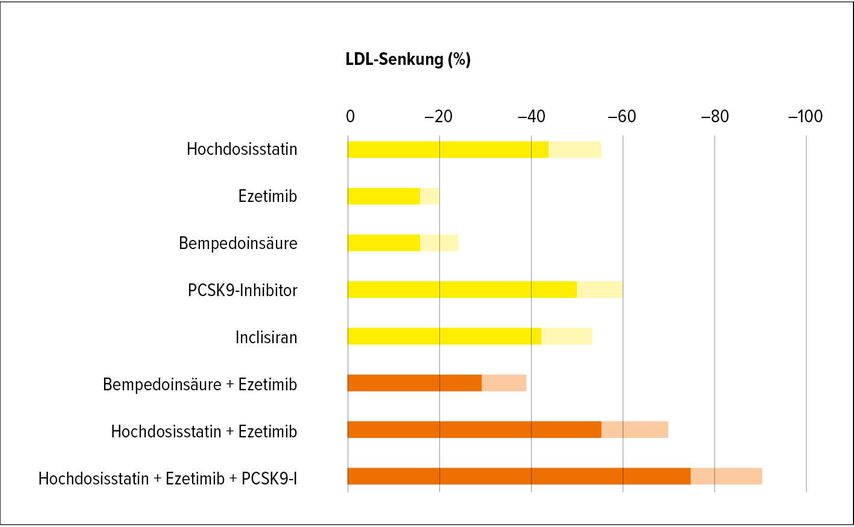
Abb. 1:Prozentuelle LDL-Senkung, mit der bei Lipidsenkern gerechnet werden kann
Statine
Statine waren die ersten Lipidsenker, die eine konsistente Reduktion des kardiovaskulären Risikos zeigten, was sie zu den am besten untersuchten Medikamenten in der kardiovaskulären Medizin macht. Die Daten zeigen, dass eine Senkung des LDL-C um 40mg/dl zu einer relativen Reduktion der Mortalität aus kardiovaskulärer Ursache um 20% führt. Statine hemmen einen Schritt der Cholesterin-Biosynthese, die Hydroxymethylglutaryl(HMG)-CoA-Reduktase, in der Leber. Eine Statintherapie in moderater Dosierung senkt das LDL-C um etwa 30 bis 35%, während eine Hochdosisstatintherapie das LDL-C um 45 bis 55% senkt. Damit stellen Hochdosisstatine die Erstlinientherapie für Patienten mit hohem oder sehr hohem kardiovaskulärem Risiko dar. Studien zeigen, dass Statine in der Anwendung sicher sind; Daten aus randomisierten kontrollierten Studien zeigen, dass Statine gut verträglich sind. Obwohl von Patienten wahrgenommene Nebenwirkungen durch Statine häufig sind, ist die Rate an unerwünschten Ereignissen für Statine gering. Bei langer Anwendung erhöhen Statine geringfügig das Risiko für Diabetes mellitus. Dies sollte jedoch keinen Einfluss auf die Nutzen-Risiko-Abwägung bei Personen mit moderatem oder hohem kardiovaskulärem Risiko haben, jedoch zu einer Nutzen-Risiko-Abwägung bei Personen mit niedrigem kardiovaskulärem Risiko führen. Erhöhungen der Leberenzyme treten bei 0,5–2% auf, daher wird empfohlen, die Leber- und Cholesterinwerte 4 bis 8 Wochen nach Beginn der Statintherapie zu kontrollieren. Auch sollte in diesem Zeitraum auf das mögliche Auftreten einer Statinunverträglichkeit geachtet werden.
Ezetimib
Ezetimib senkt das LDL-C durch Verringerung der intestinalen Absorption von Cholesterin in der Darmwand und reduziert das LDL-C als Monotherapie oder in Kombination zusätzlich zu einem Statin um ca. 15% bis 20%. Bei Patienten mit sehr hohem Risiko und einem Ausgangs-LDL-C >100mg/dl soll direkt mit einer Kombinationstherapie aus Hochdosisstatin und Ezetimib begonnen werden, da nicht anzunehmen ist, dass der Zielbereich mit einer Statinmonotherapie sicher erreicht wird.
PCSK9-Inhibitoren
PCSK9-Inhibitoren – Alirocumab und Evolocumab – sind monoklonale Antikörper, werden im Abstand von zwei Wochen subkutan verabreicht und senken das LDL-C um 50–60%. PCSK9-Inhibitoren binden an zirkulierendes PCSK9, welches für den Abbau der LDL-Rezeptoren der Hepatozyten verantwortlich ist, und erhöhen dadurch die Anzahl der LDL-Rezeptoren an der Zellmembran, indem diese das Recycling der Rezeptoren in der Zelle verhindern. Entsprechend wird die Aufnahme von LDL-C in die Leberzellen über diese Rezeptoren erhöht, womit die körpereigene Cholesterinsynthese reduziert wird. In Studien haben PCSK9-Inhibitoren die Rate an kardiovaskulären Ereignissen reduziert und ein sehr günstiges Nebenwirkungsprofil gezeigt. PCSK9-Inhibitoren sind derzeit für Patienten mit kardiovaskulären Erkrankungen in der Sekundärprävention oder bei Patienten mit familiärer Hypercholesterinämie (FH) auch in der Primärprävention zugelassen, wenn mit einer Kombinationstherapie aus maximal verträglichem Statin und Ezetimib das LDL-C-Ziel nicht erreicht wird. In Österreich kann die Erstverschreibung von PCSK9-Inhibitoren nur von spezialisierten Zentren vorgenommen werden.
Inclisiran
Inclisiran ist eine lang wirkende synthetische kleine interferierende RNA, die subkutan verabreicht wird und die Translation des Proteins PCSK9 hemmt. Es bewirkt eine hepatozytenspezifische, intrazelluläre Hemmung von PCSK9, indem es selektiv die Translation der PCSK9-mRNA durch Bindung an den RNA-induzierten Silencing-Komplex verhindert (Abb. 2). Inclisiran wurde im Dezember 2020 von der Europäischen Union zugelassen. In der Zulassungsstudie zeigte sich eine anhaltende LDL-C-Senkung von bis zu 52% bei Patienten mit erhöhtem LDL-C trotz maximal verträglicher Statintherapie. Wichtig ist, dass die Wirkung von Inclisiran lang anhaltend ist und zu einer nachhaltigen Senkung des LDL-C-Wertes führt: Das derzeit vorgeschlagene Dosierungsschema erfordert eine Dosis zu Beginn und nach 90 Tagen, danach wird Inclisiran zweimal jährlich verabreicht. Die derzeit laufende randomisiert-kontrollierte ORION-4-Studie zielt darauf ab, die Wirkung der Inclisiran-Behandlung auf das klinische Outcome bei Menschen mit kardiovaskulären Erkrankungen zu untersuchen. Mit zwei Dosen pro Jahr hat Inclisiran das Potenzial, Probleme mit der langfristigen Adhärenz zu vermeiden, die bei aktuellen Therapien auftreten.
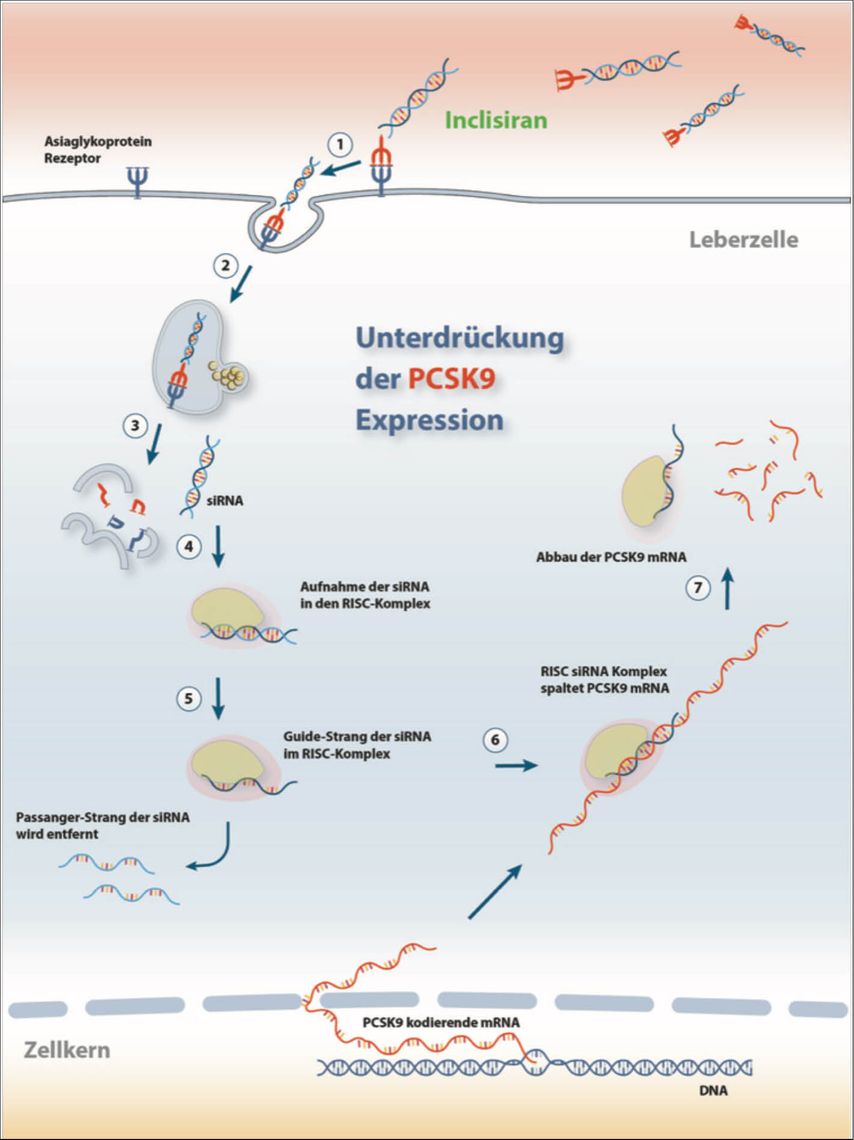
Abb. 2:Wirkprinzip von Inclisiran
Bempedoinsäure
Bempedoinsäure ist als Monopräparat oder in Kombination mit Ezetimib seit Kurzem in Österreich erhältlich. Diese neue Substanz hemmt die Cholesterinsynthese eine Stufe höher als Statine und senkt als Monopräparat das LDL-C um ca. 15 bis 25% und in Kombination mit Ezetimib bis zu 38%. Bempedoinsäure kann auch in Kombination mit einem Statin oder anderen lipidsenkenden Therapien bei Patienten eingesetzt werden, deren LDL-Cholesterin-Zielwerte mit der maximal verträglichen Statin-Dosis nicht erreicht werden. Im Gegensatz zu den Statinen ist die Bempedoinsäure ein Prodrug und wird erst in der Leber aktiviert, weshalb keine Muskelbeschwerden als Nebenwirkung auftreten und die Therapie deshalb auch besonders gut für Patienten mit Statinintoleranz geeignet ist.
Fibrate
Bei Hochrisikopatienten mit einem TG-Wert >200mg/dl soll versucht werden, mit einer Statintherapie ein Non-HDL-C-Ziel von 85mg/dl oder 100mg/dl zu erreichen. Falls dies nicht gelingt, kann das Statin mit einem Fenofibrat kombiniert werden. Fenofibrat sollte man nicht mit der höchsten Statindosis (Atorvastatin 80mg oder Rosuvastatin 40mg) kombinieren, und die GFR muss >60ml/min/1,73 m2 betragen. Bezafibrat und Gemfibrozil sollen nicht mit Statinen kombiniert werden.
Lipidtherapie bei speziellen Patienten
Statinunverträglichkeit
Studien haben gezeigt, dass eine tatsächliche Statinunverträglichkeit bei nur 5–10% der Patienten vorliegt. Die klinischen Manifestationen einer Statinunverträglichkeit sind sehr heterogen und reichen von leichter Schwäche, Krämpfen und Muskelschmerzen bis hin zu der sehr seltenen und schweren Rhabdomyolyse. Bei der häufigsten Form (>80%) handelt es sich um Muskelschmerzen ohne oder mit leichter Erhöhung der Kreatinkinase. Zur Bestimmung der Wahrscheinlichkeit einer Statinbeteiligung an Myalgien wurde ein Scoring-System entwickelt, der SAMS Clinical Index (SAMS-CI). Dieser Index basiert auf der Verteilung der Symptome, dem Zeitpunkt des Auftretens der Symptome und der Reaktion der Patienten auf das Absetzen und Wiederaufnehmen eines Statins. Da das Absetzen des Statins in der Sekundärprävention einer der wichtigsten Risikofaktoren für ein neues kardiovaskuläres Ereignis ist, sollte klinisch beobachtet werden, ob sich die Muskelsymptome nach Absetzen des Statins tatsächlich bessern und nach der Therapie mit mindestens einem anderen Statin wieder auftreten. Außerdem wird empfohlen, Ezetimib mit einer niedrigeren Statindosis oder künftig mit Bempedoinsäure zu kombinieren. Wenn in der Sekundärprävention Atorvastatin und Rosuvastatin nicht vertragen werden und der LDL-C-Wert trotz Ezetimib über dem Zielwert liegt, sollte der Patient in ein Zentrum zur Verordnung eines PCSK9-Inhibitors oder von Inclisiran überwiesen werden.
Lipoprotein-(a)-Erhöhung
Lipoprotein-(a)-Spiegel sind genetisch determiniert und können nicht durch eine Diät oder Statintherapie beeinflusst werden. Lp(a) sollte zumindest einmal im Leben bestimmt werden. Ein Wert über 50mg/dl (125nmol/l) ist mit einer Erhöhung des kardiovaskulären Risikos verbunden. Ist das Lp(a) mit >180mg/dl (430nmol/l) stark erhöht, müssen diese Patienten genau wie Patienten mit FH behandelt werden. Da Lp(a) derzeit nicht gesenkt werden kann, soll bei Patienten mit erhöhtem Lp(a) versucht werden, dass kardiovaskuläre Risiko durch eine intensive LDL-C-Senkung zu reduzieren. Bei Patienten mit Lp(a) über 100mg/dl (240nmol/l) und dem Nachweis einer progredienten kardiovaskulären Erkrankung trotz idealer LDL-C-Senkung soll der Einsatz einer Lipidapherese evaluiert werden. Eine neue Antisense-Oligonukleotid-Therapie befindet sich derzeit in klinischer Erprobung. In einer randomisierten placebokontrollierten Phase-II-Studie hatte sich die Antisense-Therapie als hochwirksam herausgestellt. Die erste Phase-III-Studie läuft seit 2020.
Familiäre Hypercholesterinämie (FH)
Bei Patienten mit einem LDL-C >190mg/dl und positiver Familienanamnese muss an eine heterozygote familiäre Hypercholesterinämie (FH) gedacht werden ( www.fhscore.eu ). Die FH ist die häufigste monogenetische Erbkrankheit (1:200 bis 1:500) mit einem massiv erhöhten kardiovaskulären Risiko. Studien haben gezeigt, dass trotz einer Statintherapie Menschen mit FH ein Durchschnittsalter von nur etwa 60 Jahren erreichen. Patienten mit FH haben einen Mindest-LDL-C-Zielwert von <70mg/dl und sollen an ein spezialisiertes Zentrum überwiesen werden. Besonders wichtig ist, bei Patienten mit FH ein Familienscreening durchzuführen, um die Diagnose bei möglichst vielen Angehörigen stellen zu können, da eine rechtzeitige Therapie die Prognose deutlich verbessern kann.
Literatur:
1 Mach F et al.: 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020; 41(1): 111-88
Autoren:
Dr. Lore Schrutka
Priv.-Doz. Dr. Konstantin Krychtiuk
Assoc. Prof. Dr. Klaus Distelmaier
Assoc. Prof. Dr. Walter Speidl
Medizinische Universität Wien
Universitätsklinik für Innere Medizin II, Klinische Abteilung für Kardiologie
E-Mail: lore.schrutka@meduniwien.ac.at