Kardioonkologie: Erste Leitlinie in Europa
Autoren:
Dr. Andreas Spannbauer
A.o. Univ.-Prof. Dr. Jutta Bergler-Klein, FESC, FHFA, FEACVI
Herzambulanz und Kardioonkologie-Spezialambulanz
Universitätsklinik für Innere Medizin II
Abteilung für Kardiologie
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Seit September 2022 liegt die erste europäische Leitlinie der ESC zum Themenkomplex der Kardioonkologie vor.Sie umfasst 133 Seiten und ist in Zusammenarbeit der EHA (European Hematology Society), ESTRO (European Society for Therapeutic Radiology and Oncology) und IC-OS (International Cardio-Oncology Society) entstanden.
Keypoints
-
Die neuen Leitlinien für Kardioonkologie unterstreichen die Wichtigkeit einer Baseline-Risikostratifizierung für alle onkologischen Patient*innen, bevor eine onkologische Therapie begonnen wird.
-
Diese Baseline-Risikostratifizierung sollte zügig vorgenommen werden und den Beginn der onkologischen Therapie nicht verzögern.
-
Krebspatient*innen sollten, abhängig von ihrem kardiovaskulären Risiko und ihrer Krebstherapie, regelmäßige kardiologische Kontrolluntersuchungen erhalten.
-
Die kardiovaskuläre Mortalität und Morbidität sind bei Krebsüberlebenden dauerhaft erhöht. Diese Patient*innen benötigen langfristiges, strukturiertes kardiologisches Follow-up.
Krebspatient*innen und „cancer survi- vors“ (CS) weisen eine stark erhöhte kardiovaskuläre (CV)Mortalität und Morbidität auf.1 An dieser Schnittstelle von Kardiologie und Onkologie ist die Fachrichtung der Kardioonkologie entstanden, die versucht, das CVRisiko dieser Patient*innen richtig einzuschätzen und präventive sowie therapeutische Maßnahmen zu ergreifen, um die CVMortalität und Morbidität zu reduzieren. Bislang gab es zu diesem komplexen Thema diverse Position Statements, die im September 2022 durch ein internationales Task-Force-Gremium, unter Mitarbeit aus Österreich durch Prof.in Bergler-Klein, zur ersten Kardioonkologie-Leitlinie der ESC (European Society of Cardiology) zusammengefasst wurden.2
Die sehr umfassenden Leitlinien mit über 250 Empfehlungen („recommendation figures und tables“) auf 133 Seiten enthalten systematisch genaue Vorgaben, insbesondere bezüglich der initialen Baseline kardialer Risikostratifizierung, des kardiovaskulären Monitorings während der Krebstherapie je nach zugrunde liegendem CV-Risiko und Art der onkologischen Therapie, der Behandlungsmöglichkeiten und des Vorgehens bei CTR-CVT („cancer therapy-related cardiovascular toxicity“) sowie Empfehlungen für das langfristige Follow-up nach Beenden der Krebstherapie.
Wir wollen im Folgenden einen kurzen Überblick über die wichtigsten Definitionen und Empfehlungen der aktuellen Leitlinien für die tägliche Praxis geben.
Das Wichtigste: „Baseline Risk Assessment“
Die Leitlinien betonen die Wichtigkeit der kardialen Risikostratifizierung vor Beginn der onkologischen Behandlung (Klasse-I-Empfehlung) anhand eines „Baseline Risk Assessment“. Der Beginn der onkologischen Therapie sollte hierdurch jedoch nicht verzögert werden. Es sollen eine genaue kardiale Anamnese (kardiale Vorerkrankungen), Erfassung onkologischer Vorbehandlungen (vorhergegangene Chemotherapien, Bestrahlung), körperliche Untersuchung (Zeichen von Herzinsuffizienz, Beinödeme), EKG (Rhythmus, QT-Zeit, ST-Veränderungen), Blutdruckmessung, Erfassung von CVRisikofaktoren (Lipidpanel, HbA1c), Bestimmung kardialer Biomarker (NT-proBNP, kardiales Troponin [Troponin T; TnT, Troponin I; TnI]) und eine Echokardiografie durchgeführt werden. Anhand der angeführten Risikotabellen (HFA-ICOS Proformas) für jede einzelne Chemo-/Immun-/ onkologische Therapiegruppe kann das kardiovaskuläre Risiko als sehr hoch/hoch, moderat oder gering eingeschätzt werden, je nach der onkologischen Therapie (z.B. für Anthrazykline, VEGF-Inhibitoren/Tyrosinkinase-Inhibitoren, HER2-gezielte Therapie). Kardiale Risikofaktoren sollen nach den aktuellen ESC-Leitlinien als primäre und sekundäre Prävention schon zu Beginn der onkologischen Therapie umgehend behandelt werden (Klasse I). Bei Patient*innen mit hohem kardialem Risiko wird erstmals schon im Vorhinein eine Therapie mit ACE-Hemmern oder Angiotensinrezeptor-Blocker (ARB) und Betablockern sowie Statinen empfohlen (Klasse IIa). Je nach Risikoprofil soll auch ein entsprechendes Monitoringschema mit kardiovaskulären Verlaufsuntersuchungen ausgewählt werden (Klasse I).
What’s new?
Neue Definitionen von CTR-CVT
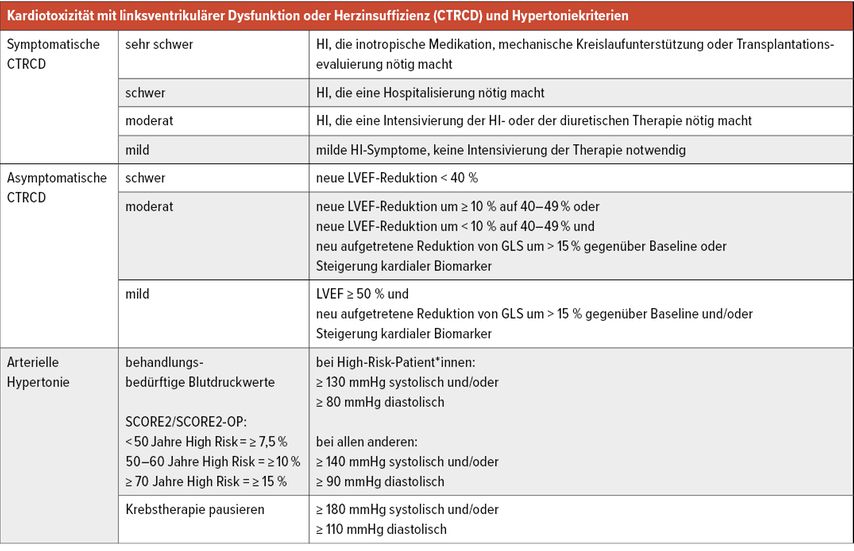
Die bisher stark unterschiedlichen Definitionen von Kardiotoxizität mit auftretender Herzinsuffizienz und linksventrikulärer Dysfunktion (CTRCD, „cancer therapy-related cardiac dysfunction“) wurden vereinheitlicht (Tab. 1). Die Echokardiografie wird als First-Line-Modalität zur Erfassung der kardialen Funktion bei Krebspatient*innen empfohlen (Klasse I). Dabei soll die linksventrikuläre Ejektionsfraktion (LVEF) bestimmt werden, möglichst mittels 3D, sowie der „Global longitudinal strain“ (GLS) mittels Speckle-Tracking, wenn vorhanden (Klasse I).
Unter HER2-gezielter Therapie wird als Monitoring generell bei allen Patient*innen eine Echokardiografie alle 3 Monate empfohlen, mit LVEF und GLS, wenn vorhanden (Klasse Ib, unabhängig von der Risikoklasse, wobei bei Niedrigrisiko im Verlauf die Frequenz der Kontrollen reduziert werden kann). Die Abnahme von Biomarkern (NT-pro/BNP und Troponin) soll bei Hochrisikopatient*innen alle 3 Monate in Erwägung gezogen werden (Klasse IIa; bei Niedrigrisiko Klasse IIb).
Eine häufige Nebenwirkung vieler onkologischer Therapien (z.B. bei VEGF-Tyrosinkinase-Inhibitoren, Myelomtherapien [bspw. Proteasominhibitoren oder monoklonalen Antikörpern wie Daratumumab u.a.]) ist eine ausgeprägte Hypertonie. Diese kann Gefäßschädigungen, Ischämien oder Herzinsuffizienz auslösen. Generell sind die Behandlungsziele arterieller Hypertonie, basierend auf SCORE2 (<70 Jahre) und SCORE2-OP (≥70 Jahre) für Krebspatient*innen nun definiert (Tab.1). ACE-Hemmer/ARB und Dihydropyridin-Kalziumkanalblocker werden in der Behandlung von Bluthochdruck bei Krebspatient*innen empfohlen (Klasse I). Verapamil und Diltiazem hingegen werden aufgrund von möglichen Medikamenteninteraktionen nicht empfohlen (KlasseIIIc). Diagnostische Kriterien für die seltene, aber bei Auftreten oft schwerwiegende ICI-(Immun-Checkpoint-Inhibitor-)Myokarditis werden in den Leitlinien ausformuliert und asymptomatische sowie symptomatische vaskuläre Toxizitäten definiert. Ebenso werden die Behandlungspfade von ICI-assoziierter Myokarditis oder anderen Toxizitäten (z.B. Perikarditis) angeführt.
Die Leitlinien enthalten auch genaue Empfehlungen zu einem oftmals schwierigen Thema: akute Koronarsyndrome (ACS) und Plaquerupturen bei Krebspatient*innen unter laufender Therapie (z.B. unter Cisplatin, Fluoropyrimidinen (5-Fluorouracil; 5-FU), Capecitabin, Bestrahlungen, Tyrosinkinase-Inhibitoren [z.B. Sunitinib], ICI etc.).
Eine invasive Herzkatheterstrategie wird bei Patient*innen mit STEMI oder Hochrisiko-NSTEMI/ACS mit einer Lebenserwartung ≥6 Monaten empfohlen (Klasse Ib). Bei Krebspatient*innen mit ACS und Thrombopenie <10000/μl wird die Gabe von Aspirin nicht empfohlen (Klasse III). Clopidogrel wird bei einer Thrombozytenzahl <30000/μl, Prasugrel oder Ticagrelor werden bei Thrombozyten <50000/µl nicht empfohlen (Klasse III).
Empfehlungen für die Praxis
Wie bereits erwähnt, gibt es je nach ausgewählter Chemotherapie eine unterschiedliche Risikostratifizierung und Empfehlungen für Monitoring und Follow-up. In der kostenlosen ESC-Pocket-Guidelines-App sind Risk-Assessment-Formulare und ein Rechner online verfügbar, welche die Risikostratifizierung erleichtern sollen.3
Um die Stratifizierung in der allgemeinen Praxis einfacher zu gestalten, sind in Tabelle 2 häufige kardiologische Diagnosen aufgeführt, die in den meisten Risk-Assessment-Scores automatisch eine Einstufung als High-Risk-Patient*in und somit engmaschiges Follow-up notwendig machen. Bei allen Patient*innen soll zu Beginn ein EKG durchgeführt werden (Klasse I). Hochrisikopatient*innen sollten generell an eine Kardiologin/einen Kardiologen überwiesen werden; bei komplexer kardiovaskulärer Vorgeschichte, reduzierter Linksventrikelfunktion oder bereits durchgeführter Chemotherapie mit Kardiotoxizität ist eine Überweisung an eine kardioonkologische Spezialambulanz wünschenswert. Diesbezüglich ist das Gesundheitswesen gefordert, weitere Kardioonkologiezentren zu ermöglichen und die Strukturen für die Kontrolluntersuchungen mit den häufigen Echokardiografien und Biomarkerbestimmungen zu schaffen.
Empfehlungen für die Therapie von CTRCD und Fortsetzen onkologischer Therapien
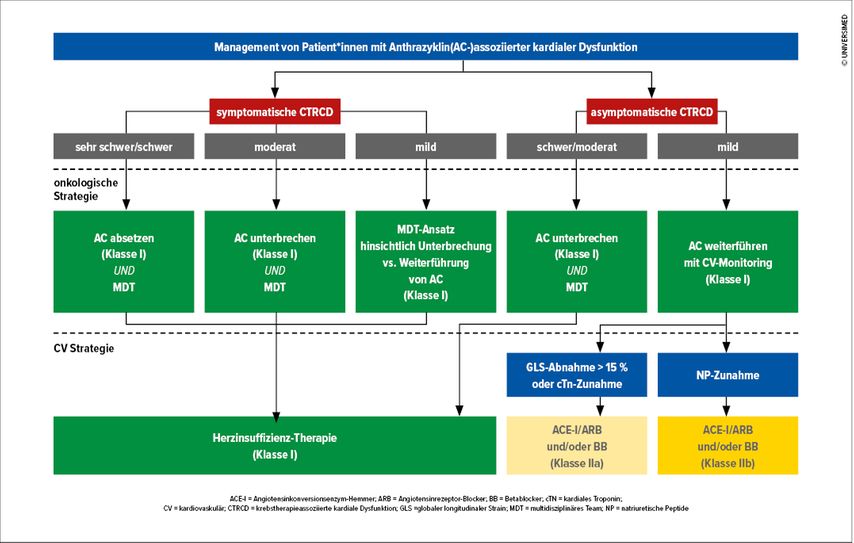
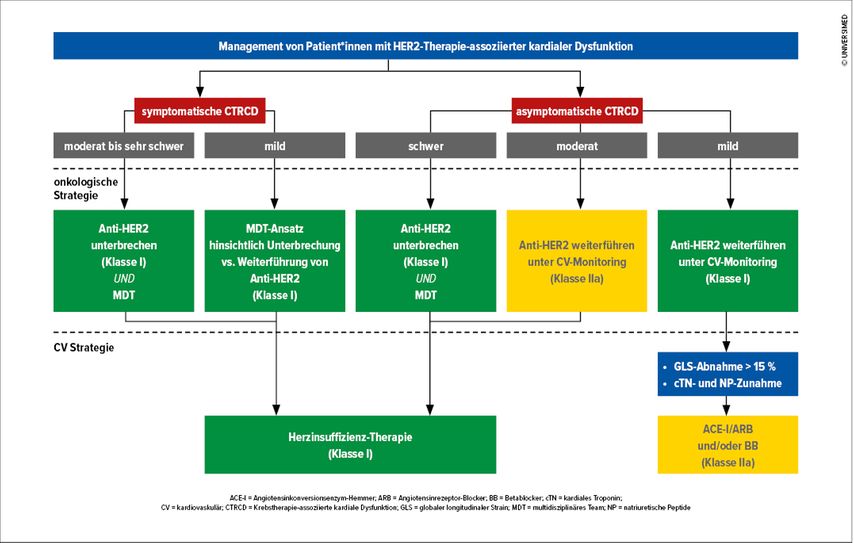
Wenn während der Chemotherapie die diagnostischen Kriterien für eine symptomatische CTRCD oder schwere bis moderate asymptomatische CTRCD (Tab.1) erfüllt sind, wird eine den aktuellen ESC-Leitlinien entsprechende Herzinsuffizienztherapie empfohlen. Bei asymptomatischer milder CTRCD wird eine Therapie mit ACE-Hemmern/ARB ± Betablocker empfohlen. Eine Unterbrechung der Chemo- oder gezielten Therapie ist nur in Fällen einer moderaten/schweren symptomatischen CTRCD und einer schweren asymptomatischen CTRCD (LVEF-Abfall<40%) empfohlen, ansonsten kann die onkologische Therapie unter engmaschiger Kontrolle und adäquater kardialer Therapie und interdisziplinärer Besprechung fortgeführt werden (Abb. 1). Bei HER2-gezielter Therapie (z.B. Trastuzumab, Pertuzumab bei Brustkrebs oder gastrointestinalen Tumoren) kann die Therapie bei asymptomatischer moderater kardialer Dysfunktion mit Abfall der LVEF auf 40–49% unter häufigerem Monitoring fortgeführt werden (Klasse IIa; Abb. 2).
Die Leitlinien geben auch Empfehlungen für das Monitoring nach abgeschlossener Chemotherapie. Am Ende der Krebstherapie soll ein weiteres komplettes kardiales Risk-Assessment stattfinden. Hierbei sollen Veränderungen des CV-Risikoprofils und möglicherweise aufgetretene CTR-CVT in die Risikokalkulation einfließen. Insbesondere bei Anthrazyklinen und Anti-HER2-Therapien soll bereits nach 3 Monaten eine Kontrolle inkl. Echokardiografie stattfinden, da hier eine verzögerte Diagnose einer CTR-CVT erwiesenermaßen zu einem schlechteren kardialen Therapieansprechen führt (z.B. bei Herzinsuffizienz). Für andere Therapien wird meist ein Follow-up alle 6–12 Monate empfohlen, mittels klinischer Untersuchung, EKG, Echokardiografie und Biomarkerbestimmung, je nach Risikoeinschätzung. Patient*innen nach Bestrahlung (vor allem mediastinal oder links thorakal) haben ebenfalls ein erhöhtes kardiales Risiko. Junge Patient*innen nach Hodgkin-Lymphomen (insbesondere nach Anthrazyklinen und mediastinaler Bestrahlung) oder Hodenkarzinomen (insbesondere nach Cisplatin) sowie Erwachsene nach kindlichen Tumoren sollten lebenslang nachkontrolliert werden.4 Kardiale Risikofaktoren (z.B. Cholesterin) sollen regelmäßig erfasst werden (Klasse I).
Die Leitlinien weisen auch darauf hin, dass langfristige Hormontherapien wie Aromatasehemmer oder antiandrogene Therapien ebenso ein erhöhtes CV-Risiko mit sich bringen. Die Patient*innen sollten über ihr erhöhtes kardiales Risiko und die Vorteile eines gesunden Lebensstils und regelmäßiger kardialer Kontrollen eingehend aufgeklärt werden (Klasse I).
Resümee
Die neuen ESC-Leitlinie für Kardioonkologie erfordern interdisziplinäre Zusammenarbeit sowie vorausschauende Therapieplanung, zugeschnitten auf die individuellen Bedürfnisse jeder Patientin/jedes Patienten. Die Einhaltung der Leitlinien wird auch die Bereitstellung von neuen Ressourcen hinsichtlich Echokardiografie, Biomarkerkontrollen und Finanzierung von kardioonkologischen Zentren notwendig machen, um das Überleben und die Lebensqualität dieses wachsenden Patientenkollektivs zu erhalten und zu verbessern.
Quelle:
Erstpublikation in Universum Innere Medizin, Sonderheft 2022; 8: 12-15
Literatur:
1 Sturgeon KM et al.: A population-based study of cardiovascular disease mortality risk in US cancer patients. Eur Heart J 2019; 40: 3889-97 2Lyon AR, López-Fernández T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J et al.: ESC scientific document group. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J 2022; 43(41):4229-361 3 European Society of Cardiology: ESC Pocket Guidelines App. https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/Guidelines-derivative-products/ESC-Mobile-Pocket-Guidelines ; zuletzt aufgerufen am 15.12.2022 4 Van Dalen EC, Mulder RL, Suh E, Ehrhardt MJ, Aune GJ, Bardi E, Benson BJ, Bergler-Klein J et al.: Coronary artery disease surveillance among childhood, adolescent and young adult cancer survivors: A systematic review and recommendations from the International Late Effects of Childhood Cancer Guideline Harmonization Group. Eur J Cancer. 2021; 156: 127-37
Das könnte Sie auch interessieren:
Funktionsstörung des Myokards: wenn die Entspannung des Herzens gestört ist
Die hypertropheobstruktive Kardiomyopathie (HOCM) ist dadurch charakterisiert, dass die Entspannung des Myokards funktionsgestört ist. Die Folge ist eine zunehmende Verdickung der ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...