Herzinsuffizienztherapie 2022
Autorin:
Priv.-Doz. Dipl.-Ing. Dr. Noemi Pavo, PhD
Abteilung für Kardiologie
Universitätsklinik für Innere Medizin II
Medizinische Universität Wien
E-Mail: noemi.pavo@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Herzinsuffizienz (HI) ist die Endstrecke vieler kardiovaskulärer Erkrankungen mit einer Prävalenz von 1–4% der Gesamtbevölkerung, hohen Hopistalisierungsraten und schlechter Prognose trotz der Fortschritte der Therapie der letzten 40 Jahre. Im Folgenden wird das Aktuellste aus dem Bereich der modernen HI-Therapie kompakt zusammengefasst.
Keypoints
-
HFrEF: Die 4 Säulen der medikamentösen Therapie sind ACE-I/ARNI, Betablocker, Mineralokortikoid-Rezeptorantagonisten und SGLT2-I.
-
HFrEF: „4 drugs in 4 weeks“ soll bei allen Patienten etabliert und optimiert werden.
-
HFrEF: Intravenöse Eisencarboxymaltose wirkt positiv auf den Eisenstatus und verbessert die Leistungsfähigkeit und kann eine Reduktion von HI-Hospitalisierungen erzielen auf eine Reduktion von HI-Hospitalisierungen.
-
HFrEF: Orale Kaliumbinder, Patiromer und Natrium-Zirkonium-Cyclosilikat, können die Implementierung der HI-Therapie unterstützen.
-
HFmrEF und HFpEF: Aufgrund der seit dem Erscheinen der Leitlinien 2021 veröffentlichten Studienergebnisse ist künftig eine Empfehlung für SGLT2-I zur Therapie zu erwarten.
-
Akute HI: Die ADVOR-Studie unterstreicht eine rasche und intensive Rekompensationstrategie mittels einer diuretischen Kombinationstherapie.
Obwohl die zugrunde liegende Ätiologie und Pathomechanismen mannigfaltig sein können, wird die HI traditionellerweise nach der linksventrikulären Auswurfsleistung (LVEF) laut ESC in die 3 Klassen Heart Failure with Reduced Ejection Fraction (HFrEF, LVEF ≤40%), Heart Failure with Mildly Reduced Ejection Fraction (HFmrEF, LVEF 41–49%) und Heart Failure with Preserved Ejection Fraction (HFpEF, LVEF >50%) eingeteilt. Diese Einteilung wurde in Studien, die die Wirksamkeit der verschiedenen Therapien in der HI untersuchten, benutzt. Entsprechend ist die LVEF essenziell, um Patienten evidenzbasierte Therapien zukommen zu lassen.
Die Leitlinien der ESC 2021 zur Behandlung der HI beinhalteten bereits viele Neuerungen im Vergleich zu den letzten Leitlinien aus dem Jahr 2016 inklusive Einzug neuer Substanzklassen und Änderungen im Behandlungsalgorithmus der HFrEF und neuer Empfehlungen für die HFmrEF-Gruppe. Rezentere Studien zeigen erstmals wirksame Therapieoptionen für die HFpEF.
Therapie der HFrEF
ARNI (Angiotensin-Rezeptor-Neprilysin-Inhibitor)
Der ARNI kombiniert die Inhibierung des RAS mit der Inhibierung von Neprilysin, einer Endopeptidase, die neben vielen Substraten auch natriuretische und vasoaktive Peptide abbaut. Sacubitril/Valsartan war in PARADIGM-HF Enalapril überlegen und reduzierte den primären Endpunkt kardiovaskulärer (CV) Tod und HI-Hospitalisierung beeindruckenderweise um 20% (p=0,0000004). Post-hoc-Analysen zeigten, dass dieser Effekt rasch auftritt und eine signifikante Risikoreduktion bereits ab dem zweiten Monat erkennbar ist. Die Erstgabe von ARNI wurde für die stabile HFrEF nicht explizit getestet, weswegen die „Angiotensin-converting enzyme“-Inhibitoren (ACE-I) und ARNI gemeinsam eine Säule der HFrEF-Therapie mit einer Klasse-I-Indikation bilden.
SGLT2-I („Sodium-dependent glucose co-transporter 2“-Inhibitor)
DAPA-HF und EMPEROR-Reduced untersuchten die Wirksamkeit von Dapagliflozin und Empagliflozin bei der HFrEF und überzeugten mit einer deutlichen Reduktion des kombinierten Endpunktes kardiovaskulärer Tod und HI-Hospitalisierung im Vergleich zu Placebo um 25%, wobei die HI-Hospitalisierung deutlicher gesenkt wird. Die beiden Vertreter der Substanzklasse wurden sogleich mit einer Klasse-I-Indikation versehen. Die SGLT2-I sind somit nach den ARNI als zweite große Neuerung der modernen Therapie der HI zu sehen.
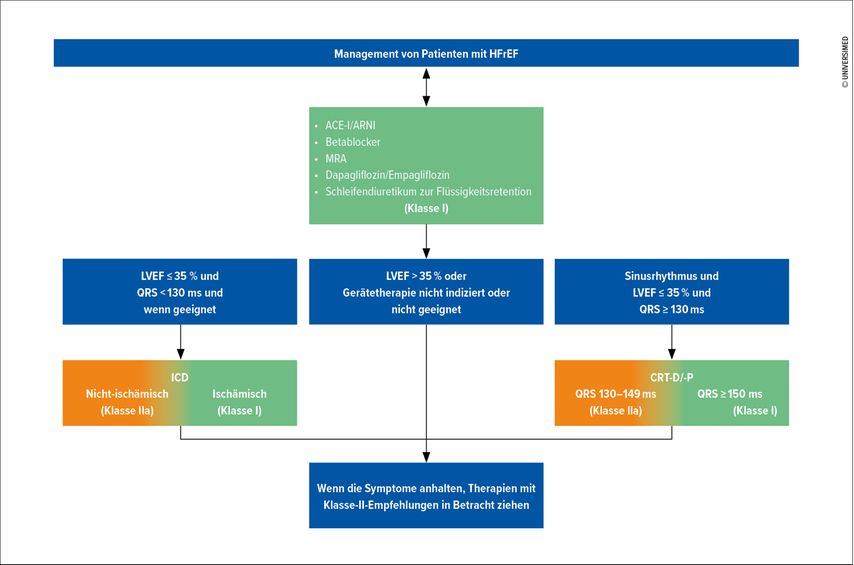
Therapiealgorhithmus: „4 drugs in 4 weeks“
Der neue Behandlungsalgorithmus zeigt als wesentliche Veränderung eine Aufhebung der Sequenz bei der Therapieeinleitung und Auftitration der 4 Säulen der medikamentösen HFrEF-Therapie (Abb. 1). ACE-I/ARNI, Betablocker (BB), Mineralokortikoid-Rezeptorantagonisten (MRA) und SGLT2-I sind nun an erster Stelle gleichwertig gestellt. Obwohl sich im Text der Leitlinien nach wie vor Hinweise auf die historisch gewachsene Sequenzierung finden, zieht sich das neue Paradigma der raschen Therapieoptimierung durch. Sobald die Diagnose der HFrEF gesichert ist, sollten „4 drugs in 4 weeks“ bei allen Patienten etabliert und optimiert werden.
Abb. 1: Der neue Behandlungsalgorithmus der ESC-Leitlinien 2021 für Herzinsuffizienz. Die Sequenz bei den Schlüsseltherapien „fantastic four“ (ACE-I/ARNI, BB, MRA, SGLT2-I) wurde aufgehoben. Mit dem teilweise gleichzeitigen Beginn und teilweise schnellerer Auftitration der jeweiligen Substanzklassen soll die Behandlungslücke verringert werden. (Abbildung nach doi:10.1093/eurheartj/ehab368) (PMID: 34447992)
Obwohl diese Therapien mit einer Mortalitätsreduktion einhergehen, weist die Implementierung in allen Ländern, auch Österreich, große Lücken auf. Der Anteil der Patienten, die mit der Diagnose HFrEF optimal versorgt sind, erreicht laut Registerdaten nicht einmal 10%. Die Gründe für diese sogenannte „clinical inertia“ (Trägheit der Therapieintensivierung) sind vielfältig und beinhalten systemrelevante, patienten- und arztbezogene Faktoren mit unterschiedlicher Beteiligung. Der neue vereinfachte Algorithmus ohne strenge Vorgabe der Sequenz, Initiierungs- und Titrationszeitpunkt, der individuell angepasst werden kann, bietet die Möglichkeit, der optimierten Versorgung ein wesentliches Stück näher zu kommen und somit weitere Hospitalisierungen und Tode zu vermeiden.
Neue Wirkmechanismen – Omecamtiv mecarbil und Vericiguat
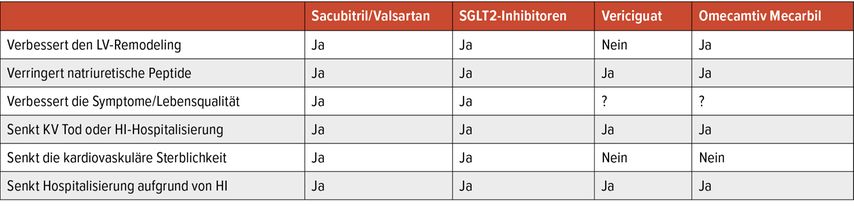
Neben der Gruppe der neurohumoralen Antagonisten und den SGLT2-I wurde die HI-Therapie zusätzlich um Substanzen mit neuartigen Wirkmechanismen reicher. Omecamtiv mecarbil (OM) und Vericiguat finden aufgrund der ermutigenden Ergebnisse erster Phase-III-Studien Erwähnung in den Leitlinien und könnten in Zukunft die Therapie für Hochrisikopatienten erweitern. Vericiguat wurde bereits mit einer Klasse-IIb-Indikation hinterlegt. Die Evidenz der HFrEF-Therapien ist in Tabelle 1 zusammengefasst.
Tab. 1: Zusammenfassung der Benefits der neueren HFrEF-Therapien auf klinische Endpunkte. (Abbildung nach doi:10.1161/CIRCRESAHA.121.318158) (PMID 33983832)
Nachdem die meisten Inotropika in der Behandlung der HI bisher gescheitert sind, zeigte nun OM als erste Substanz positive Effekte auf harte klinische Endpunkte. OM ist ein selektiver, ans Sarkomer gerichteter Myosin-Aktivator, der die Aktin-Myosin-Interaktion verstärkt, ohne dabei zusätzlich Sauerstoff zu verbrauchen oder in das Kalzium-Handling einzugreifen. Die Phase-II-Studie COSMIC-HF zeigte eine Abnahme des NT-proBNP, der Herzfrequenz und des LV-Durchmessers. GALACTIC-HF randomisierte 8256 Patienten und konnte eine relative Risikoreduktion von 8% (p=0,03) in Bezug auf den kombinierten Endpunkt CV Tod oder HI-Ereignis bei Patienten mit LVEF ≤35%, NYHA ≥II und NT-proBNP >400pg/ml nachweisen. Die Komponenten des primären Endpunktes oder die Gesamtmortalität konnten nicht signifikant gesenkt werden. Der Effekt schien bei Patienten mit niedrigerer LVEF und hohem NT-proBNP sowie, wie eine Post-hoc-Analyse zeigte, bei einer Hospitalisierung in den letzten 6 Monaten verstärkt, sodass dies eine Therapieoption der fortgeschrittenen HI sein könnte. Obwohl die Studie positive Effekte nachweisen konnte, ist die Weiterentwicklung der Substanz derzeit noch unsicher.
Vericiguat gehört zu den Stimulatoren der löslichen Guanylatzyklase und fördert somit die Bildung von zyklischem Guanosinmonophosphat (cGMP) und dessen Signalweg über NO, der beim Vorliegen einer HI verringert ist. Der Mangel an cGMP trägt zur vaskulären endothelialen Dysfunktion bei und beeinträchtigt die myokardiale Relaxation. Vorstudien haben gezeigt, dass Vericiguat in der HI sicher ist und zur Senkung des NT-proBNP-Spiegels führt. VICTORIA untersuchte die Wirksamkeit von Vericiguat bei HI-Patienten mit hohem Risiko mit rezenter Hospitalisierung für HI oder Gebrauch von Diuretika und erhöhte NTproBNP-Spiegel mit einer LVEF <45%. Die Studie zeigte bei einer medianen Nachbeobachtungszeit von lediglich 10,8 Monaten eine relative Risikoreduktion von 10% (p=0,02) im kombinierten Endpunkt CV Tod oder HI-Hospitalisierung, wobei die einzelnen Komponenten nicht signifikant reduziert waren. In der Subgruppenanalyse schien der Effekt eher in dem niedrigeren als höheren NT-proBNP Bereich (bis ca. 5000pg/ml) verstärkt. Weitere Studien, die Vericiguat in der stabilen HI untersuchen, sind derzeit im Laufen und werden hoffentlich die Zielpopulation für diese Therapie genauer definieren. Vericiguat wurde von der Food and Drug Administration (FDA) in den USA und von der European Medicines Agency (EMA) in Europa zugelassen.
Komorbiditäten – Eisenmangel und Hyperkaliämie
Eisenmangel
Eisenmangel (definiert nach HI-Kriterien) liegt bei mehr als 50% der Patienten mit HI vor und ist unabhängig von der Anämie mit einer eingeschränkten Leistungsfähigkeit und schlechter Prognose verbunden. FAIR-HF und CONFIRM-HF zeigten positive Effekte von intravenöser Eisencarboxymaltose (FCM) auf den Eisenstatus und verbesserten die Leistungsfähigkeit mit Hinweis auf Reduktion von HI-Hospitalisierungen bei Patienten mit LVEF ≤40% und ≤45%. Weitere Studien, IRONMAN (Eisen-Isomaltosid), FAIR-HF2, HEART-FID und FAIR-HFpEF (Eisencarboxymaltose), untersuchen derzeit die Effekte von intravenösem Eisen auf klinisch harte Endpunkte im gesamten Spektrum der HI.
Hyperkaliämie
Die neuartigen oralen Kaliumbinder Patiromer und Natrium-Zirkonium-Cyclosilikat (ZS-9) können die Implementierung der Therapie der HI sinnvoll unterstützen. Die Leitlinien empfehlen, dass RAAS-Inhibitoren bei einer Hyperkaliämie je nach Ausprägung vorsichtig begonnen und auftitriert oder sogar dosisreduziert oder abgesetzt werden sollten. Dementsprechend erhalten viele HFrEF-Patienten nicht alle Wirkstoffe bzw. diese nicht in den Zieldosierungen. Diese Patienten haben eine schlechtere Prognose. Patiromer und ZS-9 binden Kalium im Gastrointestinaltrakt und führen zu einer raschen Normalisierung der Serumkaliumkonzentration. In PEARL-HF wurden 105 Patienten mit Hyperkaliämie zu Patiromer und Placebo randomisiert, wobei gezeigt wurde, dass das Kalium bei Patienten in der Verumgruppe normalisiert werden konnte und dass dadurch die Therapie HI etabliert werden konnte. Der Effekt der Kaliumbinder auf HI-Hospitalisierungen und Mortalität wird in weiteren Studien untersucht.
Therapie der HFmrEF und HFpEF
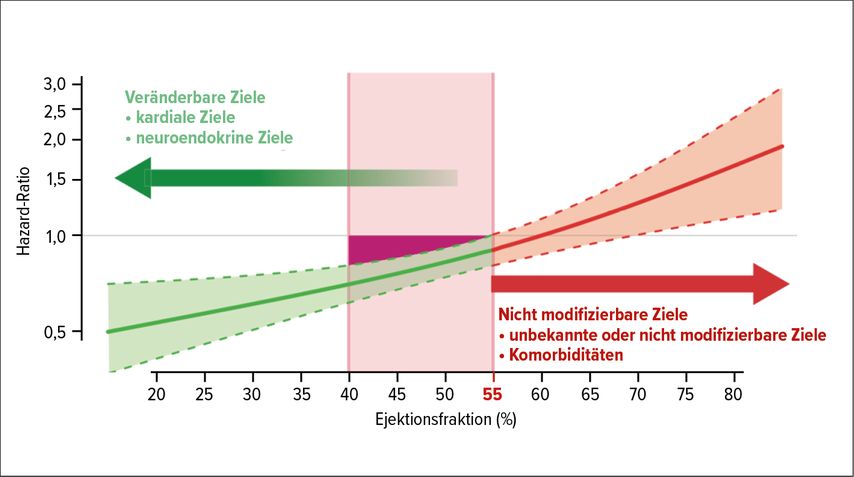
Etwa 20% aller HI-Patienten haben eine HFmrEF. Die Gruppe der Grenzzonen ist vermutlich heterogen und beinhaltet sowohl Patienten mit einer vebesserten HFrEF als auch einer verschlechterten HFpEF, die unterschiedliche Pathophysiologien und Prognosen haben. Das Ansprechen der HFmrEF-Patienten auf die HI-Therapien wurde bisher in keiner prospektiven Studie untersucht. In den Leitlinien 2021 gibt es erstmals eine Therapieempfehlung für die HFmrEF-Gruppe. Gepoolte Daten aus HFrEF- und HFpEF-Studien legen einen Benefit der HFrEF-Substanzen bis zu einer LVEF von 50% nahe, sodass nun ACE-I/ARNI, BB und MRA der HFrEF auch für Patienten mit HFmrEF empfohlen werden (Abb. 2).
Abb. 2: Behandlungseffekte von ARNI, BB und MRA in Abhängigkeit von der LVEF. Bei 41–49% (HFmrEF) haben alle diese Substanzen positive Behandlungseffekte, obwohl sie in diesem Bereich nicht prospektiv getestet wurden. Der Grenzwert für die LVEF scheint bei etwa 55% zu liegen. Bei einer LVEF >55% scheinen unbekannte oder nicht modifizierbare Ziele und nicht kardiovaskuläre Komorbiditäten für diesen Behandlungen unzugänglich zu sein. (Abbildung nach doi: 10.1093/eurheartj/ehaa281) (PMID 32350518)
Zum Zeitpunkt, als die Leitlinien veröffentlicht wurden, gab es praktisch keine Evidenz für eine medikamentöse Therapie, die die Mortalität oder Morbidität bei HFpEF verbessert. Der ARNI wurde bereits vorher in PARAGON für Patienten mit einer LVEF >45% getestet und verfehlte die Verbesserung des primären Endpunktes knapp (p=0,059), wobei der Effekt bei Patienten mit einer niedrigeren LVEF ausgeprägter schien.
SGLT2-I
Neu jedoch, und deshalb noch nicht in den Leitlinien erwähnt, sind die Ergebnisse der SGLT2-I-Studien bei der HI bei LVEF >40%, also HFmrEF und HFpEF. EMPEROR-Preserved war die erste positive Studie in dieser Patientenpopulation und stellt einen Wandel in der Behandlung dar. Empagliflozin konnte in einem mittleren Follow-up-Zeitraum von 26 Monaten das Risiko für CV Tod oder Hospitalisierung um 21% senken (p<0,001), wobei der Endpunkt von der Reduktion der Hospitalisierungen getragen wird. DELIVER folgte ein Jahr später und zeigte ähnlich gute Ergebnisse für Dapagliflozin mit einer relativen Risikoreduktion von 18% (p=0,0008) bei dem Endpunkt CV Tod oder Verschlechterung der HI, wobei auch hier bei den Einzelkomponenten nur die Verschlechterung der HI und nicht der CV Tod signifikant reduziert wurde. Metaanalysen der beiden Substanzen zeigen eine konstante Risikoreduktion der Hospitalisierung über das gesamte LVEF-Spektrum. Aufgrund dieser Datenlage ist ein Update in den Behandlungsempfehlungen für die HFmrEF und HFpEF zu erwarten.
Rasche Therapieeinleitung nach Stabilisierung bei akuter HI
Während sich im Management des akut hospitalisierten HI-Patienten in der akuten und der intermediären Phase bis zur Stabilisierung in den letzten Jahrzehnten kaum etwas geändert hat, zeigt die Datenlage immer deutlicher, dass eine Therapieeinleitung und -optimierung an HI-Therapien während der Vorentlassungs-Phase von enormer Bedeutung für den weiteren Verlauf der Erkrankung ist. Laut dem europäischen Langzeitregister ESC-HF-LT stellen mit 60% generell die meisten Fälle einer akuten HI Verschlechterungen einer chronischen HI dar, wobei die Mehrzahl der Patienten eine Flüssigkeitsretention bei normaler Perfusion (Forrester Class II) aufweist.
Zunächst sollte eine komplette Rekompensation mittels Diuretika erzielt werden. Die erst kürzlich veröffentlichte ADVOR- Studie untersuchte die Wirksamkeit der Kombination von Acetazolamid zu Furosemid bei akut dekompensierten Patienten, die bereits eine etablierte stabile orale Dosis an Furosemid hatten. ADVOR zeigte nach 3 Tagen mit 42,2% vs. 35,0% eine signifikant höhere Anzahl an erfolgreichen Rekompensationen, wobei der Unterschied bis zur Entlassung erhalten blieb. Die Kombination mit Thiaziden und SGLT2-I wurde nicht untersucht. Dies unterstreicht die Wichtigkeit einer raschen und aggressiven Rekompensationsstrategie mit Kombination verschiedener Diuretika.
Die Therapie der chronischen HI sollte während des Aufenthalts womöglich beibehalten bzw. optimiert werden. Hier gilt, dass nur bei symptomatischer Hypotonie, schwerer Hyperkaliämie und einem Anstieg der Serum-Kreatinins >50% die RAAS-Inhibitoren temporär abgesetzt werden sollten. PIONEER-HF sowie SOLOIST-HF und EMPULSE zeigten, dass der Start mit ARNI und SGLT2-I noch im stationären Setting sicher ist und frühe Rehospitalisierungen vermeiden kann. Ähnliches gilt für i.v. Eisensubstitution mit Eisencarboxymaltose, die seit der AFFIRM-AHF-Studie auch für akut hospitalisierte Herzinsuffizienzpatienten bis zu einer LVEF von ≤50% empfohlen ist. Die erst kürzlich veröffentlichen Ergebnisse von STRONG-HF bestätigen diese Strategie erneut. STRONG-HF zeigte, dass eine intensive Behandlung mit rascher Auftitration von ACE-I/ARNI, BB und MRA bei Hospitalisierung nach einem akuten HI-Ereignis sicher ist und den primären Endpunkt von Rehospitalisierung und Tod innerhalb von 180 Tagen signifikant senken kann (p=0,0021). Die komplette Rekompensation, die Einleitung und gegebenenfalls Auftitration an HI-Therapie noch im Aufenthalt sowie ein kurzfristiger ambulanter Kontrolltermin werden in den Leitlinien mit einer Klasse-I-Indikation belegt.
Literatur:
bei der Verfasserin