_Ben%20Gingell.jpg)
Die Therapie des bidirektionalen Duos im Kontext der aktuellen Wissenschaft
Universitätsklinik für Innere Medizin II<br>Klinische Abteilung für Kardiologie<br>Medizinische Universität Wien<br> E-Mail: henrike.arfsten@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Herzinsuffizienz und Diabetes mellitus Typ 2 stehen in engem, einander beeinflussendem Zusammenhang. Die Datenlage zur optimalen, zunehmend individualsierten Therapie wächst und entsprechend wandeln sich die Empfehlungen. Ein Überblick zu Studien und aktuellem Wissensstand.
Keypoints
Herzinsuffizienz und Diabetes mellitus beeinflussen einander in ihrer Krankheitsentstehung und -progression und potenzieren das Risiko für Herzinsuffizienz-Hospitalisierung, allgemeine und kardiovaskuläre Mortalität.
Aufgrund des erhöhten Risikos ist eine frühzeitige leitliniengerechte Therapieinitiierung sowohl bei Diabetes als auch der Herzinsuffizienz unabdingbar. Die empfohlene Herzinsuffizienztherapie richtet sich nicht nach dem Vorliegen eines Diabetes mellitus.
Für den herzinsuffizienten Diabetiker ist eine moderate Blutzuckereinstellung anzustreben. Der optimale HbA1c zeigt einen u-förmigen Kurvenverlauf und liegt zwischen 7% und 7,9%.
In Zusammenschau mit ihrem Effekt auf die kardiovaskuläre und Gesamtmortalität sind die SGLT2-Inhibitoren (Empagliflozin, Canagliflozin und Dapagliflozin) beim herzinsuffizienten Diabetiker als Erstlinientherapie ausdrücklich empfohlen (ESC/EASD: Klasse I Level A).
Hintergrund – Herzinsuffizienz und Typ-2-Diabetes-mellitus
Herzinsuffizienz (HI) und Diabetes mellitus (DM) sind ein häufiges, sich in seiner Krankheitsprogression und Prognose bidirektional beeinflussendes Duo. Epidemiologische Daten zeigen einen weltweit progredienten Anstieg der Prävalenz sowohl des Typ-2-Diabetes (global >383 Mio.) als auch der Herzinsuffizienz (global >63 Mio. Menschen; etwa 1:1 systolische und diastolische HI).1 Beide Erkrankungen gelten als unabhängige Risikofaktoren der jeweils anderen. In der Herzinsuffizienz (HFrEF, HFmrEF, HFpEF) liegt die Prävalenz des T2D bei 30–40% (etwa 25% HFrEF und etwa 75% HFpEF).2 Bei Menschen mit Diabetes wird die Prävalenz der HI mit 9–22% angegeben, was einem 2- bis 4-fach höheren Vorkommen gegenüber der nichtdiabetischen Bevölkerung entspricht (Framingham). Die Diagnose HI bedeutet ungeachtet existierender Leitlinien zur optimalen HI-Therapie eine schlechte Prognose und ist gekennzeichnet von einer 5-Jahres-Mortalität von 75% und Hospitalisierungsraten von 82%3 – Koexistenz von T2D und HI potenziert diese Zahlen.
Das diabetische Herz
Liegt neben dem Diabetes keine andere Ursache wie eine koronare Herzerkrankung, arterielle Hypertonie oder chronische Niereninsuffizienz vor, die als pathophysiologische Komponente die Ätiologie einer HI bedingen kann, hat sich die Entität diabetische Kardiomyopathie mit multifaktorieller Genese etabliert.4 Diabetes-assoziierte Veränderungen des Herzens inkludieren anatomische, strukturelle und funktionelle Umbauprozesse, die in der kardialen Dysfunktion enden.5 Wesentliche Charakteristika der diabetischen Kardiomyopathie sind eine initial erhöhte myokardiale Steifigkeit und eine (subklinische) diastolische Dysfunktion. Dies kann mit Krankheitsprogression zu einer beeinträchtigten systolischen Linksventrikelfunktion (LVF) führen und durch anhaltende Druck- und Volumenbelastung in einer manifesten HI mit reduzierter Auswurffraktion (HFrEF) resultieren. Die Einflussfaktoren sind pleiotrop. Bei gestörter Glukosetoleranz sind durch unzureichende Glukoseverwertung mit Shift zum inkompletten Fettsäuremetabolismus vermehrt reaktive toxische Metabolite des Glukose- und Fettstoffwechsels im Herzmuskel nachweisbar und tragen zur strukturellen sowie funktionellen Leistungseinbuße bei.
Zu den funktionellen Störungen wie endothelialer Dysfunktion als Vorstufe einer beschleunigten Koronarsklerose sowie Mikro- und Makroangiopathie zählen eine periphere Insulinresistenz, strukturelle Komponenten (u.a. linksventrikuläre Hypertrophie), myokardiale Fibrose, elektrophysiologische Defekte, Kalziumüberladung und oxidativer Stress mit lokaler Aktivierung des Renin-Angiotensin-Systems (RAS) und einem gesteigerten Sympathikotonus. Bereits das Vorliegen einer gestörten Insulinresistenz im Rahmen eines Prä-Diabetes geht mit einem deutlich erhöhten Risiko für die Entwicklung einer HI einher. Bei manifestem T2D steigt das Risiko für eine HI-Entstehung um 8–36% pro Anstieg des HbA1c um 1%.6
Trotz bereits multipler etablierter Therapieoptionen stehen beide Komorbiditäten (T2D und HI) weiterhin im Fokus der Wissenschaft. Aktuelle Aspekte der Therapie der HFrEF bei Diabetes sowie der Diabetestherapie bei Herzinsuffizienz werden im Folgenden diskutiert.
Therapie HFrEF & T2D
Herzinsuffizienztherapie für den Typ-2-Diabetiker
Die Diagnostik der diabetischen Kardiomyopathie unterscheidet sich bei Menschen mit T2D nicht von den durch die ESC-Leitlinien empfohlenen, allgemein gültigen Diagnosekriterien der Herzinsuffizienz (NT-proBNP, Echokardiografie etc.).7 Auch die herzinsuffizienzspezifische Therapie mit RAS-Blockade (ACE-Hemmer, ARB, Angiotensin-Rezeptor-Neprilysin-Inhibitor [ARNi])8, Betablocker (BB)9 und Mineralokortikoid-Rezeptor-Antagonist (MRA) ist ungeachtet des Vorliegens eines Diabetes mellitus bei allen Patienten gleich. Es liegen keine randomisierten klinischen Studien vor, die den Effekt herzinsuffizienzspezifischer bzw. kardiovaskulärer Therapieansätze (Medikamente, Devices) ausschließlich bei Diabetikern mit HI getestet haben. Wir können jedoch aufgrund der derzeitigen Datenlage (Subanalysen) davon ausgehen, dass die etablierten therapeutischen Ansätze der HFrEF ungeachtet des Vorliegens eines T2D gleichermaßen vorteilhaft für die HI sind.7
Im Speziellen vorteilhaft für die Blutzuckertherapie hat sich beispielsweise der ARNI Sacubitril/Valsartan gezeigt. Im Vergleich zur ACE-Hemmer-Monotherapie erzielte die Kombinationstherapie eine ausgeprägtere HbA1c-Reduktion mit protrahierterem insulinfreiem Krankheitsverlauf.10 Zu beachten gilt es, dass Niereninsuffizienz und Hyperkaliämie häufiger bei Patienten mit HI und T2D beobachtet werden. Eine entsprechende Therapieanpassung von RAS-Blockade und MRA ist in diesem Fall gegebenenfalls indiziert.
Neben der Indikation zur herzinsuffizienzspezifischen Therapie stellt eine ergänzende Therapiesäule die blutzuckerregulierende Therapie im hier diskutierten Patientenkollektiv „Herzinsuffizienz und Typ-2-Diabetes-mellitus“ dar (Tab. 1 und 2).
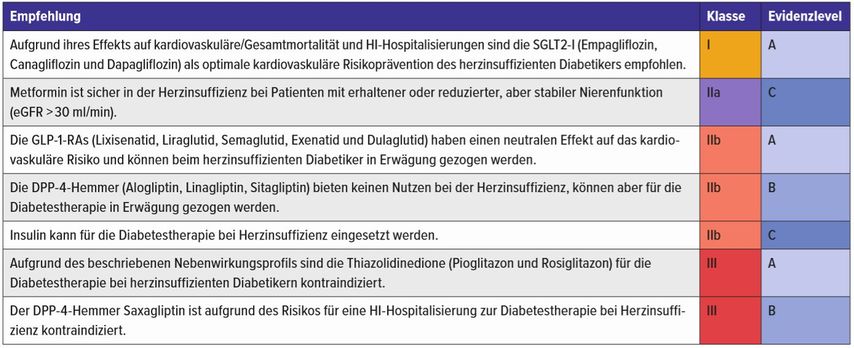
Tab. 1: ESC-Empfehlungen zur Diabetestherapie bei Herzinsuffizienz14

Tab. 2: Übersicht über die verfügbaren Diabetestherapien in Bezug auf die Herzinsuffizienz49
Therapieziele: Dynamik des optimalen Blutzuckers
Was sind nun die Ziele der Diabetestherapie bei Patienten mit T2D und HI und in welcher Form unterscheiden sich diese Patienten womöglich von Patienten ohne HI? Derzeit verfügbare blutzuckerregulierende Wirkstoffklassen und ihr potenzieller Einfluss auf kardiovaskuläre Ereignisse, Herzinsuffizienz und Outcome sollen in weiterer Folge vorgestellt werden.
In der Therapie des Diabetes ist ein klassischer Diagnose- und Verlaufsparameter der HbA1c. Obwohl eine dauerhaft hyperglykäm entgleiste Stoffwechsellage mit einem gesteigerten Risiko der Entwicklung einer HI einhergeht, zeigen vorliegende Daten keinen Benefit einer intensiven Blutzuckerreduktion bei Patienten mit bereits etablierter HI und T2D. Prospektive Beobachtungsstudien gehen von einer moderaten Blutzuckereinstellung als Optimum bei Patienten mit HI und T2D aus. Liegen beide Erkrankungen vor, ist eine steigende Inzidenz von HI und/oder HI-Hospitalisierung erst ab HbA1c-Werten >8% beschrieben. Tatsächlich liegen zudem Daten vor, die einen gleichwertigen Anstieg von herzinsuffizienzassoziierten Ereignissen im niedrigen HbA1c-Bereich ab Werten <6% zeigen. Das Verhältnis optimaler HbA1c und Mortalität/Hospitalisierung bei Patienten mit etablierter HI orientiert sich an einem u-förmigen Kurvenverlauf, wobei die geringsten Mortalitätsraten/optimalen Outcomedaten bei herzinsuffizienten Diabetikern im Bereich eines HbA1c zwischen 7% bis 7,9% liegen (Abb. 1).11, 12
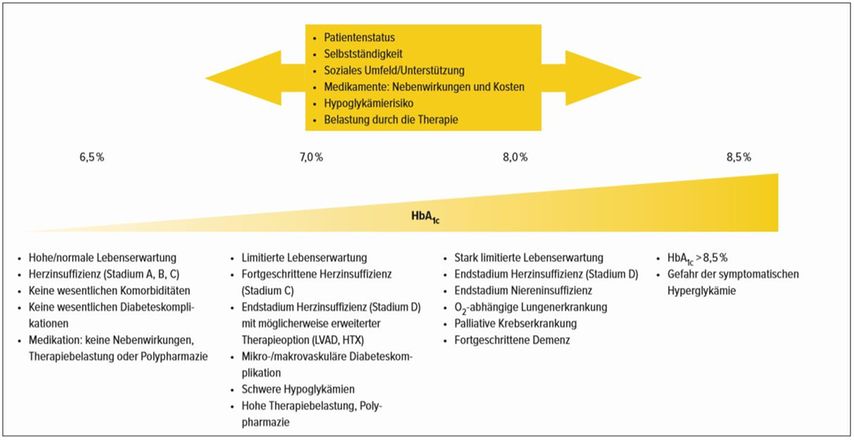
Abb. 1: Individualisierte HbA1c-Therapieziele des herzinsuffizienten (HFrEF) Diabetikers13
Grundsätzlich gültige Aspekte, die in der blutzuckerregulierenden Therapieverschreibung berücksichtigt werden sollten inkludieren: Art der Verabreichung, Hypoglykämierisiko, chronische Niereninsuffizienz, Kontraindikationen und potenzielle Nebenwirkungen.
Evidenz zu Substanzklassen und deren kardiovaskulärer Benefit
Metformin bei T2D & HI
Es liegen keine prospektiven randomisierten Studien zum Einsatz von Metformin bei Patienten mit T2D und diagnostizierter HI vor. Dennoch stellte Metformin unter den blutzuckerregulierenden Medikamenten, unter Berücksichtigung möglicher Kontraindikationen, hier bis vor Kurzem die alleinige Therapie der 1. Wahl dar.14 Initiale Bedenken bezüglich eines möglicherweise gehäuften Auftretens von Laktat-Azidosen bei der HI unter Metformintherapie sind ausgeräumt.15 Verglichen mit Insulin und Sulfonylharnstoffen (SU) geht Metformin mit einer Reduktion von Tod und HI-Hospitalisierung einher, wobei hier der potenziell negative Einfluss der SU auf die HI in der Ergebnisinterpretation nicht auszuschließen ist.16 Darüber hinaus haben multiple Beobachtungsstudien einen Überlebensbenefit gezeigt. U.a. konnte in einer Metaanalyse von 9 Kohortenstudien (Patienten: n=34000) sowohl eine Mortalitätsreduktion (adjustierte Risikoreduktion [RR]: 0,80 [95% CI: 0,74–0,87]) als auch eine Hospitalisierungsreduktion (adj. RR: 0,93 [95% CI: 0,89–0,98]) bei Diabetikern mit HI gegenüber nicht herzinsuffizienten Diabetikern gezeigt werden.17
Klinischer Stellenwert
Metformin ist sicher und stabil bei der Herzinsuffizienz bei Patienten mit erhaltener oder reduzierter, aber stabiler Nierenfunktion (eGFR >30ml/min).14 Sollte es zum Auftreten von Symptomen einer Laktatazidose kommen, muss Metformin abgesetzt werden. Für Metformin ist durch die ESC (2019) eine Klasse-IIa-, Evidenzlevel-C-Empfehlung zur Diabetestherapie bei Patienten mit Herzinsuffizienz ausgesprochen.14 (Tab. 1)
Sulfonylharnstoffe bei T2D & HI
Die Datenlage zu den Sulfonylharnstoffen (SU) bei Diabetespatienten im Hinblick auf ihr HI-Risiko ist bei limitierter Zahl prospektiver Studien divergierend. Vorliegende Beobachtungsstudien verzeichnen eine gesteigerte Assoziation zwischen SU und HI-Events im Vergleich zur Metformintherapie oder alternativen Präparaten wie Dipeptidyl-Peptidase-4(DPP-4-)Inhibitoren.16, 18–20 Klinische randomisierte Studien zu SU, die das klinische Outcome bei der etablierten HI untersuchen, liegen keine vor. Beobachtungsdaten an rund 16400 Patienten haben zwar keine erhöhte Mortalität nach akuter HI-Hospitalisierung unter der Therapie mit SU gezeigt (Hazard-Ratio [HR]: 0,99; 95% CI: 0,91–1,08), demgegenüber war jedoch Metformin signifikant mit einer Mortalitätsreduktion assoziiert (HR: 0,87; 95% CI: 0,78–0,97).21 Ein deutlicherer Überlebensnachteil bei SU-Therapie konnte bei 422 Patienten nach HI-Hospitalisierung beobachtet werden: Patienten mit SU-Monotherapie zeigten eine 30–40% höhere Mortalität im 1-Jahres- und Langzeit-Verlauf gegenüber der Therapie mit Metformin oder der Kombinationstherapie mit Metformin und SU.22,23Daten aus Schweden an 52760 Patienten zeigten die Kombinationstherapie mit Metformin und SU gegenüber der Therapie mit Metformin und DPP-4-Inhibitor hinsichtlich Hypoglykämie (adj. HR: 2,07; 95% CI: 1,11–3,86), kardiovaskulärer Events (adj. HR: 1,17; 95% CI: 1,01–1,37) und Mortalität (adj. HR: 1,25; 95% CI: 1,02-1,54) unterlegen.24 Es liegen aber auch Daten multizentrischer Studien vor, die keine Assoziation der SU mit einer gesteigerten HI-Inzidenz auswiesen (UKPDS25, ADVANCE26).
Klinischer Stellenwert
Basierend auf verfügbaren Daten ist der Einsatz von Metformin oder SGLT2-I dem von Sulfonylharnstoffen bei Patienten mit etablierter Herzinsuffizienz oder erhöhtem Risiko für die Entwicklung einer HI vorzuziehen. Nicht unwesentlich ist für Patienten mit kardiovaskulärem Risiko das eher ungünstige Nebenwirkungsprofil (u.a. Gewichtszunahme, Hypoglykämiegefahr). Die Sulfonylharnstoffe haben keinen Stellenwert in der Therapie des herzinsuffizienten Diabetikers14 (Tab. 1).
Thiazolidindione bei T2D & HI
Für Thiazolidindione (Pioglitazon und Rosiglitazon) ist eine gesteigerte HI-Inzidenz verzeichnet. Sowohl der PROactive-Trial27 (5238 Patienten) zu Pioglitazon als auch die RECORD-Studie28 (4447 Patienten) zur Untersuchung von Rosiglitazon ergaben ein bis zu 2-fach erhöhtes Risiko für das Auftreten von HI und Dekompensation bei Patienten ohne HI-Diagnose zum Einschlusszeitpunkt. Da substanzspezifische zusätzliche Nebenwirkungen auftraten, hatte dies für Rosiglitazon den Zulassungsverlust durch die EMA zur Folge. Die Assoziation zwischen Thiazolidindionetherapie und Herzinsuffizienzdekompensation konnte bei Patienten mit T2D und bereits etablierter HFrEF validiert werden. Als zugrundeliegende Pathophysiologie wird eine Medikationsinduzierte (PPARy-Rezeptor-getriggerte Natrium- und Wasserretention) Ödembildung angenommen. Eine Verschlechterung der linksventrikulären Auswurffraktion per se (ohne Volumenretention) wurde nicht beobachtet29,30 und auch der prinzipielle positive Einfluss auf MACE-Endpunkte ging nicht verloren.
Klinischer Stellenwert
Aufgrund des beschriebenen Nebenwirkungsprofils sind die Thiazolidinedione (Pioglitazon und Rosiglitazon) für die Diabetestherapie der Herzinsuffizienten kontraindiziert (ESC 2019: Klasse III, Evidenzlevel A)14 (Tab 1).
DPP-4-Inhibitoren bei T2D & HI
Nach vier großen randomisierten Studien mit ähnlichem Outcome scheinen die DDP-4-Inhibitoren (DDP-4-I) im Hinblick auf MACE (Major Adverse Cardiac Event) mit Placebo vergleichbarzu sein. Hinsichtlich ihres Einflusses auf die HI liegt jedoch eine Heterogenität zwischen den verschiedenen Präparaten vor.
Die SAVOR-TIMI-53-Studie untersuchte als placebokontrollierte Studie Saxagliptin bei Patienten mit T2D und hohem kardiovaskulärem Risiko. Während der primäre Endpunkt MACE neutral ausfiel, wurde ein erhöhtes relatives Risiko für die HI-Hospitalisierungsrate verzeichnet (27%).31 In der EXAMINE-Studie war dies für Alogliptin als nichtsignifikante Tendenz festzustellen.32 Mit 15000 Patienten war der TECOS Trial die größte randomisierte Studie zur Untersuchung der DPP-4-I (Sitagliptin). Die Studie zeigte keine negative Assoziation zur HI-Hospitalisierung, sodass bei Saxagliptin am ehesten von einem Einzelsubstanzeffekt auszugehen ist.33
Metaanalysen haben aber gezeigt, dass die Therapie mit DPP-4-I im Vergleich zu GLP-1-Rezeptoragonisten (GLP-1-RA) oder SGLT2-I mit einem erhöhten HI-Hospitalisierungsrisiko verknüpft ist (DPP-4-I vs. GLP-1-RA: HR: 1,22; 95% CI: 1,05–1,42 vs. SGLT2-Inhibitor: HR: 1,81; 95% CI: 1,50–2,18).34 Während die Prävalenz der HI in den meisten Studien gering ist, liegt sie in der CARMELINA-Studie zum Inklusionszeitpunkt bei 27%. Es konnte für Linagliptin kein Unterschied bezüglich HI-Hospitalisierung bei Patienten mit zum Einschlusszeitpunkt etablierter HI oder ohne gezeigt werden (HR: 1,00; 95% CI: 0,80–1,25).35 Vildagliptin wurde speziell hinsichtlich seines Effekts auf die LV-Auswurffraktion (LVEF) untersucht (VIVIDD-Studie).36 Es ergab sich hier jedoch für herzinsuffiziente Diabetiker kein therapeutischer Vorteil.36 Rezent hat die MEASURE-HF-Studie (NCT02917031)ihre Rekrutierungsphase abgeschlossen (Saxagliptin, Sitagliptin oder Placebo). In dieser Studie wirddie Dynamik der LVEF bei T2D mit HI untersucht.
Klinischer Stellenwert
Auf der Grundlage gegenwärtiger Daten bieten die DPP-4-Inhibitor (Alogliptin, Linagliptin, Sitagliptin) keinen kardiovaskulären Nutzen bei Menschen mit Diabetes, sie stellen aber eine sicherere Therapiealternative dar. Die Wirkungen bei Patienten mit etablierter HI sind nicht gut untersucht. Hinsichtlich des Nutzen-Risiko-Verhältnisses ist der Einsatz von DPP-4-Hemmern bei Patienten mit etablierter HI oder solchen mit hohem HI-Risiko nicht ausdrücklich empfohlen. Die ESC-Leitlinien deklarieren eine Klasse-IIb-Empfehlung mit Evidenzlevel B für den Einsatz von Sitagliptin und Linagliptin bei Diabetikern mit Herzinsuffizienz. Saxagliptin hingegen ist aufgrund des Risikos einer HI-Hospitalisierung in diesem Patientenkollektiv kontraindiziert (Empfehlungsklasse III, Evidenzlevel B)14 (Tab. 1).
GLP-1-Rezeptor-Agonisten bei T2D & HI
Nach derzeitiger Datenlage der vorliegenden Outcome-Studien zeigen sich die Glucagon-like-Peptide-1-Rezeptor-Agonisten (GLP-1-RA) zumindest neutral, wenn nicht vorteilhaft im Hinblick auf das kardiovaskuläre Risiko der Diabetiker und sind in der Therapie der herzinsuffizienten Diabetiker als sicher einzustufen. Ein explizit protektiver Effekt auf die Herzinsuffizienz hat sich jedoch nicht gezeigt. Der LEADERTrial37 erbrachte für Liraglutid eine Reduktion von MACE und Mortalität. In der SUSTAIN6-38 (Semaglutid) und der EXSCEL-Studie39 (Exenatid) zeigte sich ein zumindest neutrales kardiovaskuläres Sicherheitsprofil.
Vorteilhafte Resultate hinsichtlich kardiovaskulärer Ereignisrate und Nierenfunktion liefert der placebokontrollierte REWINDTrial40 für Dulaglutid. Typ-2-Diabetiker (n=9901) mit bekannter kardiovaskulärer Erkrankung zum Inklusionszeitpunkt oder erhöhtem kardiovaskulärem Risiko wurden eingeschlossen. Der primäre kombinierte Endpunkt kardiovaskulärer Tod, Myokardinfarkt oder Insult fiel für Dulaglutid positiv aus (12,0% vs. 13,4%; HR: 0,88; 95% CI: 0,79–0,99; p=0,026). Für Albiglutid kam die HARMONY-OUTCOMES-Studie zu vergleichbaren Ergebnissen.41
Die GLP-1-RA wurden auch als potenzielle reine HI-Medikamente, ungeachtet des Vorliegens eines Diabetes, untersucht: Die FIGHT-Studie42 untersuchte Liraglutidbei der rezent dekompensierten chronischen HI (LVEF ≤40%; 29% NYHA II und 68% NYHA III/IV; 60% Diabetiker), zeigte aber keine Verbesserung der kardialen Funktion (Beobachtungszeitraum: 180 Tage). Die LIVE-Studie43 (LVEF ≤45%; 31% Diabetiker; Beobachtungszeitraum: 24 Wochen) erbrachte ebenfalls keine Verbesserung der LVEF unter Liraglutidtherapie, zeigte aber eine erhöhte Herzfrequenz und vermehrt kardiovaskuläre Events im Vergleich zu Placebo.
Klinischer Stellenwert
Die GLP1-RA (Lixisenatid, Liraglutid, Semaglutid, Exenatid und Dulaglutid) haben in den großen randomisierten placebokontrollierten Studien einen zumindest neutralen Effekt auf das kardiovaskuläre Risiko gezeigt und können in der Diabetestherapie ungeachtet einer vorliegenden HI in Erwägung gezogen werden. Allerdings gilt eine besondere Vorsicht für den Einsatz nach rezenter HI-Dekompensation, da kleine Studien bei diesen Patienten zumindest einen Trend der Verschlechterung gezeigt haben.42,43 (ESC-Empfehlung: Klasse IIb; Evidenz A)14 (Tab. 1).
SGLT2-Inhibitoren bei T2DM & HI
Die Sodium-Dependent-Glucose-co-Transporter-2-Inhibitoren (SGLT2-I) Empagliflozin, Canagliflozin und Dapagliflozin stellen aktuell die vielversprechendste Errungenschaft in der Therapie des internistischen Patienten mit Diabetes dar, wobei der genaue zum Therapieerfolg führende Wirkmechanismus nicht final verstanden ist. Neben der Blutzuckerregulierung primär durch Glukoseausscheidung im Harn wirken SGLT2-I natriuretisch und diuretisch.
Bezüglich kardiovaskulärer Erkrankungen sind die beobachteten Vorteile nicht ausschließlich mit Blutzuckerregulierung oder Gewichtsreduktion unter der Therapie zu erklären. SGLT2-I zeigen in den placebokontrollierten randomisierten Studiden früh divergierende Kurvenverläufe hinsichtlich kardiovaskulärer Endpunkte. Dies deutet darauf hin, dass SGLT2-I weitere Effekte in der kardiovaskulären und v.a. herzinsuffizienzspezifischen Pathophysiologie ausüben. Dazu zählen Auswirkungen auf hämodynamische Parameter, wie z.B. Plasmavolumen, direkte Effekte auf den kardialen Metabolismus, fibrotisches Remodeling, myokardiale Steifigkeit, Inotropie und Chronotropie.
Der EMPA-REG-OUTCOME-Trial44 randomisierte Patienten mit T2D und kardiovaskulärer Erkrankung. Patienten im Empagliflozin-Studienarm zeigten eine relative Risikoreduktion des primären Endpunktes MACE um 14%, was v.a. durch eine beobachtete Reduktion der kardiovaskulären Mortalität um 38% getriggert war. Außerdem wurde eine Risikoreduktion von HI-Hospitalisierungen um 35% – ungeachtet einer HI-Diagnose zum Studieneinschluss (etwa 10% der Patienten) – detektiert (mit HI-Anamnese: HR: 0,72; 95% CI: 0,50–1,04; ohne HI-Anamnese: HR: 0,63; 95% CI: 0,63–0,78).
Das CANVAS-Programm45 untersuchte die kardiovaskuläre Sicherheit von Canagliflozin. Das relative Risiko des primären kombinierten Endpunktes MACE (kardiovaskulärer Tod, Myokardinfarkt oder Insult) zeigte sich unter Canagliflozin um 14% reduziert, die Risikoreduktion einer HI-Rehospitalisierung konnte hier mit 33% verzeichnet werden. Dies wurde gleichermaßen, ungeachtet einer inital anamnestisch bekannten HI, beobachtet.
In DECLARE-TIMI5846 lag die Inklusionsrate von Diabetikern mit kardiovaskulärer Erkrankung bei 40,6%. Während sich Dapagliflozin für den kombinierten Endpunkt MACE (s. o) der Placebotherapie nicht unterlegen zeigte, ist der zweite primäre Endpunkt, „kardiovaskuläre Mortalität und HI-Hospitalisierung“, für den sich eine signifikante 17%-Reduktion zeigte, hervorzuheben. Dieser Vorteil war v.a. durch die HI-Hospitalisierungsreduktion getrieben. Die erreichten Signifikanzen waren ungeachtet einer HI-Anamnese zum Einschlusszeitpunkt (mit HI-Anamnese: HR: 0,79; 95% CI: 0,63–0,99; ohne HI-Anamnese: HR: 0,84; 95% CI: 0,72–0,99).
Trotz ihrer Studiengröße von 7020 bis 17160 inkludierten Patienten sind die genannten Studien u.a. nicht für HI-Subanalysen gepowert, oder die Definition der HI ist limitiert. Aktuelle RCT untersuchen daher den Stellenwert der SGLT2-I als möglicherweise verkannte HI-Therapeutika in HI-Studienpopulationen ungeachtet des Vorliegens eines T2D.
Die DAPA-HF-Studie47 (n=4744; prä-T2D-Anteil 45%, NYHA II–IV, LVEF ≤40%) zeigte Effektivität und Sicherheit von Dapagliflozin in der HFrEF. Der kombinierte primäre Endpunkt kardiovaskulärer Tod und Hospitalisierung/HI-Verschlechterung wurde durch Dapagliflozin um 26% signifikant gesenkt (HR: 0,74; 95% CI: 0,65–0,85;
p<0,001). Dieser positive Effekt war unabhängig von Diabetes oder etablierter optimierter HI-Therapie (RAS-I, BB, MRA).7 Auch die sekundären Endpunkte wie Verbesserung der Lebensqualität und Mortalitätsreduktion waren unter SGLT2-I-Therapie signifikant überlegen. Mit DELIVER (NCT03619213), EMPEROR-Preserved (NCT03057951) und EMPEROR-Reduced (NCT03057977) untersuchen aktuell drei weitere Studien das Outcome (Mortalität/HI-Hospitalisierung) unter SGLT2-I-Therapie bei Dapagliflozin und Empagliflozin in der HI (HFrEF u/o HFpEF).
Unter den Studien, die die möglicherweise verbesserte körperliche Belastungsfähigkeit der Herzinsuffizienten unter SGLT2-I analysieren, verfehlten EMPERIAL-Preserved and EMPERIAL-Reduced (für Empagliflozin) den primären Endpunkt 6-Minuten-Gehtest (HFA Discoveries 2020), die Ergebnisse von DETERMINE-Preserved (NCT03877224) und DETERMINE-Reduced (NCT03877237) (für Dapagliflozin) sind noch abzuwarten.
Wie eingangs beschrieben ist die dem Therapieerfolg der Outcome-Studien zugrundeliegende Biochemie und Physiologie der SGLT2-I in der HI nicht lediglich mit einer euglykämen Stoffwechsellage zu erklären. Die EMPA-HEART-Studie48 zeigte bereits nach kurzer Zeit eine signifikante Reduktion des LV-Masse-Index unter Empagliflozin und weist damit auf einen Einfluss auf das kardiale Remodeling hin. Weitere Klarheit und Verständnis über den protektiven Wirkmechanismus der SGLT2-I werden die Studien PRESERVED-HF (NCT03030235), DEFINE-HF (NCT02653482), EMBRACE-HF (NCT03030222), ELUCIDATE (NCT03871621) bringen, die sich der Biomarkeranalyse, Hämodynamik sowie struktureller und funktioneller Untersuchung des Herzens widmen.
Klinischer Stellenwert
In Zusammenschau mit ihrem Effekt auf die kardiovaskuläre und Gesamtmortalität sind die SGLT2-I (Empagliflozin, Canagliflozin und Dapagliflozin) als optimale kardiovaskuläre Risikoprävention des Diabetikers ausdrücklich empfohlen. Die bereits vorliegenden vorteilhaften Daten zu den SGLT2-I bei der HI, ungeachtet des Vorliegens eines T2D, lässt ihren Einzug in die HI-Therapie vermuten. Durch die FDA ist Dapagliflozin als reines HI-Medikament bereits bewilligt, in Europa sind wir bezüglich einer Entscheidung durch die EMA derzeit noch erwartungsvoll. Trotz der vorteilhaften Effekte darf das Nebenwirkungsprofil mit Harnwegsinfektionen, euglykämischer diabetischer Ketoazidose und seltenem Nekrose-/Amputationsrisiko unterer Extremitäten (Letzteres nur für Canagliflozin beobachtet) nicht unbeachtet gelassen werden.
Die ESC hat eine Klasse-I-Level-A-Empfehlung für SGLT2-Inhibitorbei herzinsuffizienten Diabetikern ausgesprochen (Tab. 1).14
Literatur:
1 GBD 2016 Disease and Injury Incidence and Prevalence Collaborators: Lancet 2017; 390(10100): 1211-59 2 Boonman-de Winter LJ et al.: Diabetologia 2012; 55(8): 2154-62 3 Shah KS et al.: J Am Coll Cardiol 2017; 70(20): 2476-86 4 Seferović PM et al.: Eur Heart J 2015; 36(27): 1718-27, 27a-27c 5 de Simone G et al.: NMCD 2009; 19(2): 98-104
6 Iribarren C et al.: Circulation 2001; 103(22): 2668-73
7 Ponikowski P et al.: Eur Heart J 2016; 37(27): 2129-200
8 Abuissa H et al.: J Am Coll Cardiol 2005; 46(5): 821-6 9 Erdmann E et al.: Eur J Heart Fail 2001; 3(4): 469-79
10 Kristensen SL et al.: Circ Heart Fail 2016; 9(1): e002560 11 Lawson CA et al.: JACC Heart Fail 2018; 6(1): 18-26
12 Seferović PM et al.: Eur J Heart Fail 2020; 22(2): 196-213 13 Dunlay SM et al.: Circulation 2019; 140(7): e294-324 14 Cosentino F et al.: Eur Heart J 2020; 41(2): 255-323
15 Khurana R et al.: Postgrad Med J 2010; 86(1016): 371-3 16 Roumie CL et al.: J Am Heart Assoc 2017; 6(4): e005379 17 Eurich DT et al.: Circ Heart Fail 2013; 6(3): 395-402
18 McAlister FA et al.: Eur J Heart Fail 2008; 10(7): 703-8 19 Fadini GP et al.: Eur Heart J 2015; 36(36): 2454-62
20 Ou SM et al.: Ann Intern Med 2015; 163(9): 663-72
21 Masoudi FA et al.: Circulation 2005; 111(5): 583-90 22 Eurich DT et al.: Diabetes Care 2005; 28(10): 2345-51 23 Evans JM et al.: Am J Cardiol 2010; 106(7): 1006-10
24 Eriksson JW et al.: Diabetes Res Clin Pract 2016; 117: 39-47 25 UK Prospective Diabetes Study (UKPDS) Group: Lancet 1998; 352(9131): 837-53 26 Patel A et al.: N Engl J Med 2008; 358(24): 2560-72 27 Dormandy JA et al.: Lancet 2005; 366(9493): 1279-89 28 Komajda M et al.: Eur Heart J 2010; 31(7): 824-31 29 Erdmann E et al.: Diabetes Care 2007; 30(11): 2773-8 30 Dargie HJ et al.: J Am Coll Cardiol 2007; 49(16): 1696-704 31 Scirica BM et al.: Circulation 2014; 130(18): 1579-88 32 Zannad F et al.: Lancet 2015; 385(9982): 2067-76 33 Green JB et al.: N Engl J Med 2015; 373(3): 232-42 34 Zheng SL et al.: JAMA 2018; 319(15): 1580-91 35 McGuire DK et al.: Circulation 2019; 139(3): 351-61 36 McMurray JJV et al.: JACC Heart Fail 2018; 6(1): 8-17 37 Zinman B et al.: Diabetes Ther 2018; 9(6): 2383-92 38 Marso SP et al.: New Engl J Med 2016; 375(19): 1834-44 39 Holman RR et al.: New Engl J Med 2017; 377(13): 1228-39 40 Gerstein HC et al.: Lancet 2019; 394(10193): 121-30 41 Hernandez AF et al.: Lancet 2018; 392(10157): 1519-29 42 Margulies KB et al.: JAMA 2016; 316(5): 500-8 43 Jorsal A et al.: Eur J Heart Fail 2017; 19(1): 69-7744 Zinman B et al.: New Engl J Med 2015; 373(22): 2117-28 45 Mahaffey KW et al.: Circulation 2018; 137(4): 323-34 46 Wiviott SD et al.: New Engl J Med 2019; 380(4): 347-57 47 McMurray JJV et al.: New Engl J Med 2019; 381(21): 1995-2008 48 Verma S et al.: Circulation 2019; 140(21): 1693-702 49 Butler J et al.: Eur J Heart Fail 2020; 22(4): 604-17