Ablation bei lange persistierendem VHF
Autor:innen:
OA Dr. Alexandra Schratter
OA Dr. Reinhard Achleitner
Abteilung für Kardiologie, Klinik Floridsdorf, Wien
Moderne Technologien wie die Verwendung von 3D-Mapping-Systemen und „Contact force“-Kathetern haben die Effizienz und Sicherheit der Ablationstherapie maßgeblich gesteigert, sodass nunmehr sehr gute Langzeiterfolge bei geringem prozeduralem Risiko durch das Ablationsverfahren verzeichnet werden können.
Keypoints
-
Bei symptomatischen Patient:innen ist die Katheterablation bei lange persistierendem VHF nach frustraner antiarrhythmischer Medikation Therapie der Wahl.
-
Die Ablationstherapie ist bei Tachykardie-induzierter Kardiomyopathie einer medikamentösen Therapie vorzuziehen.
-
Um eine Schrittmachertherapie bei persistierendem VHF (mit bradykarder Überleitung, symptomatischen präautomatischen Pausen) zu vermeiden, an Ablation denken.
-
Die zirkumferenzielle Pulmonalvenenisolation ist Standardverfahren bei lange persistierendem Vorhofflimmern.
-
Die chirurgische Ablation ist bei Patient:innen mit lange persistierendem VHF, frustraner Medikation und erfolglosen endovaskulären Ablationsverfahren Therapieoption.
Vorhofflimmern stellt mit seiner zunehmenden Inzidenz und Prävalenz in der industrialisierten Welt und den erheblichen gesundheitlichen Folgen eine massive Belastung für die Betroffenen und folglich auch für die Gesundheitssysteme dar.1 Das Auftreten von gravierenden physischen und psychischen Folgeschäden dieser Rhythmusstörung (Tod, zerebraler Insult, Herzinsuffizienz, Angstzustände, verminderte Lebensqualität) ist bis zu 40% im Vergleich zur Gesamtbevölkerung erhöht.1
Ein gut etabliertes Verfahren bei Vorhofflimmern bietet die Katheterablation, die in den Leitlinien fest verankert ist.1
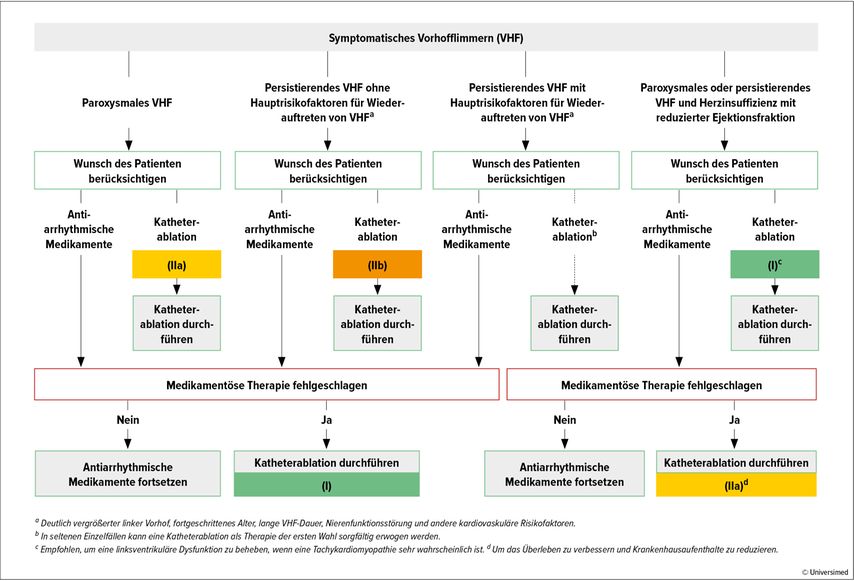
Die Katheterablation ist laut aktuellen Leitlinien der European Society of Cardiology (ESC) sowohl bei Patient:innen mit paroxysmalem, mit nur anfallsartig auftretendem Vorhofflimmern als auch bei Patient:innen mit persistierendem Vorhofflimmern indiziert, sofern die Betroffenen symptomatisch sind und/oder eine reduzierte systolische Linksventrikelfunktion im Sinne einer Tachykardie-induzierten Kardiomyopathie (Tachy-CMP) aufweisen.1
Bei paroxysmalem Vorhofflimmern (auf Wunsch des Betroffenen) bzw. bei vorliegender Tachy-CMP ist die Katheterablation als Erstlinientherapie indiziert (Klasse-IIa- bzw. Klasse-I-Empfehlung).
Bei persistierendem Vorhofflimmern ohne Tachy-CMP sollte die Ablationstherapie nach frustranem medikamentösem Therapieversuch als Zweitlinientherapie erfolgen (Klasse-I-Empfehlung; Abb. 1). Dies ist unabhängig davon, ob die Betroffenen hochgradige Risikofaktoren für das Auftreten von Vorhofflimmerrezidiven (kardiovaskuläre Risikofaktoren, eingeschränkte Nierenfunktion, deutlich vergrößerte Vorhöfe, fortgeschrittenes Alter, lange persistierendes Vorhofflimmern) aufweisen.1
Abb. 1: Indikationen zur Katheterablation bei symptomatischem Vorhofflimmern (nach Hindricks G et al. 2020)1
Warum Ablation bei lange persistierendem VHF?
Persistierendes und insbesondere lange persistierendes Vorhofflimmern (Dauer über ein Jahr) führt oftmals zu einem strukturellen atrialen „remodeling“ im Sinne von zunehmender Fibrosierung des Vorhofs. Dies begünstigt Vorhofflimmer-trigger abseits der Lungenvenen. Narbenareale ermöglichen aufgrund der elektrischen Diskontinuität sowohl die Entstehung als auch die Aufrechterhaltung von Vorhofflimmern.2 Deswegen kommt es nach einer Ablation bei persistierendem Vorhofflimmern zu einer erhöhten Rezidivrate im Zeitraum von 12 Monaten nach einer Ablation (ca. bei 50% in älteren Studien und ca. bei 33% in einer rezenten Metaanalyse) verglichen mit Ablationen bei paroxysmalem Vorhofflimmern.3 Dennoch konnte in einer randomisierten, multizentrischen Studie von 2014 die Überlegenheit der Ablationstherapie hinsichtlich Erhaltung des Sinusrhythmus gegenüber medikamentöser antiarrhythmischer Therapie bei persistierendem Vorhofflimmern eindeutig belegt werden.4 Allerdings wurden in dieser Studie Teilnehmer:innen mit lange persistierendem Vorhofflimmern systematisch ausgeschlossen.
Eine andere groß angelegte randomisierte Studie von 2019 mit über 2200 Patient:innen konnte keinen Vorteil hinsichtlich des kombinierten Endpunkts Tod, schwerer zerebraler Insult, schwere Blutungskomplikation oder Herzstillstand der Katheterablation vs. medikamentöse (antiarrhythmische und/oder frequenzkontrollierende) Therapie festmachen. Allerdings zeigte sich ein signifikanter Benefit hinsichtlich Lebensqualität im Ablationskollektiv.5,6
Adjuvante Therapie bei Herzinsuffizienz
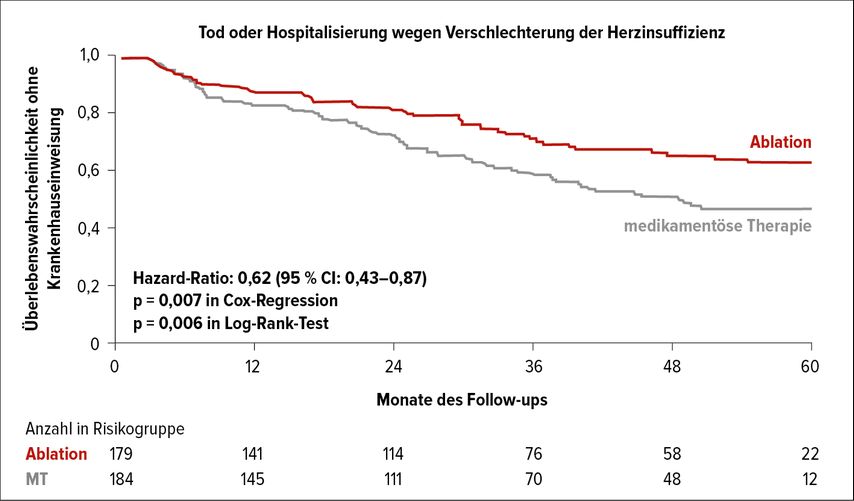
In der bahnbrechenden CASTLE-AF-Studie wurden 363 Herzinsuffizienzpatient:innen mit reduzierter systolischer Linksventrikelfunktion (EF<35%) und vorangegangener (bzw. Unverträglichkeit/Inakzeptanz) medikamentöser antiarrhythmischer Therapie in zwei Interventionsgruppen (Katheterablation vs. medikamentöse Therapie) randomisiert.7 In beiden Gruppen wiesen 65–70% der Patient:innen persistierendes Vorhofflimmern und immerhin knapp 30% lange persistierendes Vorhofflimmern auf. Der kombinierte Endpunkt aus Tod und zunehmender Herzinsuffizienz mit notwendiger Hospitalisierung wurde in der Ablationsgruppe hochsignifikant seltener erreicht (Abb. 2). Zudem besserten sich die systolische Linksventrikelfunktion sowie der 6-Minuten-Gehtest signifikant in der Ablationsgruppe.
Abb. 2: CASTLE-AF-Studie: Katheterablation bei Vorhofflimmern mit Herzinsuffizienz (nach Marrouche N et al. 2018)7
Trotz einer Vorhofflimmerrezidivrate von 50% in der Ablationsgruppe im 60-Monats-Follow-up bestehen hochsignifikante Vorteile der Ablationstherapie (vs. medikamentöse Therapie). Zum einen konnte in der Ablationsgruppe die Gesamtlast an Vorhofflimmern („atrial fibrillation burden“) trotz auftretender Rezidive signifikant reduziert werden. Patient:innen hatten demnach nach Ablation deutlich seltener Vorhofflimmern als vor Ablation, was sich vorteilhaft auf das Auftreten von Herzinsuffizienz, Schlaganfallrisiko und Hospitalisierungen auswirkte.
Durch die Katheterablation werden nicht nur die Lungenvenentrigger ausgeschaltet, es wird je nach Vorhandensein auch atriales Substrat abgetragen. Zudem erfolgt eine Modulation des autonomen Nervensystems (Neurokardiomodulation) durch Ablation von Gangliengeflechten (GP: „ganglionated plexi“), die sich unter anderem im Bereich des Antrums der Lungenvenen befinden. Diese Neurokardiomodulation hat in zahlreichen Studien einen signifikanten Effekt auf die Rezidivfreiheit nach Vorhofflimmerablation gezeigt.8–10
Die kürzlich veröffentlichte CASTLE-HTx-Studie mit 194 Proband:innen konnte den herausragenden Effekt der Katheterablation auf die Reduktion der Gesamtmortalität, auf die Implantation von linksventrikulären „assist devices“ (LVAD) und auf dringliche Herztransplantation bei Herzinsuffizienz im Endstadium belegen verglichen mit medikamentösen Therapiestrategien.11 Auch hier kam es zu einer hochsignifikanten Reduktion der Vorhofflimmerlast in der Ablationsgruppe im Vergleich zur Gruppe mit medikamentöser Therapie (–31% vs. –8,5% in der 12-Monats-Kontrolle). Der Anteil an persistierendem und lange persistierendem Vorhofflimmern lag in beiden Gruppen bei rund 70%.
Vermeidung einer Schrittmachertherapie
Bei Patient:innen mit bradykard übergeleitetem Vorhofflimmern oder Bradykardie-Tachykardie-Syndrom (bradykarder Sinusrhythmus mit intermittierenden Phasen von tachykardem Vorhofflimmern) bzw. symptomatischen präautomatischen Pausen bei Übergang zwischen Vorhofflimmern und Sinusrhythmus soll zur Vermeidung einer Herzschrittmacherimplantation evaluiert werden, ob eine Ablationstherapie indiziert ist (Klasse-IIa-Empfehlung).1
Ablationsstrategien
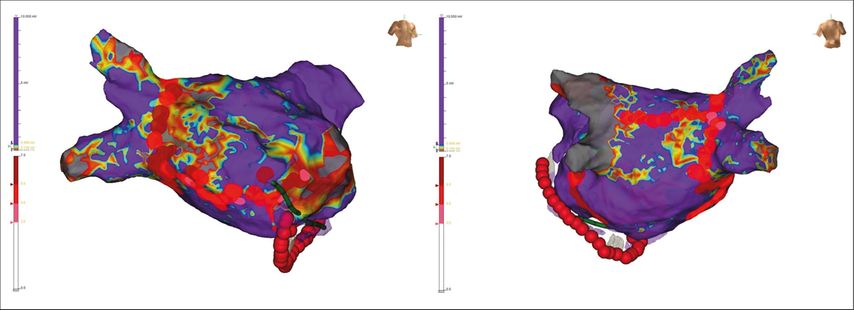
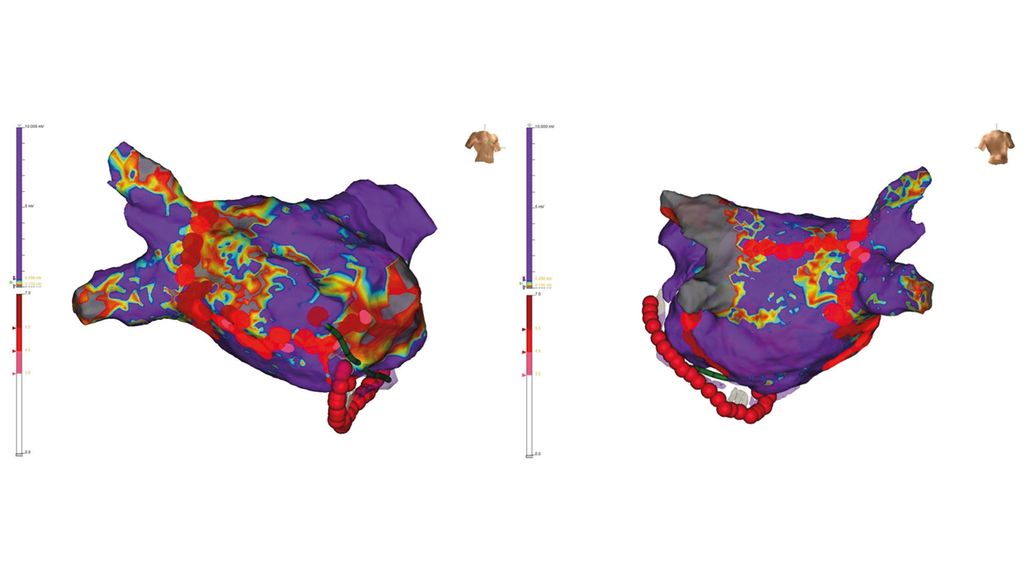
Die zirkumferenzielle Pulmonalvenenisolation stellt bei der erstmaligen Ablation sowohl bei paroxysmalem als auch bei persistierendem Vorhofflimmern das Standardvorgehen dar. Diese kannunter anderem mittels Punkt-für-Punkt-Radiofrequenzablation oder Ablation mittels Kryoballon erfolgen; beide Verfahren sind laut aktuellem Wissensstand die am besten untersuchten Methoden. Für die zusätzliche Durchführung von lineären Läsionen im linken Vorhof bzw. Ablation von komplexen fraktionierten atrialen Potentialen/Rotoren/ektopen foci usw. im Rahmen der Erstprozedur bei persistierendem Vorhofflimmern gibt es keine Evidenz hinsichtlich Verbesserung des prozeduralen Langzeitoutcomes (d.h. Reduktion der Rezidivrate).12 Ebensowenig besteht Evidenz für die zusätzlich zur Pulmonalvenenisolation durchgeführte Isolation der linksatrialen Hinterwand.13 Dementsprechend sollte von diesen zusätzlichen Ablationsstrategien im Rahmen der Erstintervention bei Vorhofflimmern Abstand genommen werden, sofern nicht organisierte atriale Tachykardien im Vorfeld dokumentiert sind (Klasse-IIb-Empfehlung).1 Bei Folgeeingriffen sollten die Lungenvenenläsionen überprüft und gegebenenfalls deren Ablation vervollständigt werden. Je nach intraprozeduralem Befund kann dann eine zusätzliche Substratmodifikation erfolgen (Abb. 3).
Abb. 3: 3D-Spannungskarte („voltage map“) des linken Vorhofs von vorne (links) und hinten (rechts). Nach vorangegangener zirkumferenzieller Pulmonalvenenisolation zeigen sich die linken Lungenvenen anhaltend isoliert (grau: im rechten Bild), die rechten Lungenvenen zeigen sich rekonnektiert (violett: vitales Vorhofmyokard, rot/gelb: „Low voltage“-Areale, grau: Narbengewebe). Es erfolgten die neuerliche zirkumferenzielle Isolation der rechten Lungenvenen sowie eine Substratmodifikation mittels septaler Linie und hinterer Dachlinie sowie eine endo- und epikardiale Koronarsinusablation (rote Punkte: Ablationsläsionen)
Stellenwert chirurgischer Ablation
Die chirurgische Ablation von Vorhofflimmern kommt als konkomitantes Verfahren im Rahmen von Herzoperationen (aortokoronare Bypass-Operationen, Herzklappenoperationen) bereits seit Langem zum Einsatz (Klasse-IIa-Empfehlung).1 Die primäre chirurgische Ablation bei Vorhofflimmern mittels thorakoskopischen oder Hybridverfahrens (minimalinvasive chirurgische Ablation in Kombination mit Katheterablation) stellt insbesondere bei Patient:innen mit persistierendem und lange persistierendem Vorhofflimmern nach frustraner medikamentöser antiarrhythmischer Therapie sowie vorangegangenen frustranen endovaskulären Ablationsverfahren eine Therapiealternative dar. Eine rezente Metaanalyse hat Studien mit primärem Hybridverfahren und solche mit Katheterablation bei Patient:innen mit persistierendem oder lange persistierendem Vorhofflimmern verglichen.14 Das Ergebnis war ein deutlich höherer Anteil an persistierendem Sinusrhythmus nach Intervention in der Hybridgruppe bei etwas erhöhtem prozeduralem Komplikationsrisiko. Groß angelegte randomisierte Studien, die beide Verfahren bei Proband:innen mit persistierendem und lange persistierendem Vorhofflimmern direkt vergleichen, fehlen allerdings noch, ebenso wie ein Empfehlungsalgorithmus zur Art des angewandten chirurgischen Verfahrens. Eine randomisierte Studie von 2018 mit 52 Patient:innen, die eine primär chirurgische Ablation mit der Katheterablation bei paroxysmalem oder kurz persistierendem Vorhofflimmern verglich, konnte keinen Vorteil hinsichtlich Rezidivfreiheit bei deutlich erhöhter Komplikationsrate in der chirurgischen Gruppe zeigen.15 Bei Patient:innen mit persistierendem oder paroxysmalem Vorhofflimmern, frustraner medikamentöser antiarrhythmischer Therapie sowie erfolgloser vorangegangener Katheterablation bzw. nicht möglicher endovaskulärer Ablation haben thorakoskopische und Hybridverfahren laut aktuellen ESC-Leitlinien eine Klasse-IIa-Empfehlung.1
Zusammenfassung
Die Katheterablation von Vorhofflimmern bald nach Diagnosestellung, aber jedenfalls vor der Chronifizierung der Rhythmusstörung (bevor paroxysmales in persistierendes Vorhofflimmern übergeht bzw. zeitnah nach dem Übergang) kann den atrialen Umbauprozess und somit das Fortschreiten der Erkrankung verhindern und das klinische Outcome verbessern.
Nichtsdestotrotz kann die Ablationstherapie auch bei Patient:innen mit lange persistierendem Vorhofflimmern (Dauer über 1 Jahr) zur deutlichen Reduktion der Vorhofflimmerlast führen. Sie verhindert das Auftreten von Herzinsuffizienz, Hospitalisierung, Schlaganfall oder anderen thrombembolischen Ereignissen, das Auftreten von gravierenden psychischen Folgen und verbessert somit deutlich die Lebensqualität. Auch bei bereits bestehender Herzinsuffizienz führt die Katheter-ablation zu einer Besserung der klinischen Situation und zu einem deutlichen Überlebensvorteil. Zusätzlich kommt es durch die Reduktion der Hospitalisierungen zu einer beträchtlichen Entlastung der Gesundheitssysteme.
Literatur:
1 Hindricks G et al.: 2020 ESC guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC). European Heart Journal 2020; 42(5): 373-498 2 Nattel S et al.: Atrial remodeling and atrial fibrillation: mechanisms and implications. Circ Arrhythm Electrophysiol 2008; 1(1): 62-73 3 Voskoboinik A et al.: Revisiting pulmonary vein isolation alone for persistent atrial fibrillation: A systematic review and meta-analysis. Heart Rhythm 2017; 14(5): 661-7 4 Mont L et al.: Catheter ablation vs. antiarrhythmic drug treatment of persistent atrial fibrillation: a multicentre, randomized, controlled trial (SARA study). Eur Heart J 2014; 35(8): 501-7 5 Packer D et al.: Effect of catheter ablation vs antiarrhythmic drug therapy on mortality, stroke, bleeding and cardiac arrest among patients with atrial fibrillation (CABANA trial). JAMA 2019; 321(13): 1261-74 6 Mark D et al.: Effect of catheter ablation vs medical therapy on quality of life among patients with atrial fibrillation (CABANA trial). JAMA 2019; 321(13): 1275-85 7 Marrouche N et al.: Catheter ablation for atrial fibrillation with heart failure (CASTLE AF trial). N Engl J Med 2018; 378(5): 417-27 8 Pappone C et al.: Pulmonary vein denervation enhances long-term benefit after cirumferential ablation for paroxysmal atrial fibrillation. Circulation 2004; 109(3): 327-34 9 Zhang Y et al.: Efficacy of cardiac autonomic denervation for atrial fibrillation: a meta-analysis. J Cardiovasc Electrophysiol 2012; 23(6): 592-600 10 Yorgun H et al.: Additional benefit of cryoballoon-based atrial fibrillation ablation beyond pulmonary vein isolation: modification of ganglionated plexi. Europace 2014; 16(5): 645-51 11 Sohns C et al.: Catheter ablation in end-stage heart failure with atrial fibrillation (CASTLE HTx trial). N Engl J Med 2023; 389(15): 1380-9 12 Verma A et al.: Approaches to catheter ablation for persistent atrial fibrillation (STAR AF II trial). N Engl J Med 2015; 372(19): 1812-22 13 Kistler P et al.: Effect of catheter ablation using pulmonary vein isolation with vs without posterior left atrial wall isolation on atrial arrhythmia recurrence in patients with persistent atrial fibrillation (CAPLA trial). JAMA 2023; 329(2): 127-35 14 Van der Heijden C et al.: Hybrid versus catheter ablation in patients with persistent and longstanding persistent atrial fibrillation: a systematic review and meta-analysis. Eur J Cardiothorac Surg 2019; 56(3): 433-43 15 Adiyaman A et al.: Randomized controlled trial of surgical versus catheter ablation for paroxysmal and early persistent atrial fibrillation. Circ Arrhythm Electrophysiol 2018; 11(10): e006182
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Antibiotika bei Endokarditis: ambulante Fortsetzung der stationären Therapie
Nach einer erfolgreichen initialen stationären, parenteralen Antibiotikatherapie besteht bei vielen Patient:innen mit bakterieller Endokarditis die Option einer ambulanten ...