Osteoporose und Endoprothetik
Autoren:
Dr. Sebastian Simon1,2
Priv.-Doz. Dr. Jochen G. Hofstätter1,3
1 Michael-Ogon-Labor für orthopädische Forschung, Orthopädisches Spital Speising, Wien
2AUVA Trauma Center Meidling, Wien
3 Orthopädisches Spital Speising, Abteilung II, Wien
Korrespondierender Autor:
Priv.-Doz. Dr. Jochen G. Hofstätter
E-Mail: researchlab@oss.at
Osteoporose ist assoziiert mit einer erhöhten Rate an intra- und postoperativen periprothetischen Frakturen (PPF). Was gilt es zu beachten?
Keypoints
-
Osteoporosepatient:innen haben ein deutlich erhöhtes Revisionsrisiko für Frakturen, Lockerungen und Infektionen.
-
Präoperative Osteoporoseabklärung und Therapiebeginn könnten Revisionen vermeiden.
-
Frakturrate: zementierte Schäfte < Kragenschäfte < zementfreie, kragenlose Schäfte
-
Das Risikoprofil für Frakturen ist multifaktoriell und nicht nur altersabhängig. Risikofaktoren sind u.a. weibliches Geschlecht, schlechte Knochenqualität, Dorr-C-Femur, hohe Sturzneigung.
Warum hat Osteoporose Einfluss auf die Endoprothetik?
Osteoporose ist assoziiert mit einer erhöhten Rate an intra- und postoperativen periprothetischen Frakturen (PPF), früher und später postoperativer aseptischer Prothesenlockerung, primärer Fehlpositionierung von Implantatkomponenten und somit einem gesamthaft signifikant erhöhten Revisionsrisiko in der Hüftendoprothetik.1 Auch in der Knieendoprothetik ist das Revisionsrisiko bei Patienten mit Osteoporose aufgrund von periprothetischen Frakturen doppelt so hoch wie bei Patienten ohne Osteoporose.2 Aseptische Prothesenlockerung und periprothetische Infektionen scheinen bei Patienten mit Osteoporose in der Knieendoprothetik ebenfalls höher zu sein.3
Es ist nicht vollständig geklärt, ob die altersbedingte Abnahme der Knochenqualität die alleinige Ursache für die erhöhte Revisionsrate ist. Es ist offensichtlich, dass ältere Menschen aufgrund ihrer Datenlage ein höheres Risiko für Frakturen und damit verbundene Revisionen haben. Die allgemeine Datenlage zeigt eindeutig, dass ab einem Alter von >75 Jahren das Risiko für aseptische Schaftlockerungen und periprothetische Frakturen bei Verwendung zementfreier Schäfte im Vergleich zu zementierten Schäften signifikant erhöht ist.4–10
Optimierung der endoprothetischen Versorgung
Es ist wichtig, bei der Entscheidung zur Therapie nicht allein das Alter des Patienten zu berücksichtigen, da auch andere Faktoren eine Rolle spielen. Viele dieser Faktoren werden jedoch nicht in den Registerdaten erfasst. Das Geschlecht, die Sturzneigung, die Femurgeometrie und die Aktivität jedes einzelnen Patienten, die verfügbaren Implantate und die Index-Diagnose sollten bei der Entscheidung über die endoprothetische Versorgung berücksichtigt werden, um ein gesamtes Risikoprofil für Komplikationen zu erstellen. So gilt es folgende Punkte zu berücksichtigen:
Abb. 1: Ein weibliches Dorr-C-Femur mit einer sehr dünnen Kortikalis und einem breiten Markraum. Bei einer solchen Femurkonfiguration zeigte eine zementierte Femurkomponente ein geringeres Risiko einer aseptischen Lockerung oder Fraktur im Vergleich zu einer zementfreien Variante. Das abgebildete Femur zeigt einen niedrigen Cortical Index, einen niedrigen Canal Flare Index, eine höhere Canal Calcar Ratio und eine höhere Canal Bone Ratio. Diese Werte sind alle mit osteoporotischen Veränderungen im Bereich des Femurs assoziiert
-
Postmenopausale Frauen haben im Vergleich zu Männern ein erhöhtes Risiko für PPF.11
-
Bei jüngeren und aktiveren Patienten ist die Wahrscheinlichkeit höher, dass sie ein hochenergetisches Trauma erleiden. Bei älteren Patienten ist hingegen die Wahrscheinlichkeit höher, dass sie eine schlechtere Knochenqualität aufweisen.12
-
Für eine gute primäre Stabilität sollte die Femurgeometrie evaluiert werden: Cortical Index, Canal Flare Index, Canal Calcar Ratio, Canal Bone Ratio.13
-
Verschiedene Implantate zeigen unterschiedliche Frakturrisiken aufgrund der unterschiedlichen Schaftdesigns.14
Auch die Ursache der Arthrose, die zur endoprothetischen Versorgung führt, spielt eine Rolle im Risikoprofil. So haben Rheumatiker:innen, aber auch Patient:innen, die eine vorangegangene Fraktur hatten, ein erhöhtes Risiko für PPF.3,15 Die Kombination aus weiblichem Geschlecht, einem Dorr-C-Femur und schlechter Knochenqualität sowie einem geriatrischen Patienten mit Sturz- und Stolperneigung hat das höchste Risiko einer PPF (Abb. 1).
Operationstechniken
Hüftendoprothetik Schaft
-
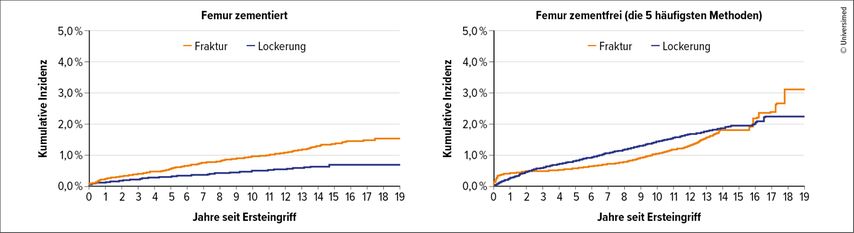
Zementierte Schäfte zeigen eine niedrigere Schaftlockerungsrate und PPF-Rate gegenüber zementfreien Schäften (Abb. 2).1
-
Unterschiede zwischen zementierten Schäften: „Composite beam“-zementierte Schäfte zeigen eine niedrigere PPF-Rate als „polished tapered slip“-zementierte Schäfte.16,17
-
Unterschiede zwischen zementfreien Schäften: „Flat taper“-Schäfte zeigen eine niedrigere PPF-Rate als im Querschnitt quadratisch geformte Schäfte.18
-
Schäfte mit Kragen haben ein geringeres Risiko für Nachsinterung und PPF gegenüber kragenfreien Schäften.19
-
Calcar-geführte Kurzschäfte sind prinzipiell bei Patientinnen mit Osteoporose nicht geeignet, zeigen aber beim richtig gewählten >75-jährigen Patienten auch eine sichere Versorgungsoption, wobei die Dorr-Typen A und B kein erhöhtes Frakturrisiko aufweisen.20
-
Zementierte Schäfte haben die niedrigste PPF-Rate gefolgt von Schäften mit Kragen. Die höchste PPF-Rate weisen zementfreie, kragenfreie Schäfte auf.
Abb. 2: Daten aus dem Bericht des Australischen Endoprothesenregisters.28 Es zeigt sich die kumulative Inzidenz der Frakturrate und der Rate der aseptischen Lockerung nach einer primären HTEP bei zementfreier und zementierter Fixierung der Femurkomponente. In der zementfreien Kohorte zeigt sich eine erhöhte Revisionsrate aufgrund von Fraktur und aseptischer Lockerung, vor allem im ersten Monat postoperativ. 0–2 Wochen – HR: 5,89 (4,00; 8,68); p<0,001; 2 Wochen bis 1 Monat – HR: 3,41 (2,45; 4,73); p<0,001; 1 Monat+ – HR: 1,16 (1,06; 1,26); p=0,001
Hüftendoprothetik Pfanne
-
Prinzipiell zeigen zementfreie azetabuläre Komponenten gute Ergebnisse, aber auch hier sind die Osteoporose und das Geschlecht ein Risikofaktor für eine erhöhte Rate an periazetabulären Frakturen.21,22
-
Hemisphärische Pfannendesigns haben die niedrigste Rate an azetabulären Frakturen gefolgt von elliptischen Pfannen und „Periphere self-locking“-Pfannen.23
Knieendoprothetik
-
Im Bereich der Knieendoprothetik sollte bei bekannter Osteoporose zementiert werden.24
-
Bei einer schlechten Knochenqualität kann ein tibialer Stem für zusätzliche Stabilität sorgen.25
Eine Osteoporoseabklärung mittels DXA, TBS Score, FRAX Score, Knochenstoffwechselparametern (Vit. D, Ca, Prokollagen, Crosslaps) sollte bei Patientinnen mit Risikofaktoren (Alter, Nikotinabusus, Kortisontherapie, Mangelernährung, positive Familienanamnese etc.) durchgeführt werden. Dadurch kann zeitnah eine antiosteoporotische Therapie begonnen werden. Spezifische Antiresorptiva und Osteoanabolika können die Primärstabilität verbessern, Prothesenmigration verhindern und den periimplantären Knochensubstanzverlust abmildern.1 Derzeit erfüllen ca. 25% der H-TEP- und K-TEP-Patienten die Kriterien für eine medikamentöse Behandlung der Osteoporose, aber nur 5% erhalten prä- oder postoperativ eine Therapie.26 Auch die Präparation und Implantationstechniken müssen bei einer reduzierten Knochenqualität angepasst werden.
Über 60% der Operateure würden bei niedriger BMD („bone mineral density“) die Implantatwahl und das Implantatdesign überdenken. Jedoch führen nur 4% eine präoperative Diagnostik durch.27
Revisionsoperationen in der Hüft- und Knieendoprothetik sind kostenintensiv. Eine präoperative Abklärung der Osteoporose sowie die Optimierung der Knochenqualität können dazu beitragen, große Revisionseingriffe zu vermeiden. Diese erhöhen nicht nur die Morbidität des Patienten, sondern belasten auch das Gesundheitsbudget.
Zusammenfassend lässt sich sagen, dass das Risiko osteoporotischer Komplikationen bei der Endoprothetik multifaktoriell bedingt ist. Die Versorgung von Patienten mit Hüft- oder Knietotalendoprothesen sollte immer auf einer individuellen Entscheidung basieren, beginnend mit der Diagnose und präoperativen Abklärung bis hin zur Implantatwahl. Dabei spielen patientenspezifische, operations- und implantatspezifische Faktoren eine Rolle, die erkannt und berücksichtigt werden müssen.
Literatur:
1 Niemeier A: AE-Manual der Endoprothetik 2023 2 Harris AB et al.: J Arthroplasty 2024; 39: 948-53.e1 3 Albright JA et al.: J Arthroplasty 2023; 38: 266-73 4 Bloemheuvel EM et al.: Acta Orthop 2022; 93: 151-7 5 Tanzer M et al.: Clin Orthop Relat Res 2018; 476: 1428-37 6 Edelstein AI et al.: J Bone Joint Surg Am 2022; 104: 523-9 7 Bunyoz KI et al.: Clin Orthop Relat Res 2020; 478: 697-704 8 Dale H et al.: Acta Orthop 2020; 91: 33-41 9 Ogino D et al.: J Bone Joint Surg Am 2008; 90: 1884-90 10 Peitgen DS et al.: J Arthroplasty 2019; 34: 77-81 11 Xiao P-L et al.: Arch Osteoporos 2022; 17: 16 12 Cao L, Baochao J: Risk factors in treatment of periprosthetic fractures. AO Recon 2024 13 D’Ambrosio A et al.: Bone Joint Res 2020; 9: 182-91 14 Radaelli M et al.: J Arthroplasty 2023; 38: 502-10 15 Franklin J, Malchau H: Injury 2007; 38: 655-60 16 Mabrouk A et al.: J Arthroplasty 2024;39: 269-75 17 Rames RD et al.: J Arthroplasty 2022; 37: S598-603 18 Jeong S-J et al.: J Arthroplasty 2023; 38: 2379-85 19 Giovanoulis V et al.: SICOT-J 2024; 10: 8 20 Gkagkalis G et al.: BMC Geriatr 2019; 19: 112 21 Beckers G et al.: Medicina (B Aires) 2022; 58: 630 22 Haasper C et al.: Unfallchirurg 2019; 122: 762-5 23 Hasegawa K et al.: Clin Orthop Relat Res 2017; 475: 484-94 24 Spinarelli A et al.: Aging Clin Exp Res 2011; 23: 78-80 25 Filip AC et al.: Medicina (B Aires) 2022; 58: 634 26 Bernatz JT et al.: J Arthroplasty 2019; 34: 1347-53 27 Maier GS et al.: Adv Orthop 2016; 2016: 1-5 28 Babazadeh S et al.: J Arthroplasty 2022; 37: 110-8
Das könnte Sie auch interessieren:
Systems oncology is the future
Dr. Juliane Winkler is head of the Lab for Tumor Heterogeneity and Metastasis at the Medical University of Vienna. She is a licensed pharmacist and did her PhD at the University of ...
Kleine Chirurgie mit großer Wirkung beim diabetischen Fußsyndrom
Die weitgehend uneingeschränkte Mobilität der an einem diabetischen Fußsyndrom erkrankten Menschen sollte bei der Therapie im Vordergrund stehen. Bei mittleren Wundschlusszeiten von etwa ...
04. Juli 2024, 17:00 – 18:00 Uhr
ZUR ANMELDUNG