Chronische Autoimmunthyreoiditis und Morbus Basedow
Autorin:
Dr. med. Lilian Sewing
FMH Allgemeine Innere Medizin
FMH Endokrinologie/Diabetologie
Medizinische Poliklinik
Universitätsspital Basel
E-Mail: lilian.sewing@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Autoimmune Schilddrüsenerkrankungen (AITD) gehören mit einer Prävalenz von 2–5%1 zu den häufigsten organspezifischen Autoimmunerkrankungen. Die beiden Hauptvertreter sind die chronische Autoimmunthyreoiditis und der Morbus Basedow, die bei uns häufigsten Ursachen für eine Hypo- bzw. Hyperthyreose.2 Beiden gemeinsam ist ein Verlust der Immuntoleranz mit Bildung von Autoantikörpern gegen schilddrüsenspezifische Antigene und einer lymphozytären Infiltration des Schilddrüsenparenchyms.3 Im folgenden Artikel werden Grundlagen der Pathogenese sowie Diagnostik und Management der beiden wichtigsten autoimmunen Schilddrüsenerkrankungen behandelt.
Pathogenese von autoimmunen Schilddrüsenerkrankungen
Die zugrunde liegenden Mechanismen für die Entwicklung einer AITD sind bisher noch nicht vollständig bekannt. Epidemiologische Daten legen nahe, dass eine Kombination aus genetischer Prädisposition und Umweltfaktoren zum Verlust der Immuntoleranz führt: So finden sich familiäre Cluster mit gehäuftem Auftreten von AITD, bei denen genetische Varianten in immunregulatorischen Genen sowie schilddrüsenspezifischen Genen nachgewiesen wurden.4
Bei den Umweltfaktoren spielen Nikotinkonsum, Stress sowie die Höhe der Iodaufnahme eine zentrale Rolle. So ist eine exzessive Iodaufnahme mit einer höheren Prävalenz von Autoimmunthyreoiditis assoziiert. Raucher haben einerseits ein erhöhtes Risiko für einen Morbus Basedow und eine endokrine Orbitopathie (EOP), andererseits senkt Nikotinkonsum das Risiko für eine Hypothyreose. Ein weiterer Risikofaktor ist die Exposition gegenüber ionisierender Strahlung.5 Zudem scheinen Viren wie das Parvovirus B12 oder das Hepatitis-C-Virus möglicherweise über eine molekulare Mimikry bei der Pathogenese der AITD eine Rolle zu spielen. Ein Selenmangel mit eingeschränkter Funktion von schilddrüsenspezifischen Selenoproteinen wird ebenfalls als möglicher Risikofaktor diskutiert.6 Auch Medikamente wie Amiodaron oder Interferonalpha gelten als mögliche Auslöser einer AITD.7
AITD sind mit einer Vielzahl von anderen autoimmunen Erkrankungen wie u.a. rheumatoider Arthritis, Typ-1-Diabetes, Sarkoidose, Vitiligo oder Zöliakie assoziiert. Wenn bei Patient:innen mit AITD neue oder unspezifische Symptome auftreten, wird daher ein Screening auf weitere Autoimmunerkrankungen empfohlen.8
Chronische Autoimmunthyreoiditis
Verlaufsformen
Die chronische Autoimmunthyreoiditis ist die häufigste Ursache einer Hypothyreose in Gegenden mit ausreichender Iodversorgung. Es sind insbesondere Frauen um das 4. Lebensjahrzehnt betroffen, die Prävalenz liegt bei 1:1000. Charakteristisch sind das Vorliegen von Antikörpern gegen Thyreoperoxidase (TPO) sowie das typische sonografische Bild eines diffus echoarmen, heterogenen Schilddrüsenparenchyms. Die chronische Autoimmunthyreoiditis mit normaler Schilddrüsenfunktion wird von der Form mit manifester Hypothyreose unterschieden– nur Letztere ist als Hashimoto-Thyreoiditis (HT) definiert.
Typisch für die chronische Autoimmunthyreoiditis/HT ist ein graduell fortschreitender Verlust der Schilddrüsenfunktion mit lymphozytärer Infiltration des Parenchyms und autoimmunvermittelter Destruktion der Schilddrüsenfollikel.
Meist kommt es zu einem schleichenden Beginn mit unspezifischen Symptomen wie Kälteempfindlichkeit, Müdigkeit oder Obstipation. Klinisch werden zwei Verlaufsformen unterschieden: Bei einem Teil der Patient:innen kommt es zur Atrophie des Schilddrüsengewebes, bei anderen bildet sich eine Struma aus. Der zunehmende Verlust der Schilddrüsenfunktion bedingt eine vermehrte Ablagerung von Glykosaminoglykanen im Gewebe sowie eine Abnahme des Energieumsatzes, wodurch die mannigfaltigen klinischen Symptome der Hypothyreose zu erklären sind.
Bei den Patient:innen kommt häufig die Frage auf, ob und inwiefern ihre Schilddrüsenerkrankung das Risiko für Schilddrüsenkarzinome beeinflusst.
Die chronische Autoimmunthyreoiditis ist mit einem erhöhtem Risiko für differenzierte Schilddrüsenkarzinome (DTC) assoziiert,9 jedoch wird die klinische Implikation dieser Assoziation kontrovers diskutiert. So gibt es Hinweise, dass eine AITD mit euthyreoter Stoffwechsellage oder subklinischer Hypothyreose mit einem erhöhten Risiko für DTC einhergeht, eine manifeste Hypothyreose jedoch nicht mit einem erhöhten Risiko für DTC vergesellschaftet ist und sich hohe TPO-Antikörper sogar protektiv auszuwirken scheinen.10 Es besteht bei AITD ohne Struma keine Notwendigkeit für ein regelmässiges sonografisches Screening auf DTC.
Diagnostik
Bei klinischem Verdacht auf eine chronische Autoimmunthyreoiditis empfiehlt sich ein Screening mittels TSH-Wert-Bestimmung. Bei auffälligem TSH sollte das freie Thyroxin (fT4) bestimmt werden, um eine subklinische Hypothyreose (TSH↑, fT4 normal) von einer manifesten Hypothyreose (TSH↑, fT4↓) zu differenzieren. Von einer Messung der TPO-Antikörper als Screening-Untersuchung ist abzusehen, da auch bis zu 10% der Euthyreoten positive Antikörperwerte zeigen.11
Wenn mittels TSH und fT4 die Diagnose einer subklinischen oder manifesten Hypothyreose gestellt wurde, können die schilddrüsenspezifischen Antikörper bestimmt werden. TPO-AK liegen bei 90% der Patient:innen mit chronischer Autoimmunthyreoiditis vor, Thyreoglobulin-Antikörper (Tg-AK) werden bei 50–90% gefunden. Jedoch stellt sich die Frage nach der Konsequenz einer Antikörperbestimmung. Denn bei manifester Hypothyreose besteht eine klare Therapieindikation– unabhängig vom Antikörpertiter. Zeigt sich eine subklinische Hypothyreose, ist es essenziell, zu überprüfen, ob die TSH-Erhöhung persistierend ist. Die Blutwerte sollten daher nach 8 bis 12 Wochen erneut kontrolliert werden. Bei 30–50% der Patient:innen mit erhöhtem TSH zeigt sich eine Normalisierung der Werte nach erneuter Testung.11 Bei subklinischer Hypothyreose liegt das Risiko für die Entwicklung einer manifesten Hypothyreose bei circa 2% pro Jahr; wenn positive TPO-AK vorliegen, steigt das Risiko auf etwa 4% pro Jahr – in beiden Fällen sind Verlaufskontrollen indiziert. Das Wissen um das Vorliegen eines positiven Antikörpertiters ergibt keinen klaren Mehrwert, sodass die Indikation zur Antikörpermessung bei der Hypothyreose zurückhaltend zu stellen ist.
Therapie
Die Gabe von Levothyroxin (LT4), der synthetischen Form des T4, ist Therapie der Wahl bei der manifesten Hypothyreose. Die volle Substitutionsdosis liegt bei 1,6µg/kg/d. Bei älteren oder kardial vorerkrankten Patient:innen empfiehlt es sich, mit einer niedrigeren Dosis zu starten. Ziel der Therapie ist eine Normalisierung des TSH, das 6 Wochen nach Therapiestart sowie nach jeder Dosisänderung kontrolliert werden sollte. Danach empfehlen sich lebenslange Kontrollen alle 6 bis 12 Monate.
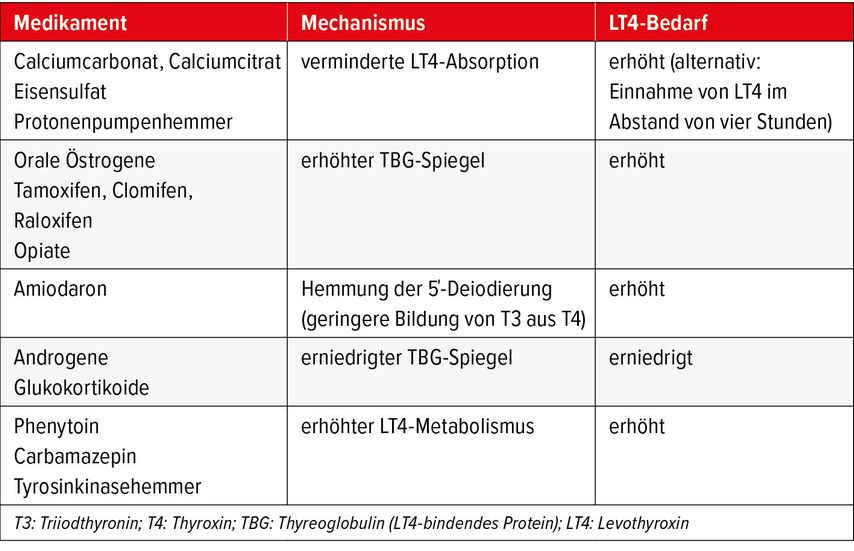
LT4 sollte regelmässig morgens 30 bis 60 Minuten vor dem Frühstück nüchtern eingenommen werden. Alternativ ist auch eine Einnahme vor der Bettruhe möglich.12 Viele Medikamente interferieren mit der LT4-Absorption, der Proteinbindung oder dem Metabolismus (Tab. 1), sodass gegebenenfalls Dosisanpassungen notwendig werden.
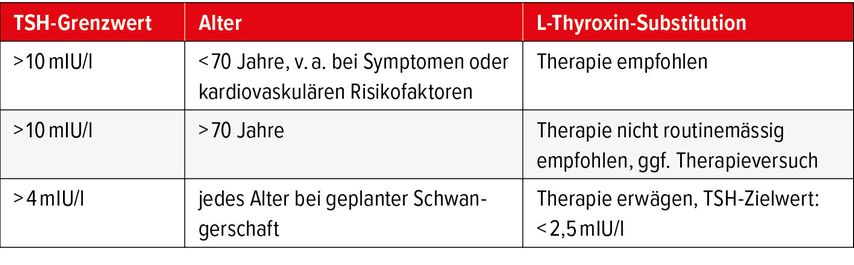
Die Therapie der subklinischen Hypothyreose wird kontrovers diskutiert. Eine Levothyroxin-Therapie bei milder subklinischer Hypothyreose zeigte keinen Einfluss auf Lebensqualität oder schilddrüsenspezifische Symptome.13 Bei Vorliegen einer subklinischen Hypothyreose mit TSH-Werten >10mIU/l ergaben Metaanalysen bei Personen unter 65 Jahren jedoch ein erhöhtes kardiovaskuläres Risiko und eine erhöhte Mortalität.14 Eine LT4-Therapie bei subklinischer Hypothyreose hatte einen positiven Einfluss auf die Mortalität bei jüngeren Patient:innen (<65 bis 70 Jahre), nicht jedoch bei älteren.11 Gerade bei älteren Personen besteht ein erhöhtes Risiko bei LT4-Übersubstitution mit Auftreten von kardialen Arrhythmien oder Osteoporose. Zudem steigen die TSH-Spiegel im Alter physiologischerweise an, sodass eine formal milde subklinische Hypothyreose ein Normalbefund sein kann.
Gemäss den aktuellen Therapieempfehlungen (Tab. 2) sollten Personen unter 70 Jahren mit persistent erhöhtem TSH >10mIU/l mit LT4 behandelt werden. Bei Älteren kann in dieser Situation eine Therapie erwogen werden. Bei Frauen mit Schwangerschaftswunsch kann eine Levothyroxin-Substitution bereits ab einem TSH-Wert von >4mIU/l diskutiert werden. Kleine randomisierte, kontrollierte Studien haben gezeigt, dass eine LT4-Therapie vor Konzeption das Outcome einer assistierten Reproduktion verbessern kann.15
Wichtig ist, dass bei der Behandlung einer Hypothyreose mit Eintreten der Schwangerschaft die Dosis adäquat erhöht wird: Der Fetus ist in den ersten 16 bis 20 Wochen auf die mütterlichen Schilddrüsenhormone angewiesen. Um dem erhöhten Bedarf gerecht zu werden, wird empfohlen, die Dosis um 25–30% zu erhöhen, sobald die Schwangerschaft festgestellt wird.
Nach Normalisierung von TSH und fT4 haben bis zu 15% der Patient:innen persistierende, oft unspezifische Symptome. Hier sollten zunächst unbedingt auch andere Differenzialdiagnosen erwogen werden.
Da auch bei normalisiertem TSH die gewebespezifischen Spiegel von Triiodthyronin (T3) prinzipiell noch niedrig sein können, insbesondere bei Patient:innen, die aufgrund eines Polymorphismus der Deiodinase-2 das T4 auf zellulärer Ebene nicht effektiv in das biologisch aktivere T3 umbauen können, stellt sich die Frage, ob zusätzlich T3 substituiert werden sollte. Bisher ist die Datenlage diesbezüglich nicht konklusiv, die Langzeitwirkungen einer T3-Therapie sind nicht bekannt. Die Ergebnisse des T3-4-Hypo Trials, einer niederländischen multizentrischen, randomisierten, placebokontrollierten Studie bei Patient:innen mit persistierender Fatigue unter LT4, werden mit Spannung erwartet. Aktuell kann eine Kombinationstherapie aus LT4 und LT3 in Einzelfällen unter engmaschigem Monitoring erwogen werden.
Von Patient:innen mit chronischer Autoimmunthyreoiditis kommt häufig die Frage, ob sie Selen supplementieren sollten. Es gibt in der Literatur Hinweise, dass eine Selensupplementation bei Patient:innen mit AITD die TPO-Antikörperspiegel senken kann. Ob dies klinisch relevant ist oder ob eine langfristige Selensupplementation sicher ist, bleibt unklar. Es gibt keine klare Evidenz, dass eine Selentherapie erhöhte TSH-Werte normalisieren kann,16 sodass eine generelle Supplementation nicht empfohlen werden kann.
Morbus Basedow
Der Morbus Basedow ist die häufigste Ursache für eine Schilddrüsenüberfunktion, insbesondere bei Patient:innen unter 40 Jahren; circa 2% der Frauen und 0,2% der Männer weltweit sind betroffen.17 In mehr als 95% der Fälle werden positive Antikörper gegen den TSH-Rezeptor (TRAK) nachgewiesen, die zu einer exzessiven Sekretion von Schilddrüsenhormonen und zur Ausbildung einer Struma führen.
Typisch für den M. Basedow ist die häufig rasch auftretende Symptomatik einer Hyperthyreose mit Schlaf- oder Konzentrationsstörungen, Tremor, Ängsten, Gewichtsverlust oder Palpitationen. Bei älteren Patient:innen stehen oft kardiovaskuläre Symptome wie eine neue Herzinsuffizienz oder ein Vorhofflimmern im Vordergrund.
Diagnostik
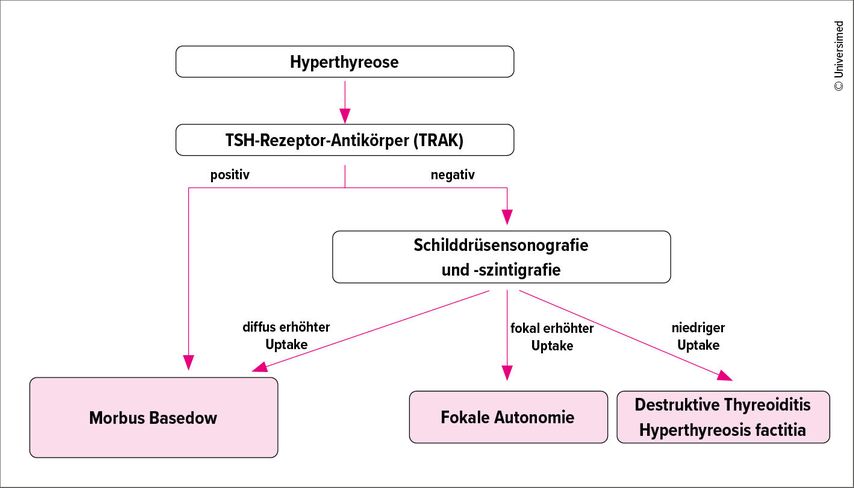
Bei Vorliegen einer manifesten Hyperthyreose (TSH↓, fT4↑) mit positiven TRAK wird die Diagnose des M. Basedow gestellt. Bei negativen TRAK sollten sich eine Sonografie und Schilddrüsenszintigrafie anschliessen (Abb. 1). Beim M.Basedow zeigt sich sonografisch ein stark vaskularisiertes, unruhiges Parenchym, szintigrafisch findet sich typischerweise ein diffus erhöhter Uptake. Mittels Szintigrafie gelingt auch die Unterscheidung von der akuten Zerfallsthyreoiditis, die sonografisch schwierig vom M.Basedow zu differenzieren ist.
Endokrine Orbitopathie (EOP)
Zusätzlich zur Manifestation an der Schilddrüse kommt es in bis zu 20% der Fälle zu einer endokrinen Orbitopathie: TSH-Rezeptor-Antikörper und TSH-Rezeptor-spezifische T-Zellen stimulieren TSH-Rezeptoren auf retroorbitalen Fibroblasten und Adipozyten und führen zu einer Entzündungsreaktion unter Einbezug der Augenmuskeln. Unter anderem durch Akkumulation von Glykosaminoglykanen in der extrazellulären Matrix kann es zur Schwellung der Augenmuskeln kommen, sodass in schweren Fällen die Gefahr einer druckinduzierten Optikusneuropathie mit drohendem Sehverlust besteht.
In milden Fällen manifestiert sich die EOP mit tränenden, trockenen oder gereizten Augen und einer Schwellung der Augenlider. Schwerer betroffene Patient:innen berichten über Schmerzen oder ein Druckgefühl hinter den Augen sowie den charakteristischen Exophthalmus mit Doppelbildern und Sehstörungen.
Die EOP kann sowohl vor, während oder nach der Hyperthyreose auftreten, sodass eine hohe Vigilanz vonnöten ist: Patient:innen mit Symptomen, die auf eine EOP hindeuten können, sollten frühzeitig ophthalmologisch vorgestellt werden.
Das primäre Therapieziel bei der EOP ist das Erreichen einer Euthyreose, zudem sollten Patient:innen darauf hingewiesen werden, dass Rauchen die Erkrankung verschlechtern kann. In milden Fällen wird eine Watch-and-wait-Strategie verfolgt, eine Selensupplementation über 6 Monate kann aufgrund der antiinflammatorischen Effekte empfohlen werden. Bei schwereren Verläufen sind intravenöse Glukokortikoide indiziert. Bei unkontrollierbarer Situation sollte eine interdisziplinäre Evaluation hinsichtlich weiterer immunsuppressiver Therapiemöglichkeiten, einer orbitalen Radiatio oder –als Ultima Ratio– einer chirurgischen Orbitadekompression erfolgen.
Therapie
Medikamentöse Therapie
Das Ziel der Behandlung des M. Basedow ist die Wiederherstellung der Euthyreose. Initial erfolgt eine medikamentöse Therapie mit Thyreostatika, die die Schilddrüsenhormonsynthese blockieren. Mittel der Wahl ist Carbimazol (Neo-Mercazole®), das aufgrund seiner Halbwertszeit von 9 Stunden einmal täglich gegeben werden kann. Alternativ steht mit Propylthiouracil ein weiteres Thyreostatikum zur Verfügung, das aufgrund eines etwas ungünstigeren Nebenwirkungspotenzials jedoch seltener eingesetzt wird. Bei stark symptomatischen Patient:innen kann initial bis zur vollständigen Thyreostase zusätzlich eine Betablockade, beispielsweise mit Propanolol, erfolgen.
Carbimazol ist generell gut verträglich, die häufigste Nebenwirkung ist ein milder Hautausschlag, der gut auf Antihistaminika anspricht. Bei allen Thyreostatika besteht ein geringes Risiko für Hepatotoxizität sowie Agranulozytose, sodass eine Behandlung bei Neutropenie oder stark erhöhten Transaminasen kontraindiziert ist. Vor Beginn der Behandlung empfiehlt sich eine Bestimmung des Blutbilds sowie der Leberwerte, da auch die Hyperthyreose selbst eine Transaminitis bedingen kann. Patient:innen unter Thyreostatikabehandlung sollten instruiert werden, sich bei Fieber oder fieberhafter Pharyngitis ärztlich vorzustellen, um eine Agranulozytose auszuschliessen.
In der Regel wird für 1 bis 1,5 Jahre nach Erreichen der Euthyreose mit der niedrigstmöglichen Dosis von Carbimazol behandelt, danach kann ein Auslassversuch unternommen werden. Vor dem Auslassversuch sollte eine Euthyreose vorliegen und die TRAK sollten nicht mehr messbar sein. Bei circa der Hälfte der Patient:innen ist die Erkrankung dann geheilt, bei den anderen 50% kommt es im Verlauf zum Hyperthyreoserezidiv. Raucher sowie Patient:innen mit grosser Struma, EOP oder persistierend hohen TRAK-Werten haben ein deutlich erhöhtes Rezidivrisiko. Schon zu Therapiebeginn sollte unbedingt ein Rauchstopp empfohlen werden.
Bei medikamentös nicht kontrollierbarem M. Basedow oder Basedowrezidiv sollte frühzeitig eine definitive Therapie mit den Patient:innen besprochen werden.
Radioiodtherapie
Eine Radioiodtherapie (RJT) wird insbesondere für Patient:innen mit kleiner Struma (<50g) empfohlen. Im stationären Setting erfolgt die orale Gabe von radioaktivem Natriumiodid (Na131I), das sich in der Schilddrüse anreichert. Durch Betastrahlung kommt es zur allmählichen Ablation des Schilddrüsengewebes nach 6 bis 18 Wochen. Im Verlauf entwickelt sich eine Hypothyreose, sodass eine lebenslange Substitutionstherapie mit Levothyroxin erfolgen muss.
Eine RJT ist in der Schwangerschaft und Stillzeit kontraindiziert. Zudem sollten Patient:innen bis 6 Monate nach der Therapie nicht schwanger werden. Eine relative Kontraindikation ist die EOP, da es nach RJT zu einem passageren Anstieg der TRAK mit möglicher EOP-Verschlechterung kommen kann. Die beim Morbus Basedow verwendeten niedrigen Strahlendosen bei der RJT führen nicht zu einem signifikant erhöhten Karzinomrisiko.18,19
Totale Thyreoidektomie
Bei Patient:innen mit grosser Struma, zusätzlichem Vorliegen von Schilddrüsenknoten oder Kinderwunsch innerhalb der nächsten 6 Monate ist die totale Thyreoidektomie die definitive Therapie der Wahl. Um postoperative Komplikationen wie einen Hypoparathyreoidismus oder eine Schädigung des Nervus laryngeus recurrens zu vermeiden, empfiehlt es sich, die Thyreoidektomie in einem Zentrum mit Erfahrung in der Schilddrüsenchirurgie durchführen zu lassen. Vor der Operation sollten die Patient:innen mit Thyreostatika und gegebenenfalls Betablockern behandelt werden, um eine Euthyreose und Frequenzkontrolle zu erzielen. Postoperativ wird eine Schilddrüsenhormonsubstitution begonnen.
Patientinnen sollten wissen, dass auch nach definitiver Therapie eines Morbus Basedow im Falle einer Schwangerschaft in regelmässigen Abständen die TRAK-Werte kontrolliert werden. Diese können in seltenen Fällen in der Schwangerschaft persistieren und durch plazentären Transfer eine transiente neonatale Hyperthyreose auslösen.
Literatur:
1 Simmonds MJ, Gough SCL: Unravelling the genetic complexity of autoimmune thyroid disease: HLA, CTLA-4 and beyond. Clin Exp Immunol 2004; 136: 1-10 2 Stathatos N, Daniels GH: Autoimmune thyroid disease. Curr Opin Rheumatol 2012; 24: 70-5 3 Antonelli A et al.: Autoimmune thyroid disorders. Autoimmun Rev 2015; 14: 174-80 4 Brix TH et al.: Evidence for a major role of heredity in Graves’ disease: a population-based study of two Danish twin cohorts. J Clin Endocrinol Metab 2001; 86: 930-4 5 Iddah MA, Macharia BN: Autoimmune thyroid disorders. ISRN Endocrinol 2013; 509764 6 Duntas LH: Selenium and the thyroid: a close-knit connection. J Clin Endocrinol Metab 2010; 95: 5180-8 7 Ferrari SM et al.: Environmental issues in thyroid diseases. Front Endocrinol (Lausanne) 2017; 8: 50 8 Boelaert K et al.: Prevalence and relative risk of other autoimmune diseases in subjects with autoimmune thyroid disease. Am J Med 2010; 123: 183.e1-9 9 Resende de Paiva C et al.: Association between Hashimoto's thyroiditis and thyroid cancer in 64,628 patients. Front Oncol 2017; 7: 53 10 Paparodis R et al.: Hashimoto’s thyroiditis pathology and risk for thyroid cancer. Thyroid 2014; 24: 1107-14 11 Chaker L et al.: Hypothyroidism. Nat Rev Dis Primers 2022; 8: 30 12Mello RB de et al.: Evaluation of bedtime vs. morning levothyroxine intake to control hypothyroidism in older patients: a pragmatic crossover randomized clinical trial. Front Med (Lausanne) 2022; 9: 828762 13 Feller M et al.: Association of thyroid hormone therapy with quality of life and thyroid-related symptoms in patients with subclinical hypothyroidism: a systematic review and meta-analysis. JAMA 2018; 320: 1349-59 14 Moon S et al.: Subclinical hypothyroidism and the risk of cardiovascular disease and all-cause mortality: a meta-analysis of prospective cohort studies. Thyroid 2018; 28: 1101-10 15 Velkeniers B et al.: Levothyroxine treatment and pregnancy outcome in women with subclinical hypothyroidism undergoing assisted reproduction technologies: systematic review and meta-analysis of RCTs. Hum Reprod Update 2013; 19: 251-8 16 Qiu Y et al.: Insufficient evidence to support the clinical efficacy of selenium supplementation for patients with chronic autoimmune thyroiditis. Endocrine 2021; 73: 384-97 17 Davies TF et al.: Graves’ disease. Nat Rev Dis Primers 2020; 6: 52 18 Gronich N et al.: Cancer risk after radioactive iodine treatment for hyperthyroidism: a cohort study. Thyroid 2020; 30: 243-50 19Franklyn JA et al.: Thyroid function and mortality in patients treated for hyperthyroidism. JAMA 2005; 294: 71-80
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...