Risikostratifizierung bei PBC-Patienten
Bericht: Mag. Dr. Anita Schreiberhuber
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei Patienten mit primärer biliärer Cholangitis (PBC), die ein unzureichendes Ansprechen aufUrsodesoxycholsärue (UDCA)aufweisen oder dagegen intolerant sind, wurde unter Obeticholsäure (OCA) eine signifikante Verbesserung der Cholestaseparameter nachgewiesen. Zudem zeigen erste Daten, dass OCA auch einer Fibrosierung entgegenwirken kann.
PBC ist eine chronische, langsam progrediente Autoimmunerkrankung der Leber, bei der eine chronische Destruktion der kleinen Gallengänge erfolgt, die mit der Entwicklung einer Leberfibrose und in weiterer Folge einer Leberzirrhose einhergehen kann.1 Das Alter bei Diagnosestellung wurde als unabhängiger Prädiktor für die Prognose identifiziert: Je jünger der Patient, umso größer ist das Risiko für ein leberassoziiertes Ereignis im Verlauf.2 Umso relevanter ist es, diesem Risiko rechtzeitig durch pharmakologische Intervention entgegenzuwirken.
Standardtherapie der PBC
Bilirubin und die alkalische Phosphatase (ALP) sind valide Surrogatmarker, die zur Risikostratifizierung von Patienten herangezogen werden können. Als Schwellenwerte gelten dabei 1xULN („upper limit of the normal“) bzw. 1,67xULN. Mit Ursodeoxycholsäure (UDCA), der Standardtherapie der PBC, konnte bei Patienten mit bereits normalen Bilirubinwerten zu Studienbeginn nach einem Jahr eine weiteren Reduktion des Bilirubins auf ≤0,6xULN gezeigt werden. Dieser Wert war mit einer Verbesserung des 10-Jahres-Überlebensvon 11% assoziiert, wobei das Erreichen von Bilirubinspiegeln ≤0,6xULN und eine Normalisierung der ALP-Spiegel mit dem niedrigsten Risiko für eine Lebertransplantation (LT) oder dem Tod einhergingen.3 In einer internationalen multizentrischen Studie mit 3092 PBC-Patienten führte die UDCA-Gabe zu einer signifikanten Verlängerung des LT-freien Überlebens (p<0,001), die auch bei Patienten mit inkomplettem biochemischem Response statistisch signifikant blieb.1 In einer weiteren Studie zeigte sich, dass ungeachtet des biochemischen Ansprechens auf UDCA der Schweregrad des Fibrosestadiums negative Auswirkungen auf das LT-freie Überleben hatte.4 Daher empfiehlt es sich, die Therapie mit UDCA auch bei Non-Respondern weiterzuführen.
Obeticholsäure (Ocaliva®)
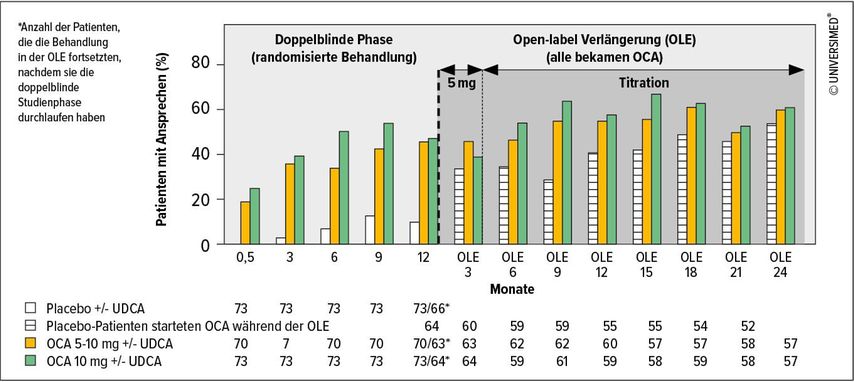
Obeticholsäure (OCA) wurde Ende 2016 als einzige Zweitlinientherapie für Erwachsene mit PBC zugelassen, die unzureichend auf UDCA ansprechen, und als Monotherapie bei Erwachsenen, bei denen eine Intoleranz gegenüber UDCA besteht.5,6 In der 12-monatigen doppelblinden Phase-III-Studie POISE wurden 217 PBC-Patienten zum Erhalt von OCA, 10mg bzw. 5mgmit der Möglichkeit der Titration auf 10mg bzw.Placebo randomisiert. Der primäre Endpunkt war die Kombination eines Rückgangs der ALP auf <1,67xULN, einer mindestens 15%igen ALP-Senkung sowie ein Gesamtbilirubin ≤ULN. Dieser wurde bei 46% in der 5- bis-10mg-Gruppe, bei 47% in der 10-mg-Gruppe und bei 10% in der Placebogruppe erreicht (beide p-Werte vs. Placebo <0,001) (Abb. 1).7 Bei fast allen Patienten –auch bei jenen, die die Kriterien für den primären Endpunkt nicht erfüllt hatten–wurde unter OCA eine Reduktion der ALP- und Gesamtbilirubinspiegel nachgewiesen.8
Abb. 1: Signifikanter Anstieg der Patienten unter OCA, die den primären Endpunkt erreichten (modifiziert nach Trauner M et al.: UEG Week 2017; OP288)
Allerdings weisen immer noch 40% der Patienten ein unzureichendes Ansprechen auf UDCA auf und zeigen ein erhöhtes Risiko für die Entwicklung schwerwiegender Komplikationen.9 In einer Subanalyse der POISE-Studie haben Bowlus et al. den Effekt von OCA auf die Fibrosierung untersucht. Hierfür wurden Leberbiopsien, die zu Studienbeginn und nach 3 Jahren OCA-Therapie entnommen wurden, randomisiert und verblindet von zwei Pathologen analysiert.10 Bei 71% der Patienten konnte unter dreijähriger OCA-Therapie eine Verbesserung bzw. zumindest eine Stabilisierung der Fibrose gemäß dem Nakanuma-Scorefestgestellt werden. Außerdem resultierte die Gabe von OCA bei der überwiegenden Mehrheit der Patienten in einer Verbesserung der meisten Kollagen-Parameter.10
Literatur:
1 Harms MH et al.: J Hepatol 2019; 71: 357-65 2 Cheung AC et al.: Clin Gastroenterol Hepatol 2019; doi: 10.1016/j.cgh.2018.12.028 3 Murillo Perez CF et al.: Am J Gastroenterol 2020; 115: 1066-74 4 Murillo Perez CF et al.: Aliment Pharmacol Ther 2019; 50: 1127-36 5 www.ema.europa.eu/en/medicines/human/EPAR/ocaliva; zuletzt aufgrufen am 21.2. 2021 6 Fachinformation Obeticholsäure, Stand: Jänner 2021 7 Nevens F et al.: N Engl J Med 2016; 375: 631-43 8 Carbone M et al.: Hepatol Communications 2018; 2: 683-92 9European association for the study of the liver: J Hepatol 2017; 67(1): 145-72 10 Bowlus CL et al.: Clin Gastroenterol Hepatol 2019; pii: S1542-3565(19)31106-1
Entgeltliche Einschaltung
Mit freundlicher Unterstützung durch Intercept Pharma Austria GmbH
Fachkurzinformation siehe Seite 58 | AT-PP-PB-0080 Mar 21
Fachkurzinformation
Ocaliva 5 mg Filmtabletten. Ocaliva 10 mg Filmtabletten. Qualitative und quantitative Zusammensetzung: Jede Filmtablette enthält 5 mg bzw. 10 mg Obeticholsäure. Sonstige Bestandteile: Tablettenkern: Mikrokristalline Cellulose (E 460), Poly(O-carboxymethyl)stärke-Natriumsalz (Typ A), Magnesiumstearat; Tablettenüberzug: Poly(vinylalkohol) (E 1203), Titandioxid (E 171), Macrogol (3350) (E 1521), Talkum (E 553b), Eisen(III)-hydroxid-oxid x H2O (E 172). Pharmakotherapeutische Gruppe: Gallensäuren und Derivate, ATC-Code: A05AA04. Anwendungsgebiete: Ocaliva wird angewendet für die Behandlung der primären biliären Cholangitis (PBC) (auch unter der Bezeichnung primäre biliäre Zirrhose bekannt) in Verbindung mit Ursodesoxycholsäure (UDCA) bei Erwachsenen, die unzureichend auf UDCA ansprechen, oder als Monotherapie bei Erwachsenen, die UDCA nicht tolerieren können. Dosierung: Vor Behandlungsbeginn muss der Leberstatus bekannt sein. Nicht zirrhotisch oder Child-Pugh Klassifikation A: Anfangsdosis einmal täglich 5 mg; Dosistitration bis zur Höchstdosis von einmal täglich 10 mg, wenn nach 6-monatiger Behandlung keine angemessene Verringerung der ALP und/oder des Gesamtbilirubins erreicht werden konnte und die Obeticholsäure vertragen wird. Child-Pugh Klassifikation B oder C oder dekompensierte Zirrhose: Anfangsdosis einmal wöchentlich 5 mg; Dosistitration auf bis zu zweimal wöchentlich 5 mg (im Abstand von mindestens 3 Tagen), wenn nach 3-monatiger Behandlung keine angemessene Verringerung der ALP und/oder des Gesamtbilirubins erreicht werden konnte und die Obeticholsäure vertragen wird; anschließend ggf. Titrierung auf die Höchstdosis von zweimal wöchentlich 10 mg (im Abstand von mindestens 3 Tagen) gemäß Ansprechen und Verträglichkeit. Siehe veröffentliche Fachinformation zu weiteren Informationen über Management und Dosisanpassung bei starkem Pruritus und zu speziellen Patientengruppen. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile, totaler Gallengangsverschluss. Inhaber der Zulassung: Intercept Pharma International Ltd., Ormond Building, 31–36 Ormond Quay Upper, Dublin 7, Irland. Rezeptpflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie zu etwaigen Gewöhnungseffekten entnehmen Sie bitte der veröffentlichten Fachinformation. Stand der Information: 01/2021.
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Jeder Verdachtsfall einer Nebenwirkung zu OCALIVA ist zu melden an Intercept Pharma Austria GmbH, Tel: +43 (0)1 928 40 12, E-Mail: drugsafety@interceptpharma.com, und/oder über das nationale Meldesystem an das Bundesamt für Sicherheit im Gesundheitswesen, Traisengasse 5, 1200 Wien, Österreich, Fax: +43 (0)50 555 36207, Website: www.basg.gv.at. AT-NP-PB-140