Chirurgie bei Lebermetastasen: Was ist heute möglich?
Autoren:
Dr. Felix Julius Krendl
Assoz. Prof. Priv.-Doz. Dr. Rupert Oberhuber
Univ.-Prof. Dr. Stefan Schneeberger
Universitätsklinik für Visceral-, Transplantations-und Thoraxchirurgie
Medizinische Universität Innsbruck
Korrespondierender Autor:
Univ.-Prof. Dr. Stefan Schneeberger
E-Mail: stefan.schneeberger@i-med.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Für kolorektale und neuroendokrine Lebermetastasen bietet die chirurgische Resektion – in Kombination mit neoadjuvanten Systemtherapien – die einzige Chance auf Kuration. Nur etwa bei einem Fünftel aller Patienten mit kolorektalen Lebermetastasen sind dieseprimär resektabel, sodass sich innovative interventionelle und chirurgische Therapiekonzepte entwickelt haben, um die Resektabilitätsrate zu erhöhen. Als „Maximalform der Resektion“ bleibt die Lebertransplantation, mit der für Patienten mit günstiger Tumorbiologie 5-Jahres-Überlebensraten von 80% erreicht werden.
Keypoints
Die chirurgische Resektion ist der einzige kurative Ansatz für Patient*innen mit kolorektalen Lebermetastasen.
Entscheidend für die chirurgische Resektabilität ist in vielen Fällen das zurückbleibende Lebergewebe („future liver remnant“; FLR).
Interventionelle und chirurgische Innovationen wie die PVE, LVD und ALPPS erlauben eine primär nicht resektable Situaton in eine resektable zu überführen.
Die Lebertransplantation bietet als „Maximalform der Resektion“ auch für Patient*innen mitausgeprägtem Befall und hoher Tumorlast eine Alternative zur palliativen Systemtherapie mit teils deutlich besseren 5-Jahres-Überlebensraten.
Die Leber ist häufig von metastatischen Absiedelungen betroffen. Am häufigsten sindkolorektale Karzinome für sekundäre Malignome der Leber verantwortlich. Auch andere Karzinome wie zum Beispiel das Mamma-, Nierenzell- oder Pankreaskarzinom sowie gastrointestinale neuroendokrine Tumoren bzw. Karzinome können in die Leber streuen.1
Behandlung von Lebermetastasen
Mittlerweile stehen viele Modalitäten zur Behandlung von Lebermetastasen zur Verfügung. Die Herausforderung ist, die richtige Modalität zum richtigen Zeitpunkt für den richtigen Patienten/die richtige Patientin auszuwählen. Entscheidend für die optimale Behandlung ist der Diskurs in einem interdisziplinären hepatobiliären Tumorboard. Auf Basis der erhobenen Befunde wird dort ein multimodales Therapiekonzept erstellt.2
Die chirurgische Resektion ist nach wie vor eine zentrale Säule in der Behandlung von Lebermetastasen. Indikationen müssen aber unter Berücksichtigung einer systemischen (Chemo-)Therapie und inKenntnis von alternativen interventionellen Ansätzen – wie stereotaktischer Bestrahlung („stereotactic body radiation therapy“, SBRT) und (stereotaktischer) Radiofrequenzablation (SRFA) – gestellt werden.3,4
Chirurgische Resektion
Für ausgewählte Entitäten wie beispielsweise kolorektale oder neuroendokrine Lebermetastasen ist die chirurgische Resektion in Kombination mit neoadjuvanten Chemotherapien der Goldstandard bzw. das Therapieverfahren/die Therapie der Wahl.5,6
Chirurgisch-technische Aspekte der Lebermetastasenbehandlung
Generell ist in der Chirurgie ein anhaltender Trend hin zu weniger invasiven bzw. minimalinvasiven Techniken zu verzeichnen. Dies spiegelt sich auch in der Leberchirurgie wider, wo die klassische, offene Operationstechnik zunehmend von laparoskopischen und handassistierten laparoskopischen Techniken ersetzt wird.7 Zunehmend halten auch roboterassistierte Operationstechniken Einzug in die Leberchirurgie.8
Die Vorteile der minimalinvasiven Chirurgie sind dabei ein geringerer intraoperativer Blutverlust, eine geringere Rate an postoperativen Komplikationen sowie eine raschere Rekonvaleszenz und damit einhergehend eine kürzere Krankenhausaufenthaltsdauer.9–12
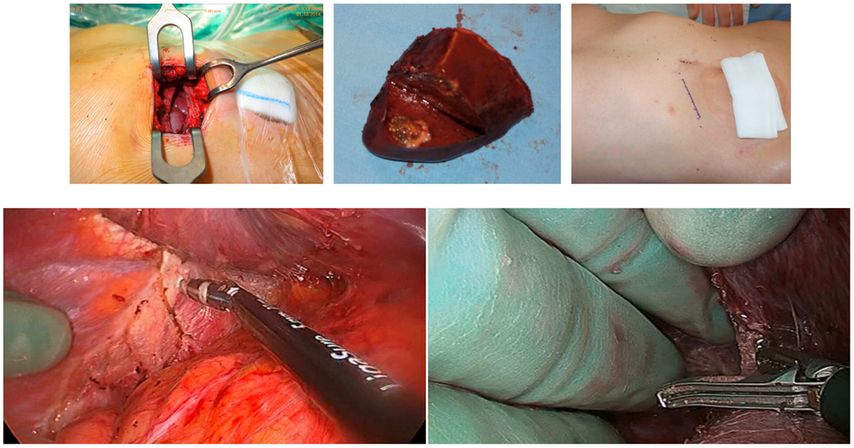
Kombinationstechniken wie handassistiert-laparoskopische Operationen vereinen die Vorteile der offenen und laparoskopischen Chirurgie und erlauben maximale Sicherheit durch manuelle Kontrolle über minimaltraumatische Zugangswege (Abb.1)13–15
Abb. 1: Zu sehen ist eine handassistiert-laparoskopische Leberresektion. Durch die digitale Kontrolle wird maximale Operationssicherheit über einen minimal traumatischen Zugangsweg erreicht
Im Gegensatz zu primären Lebertumoren, bei denen die chirurgische Resektion zumeist entlang der anatomischen Grenzen erfolgt (Hemihepatektomie rechts/links, erweitert rechts/erweitert links), kommt bei der Metastasenchirurgie häufig ein parenchymsparender Ansatz im Sinne von atypischen Resektionen zum Einsatz.16 Hintergrund für dieses Vorgehen sind unteranderem die hohe Rezidivrate und die Notwendigkeit weiterer Resektionen/Interventionen (Salvage-Operation). Bei erweiterten oder Mehrfach-Resektionen ist das verbleibende Restvolumen der Leber („future liver remnant“, FLR) oftmals der limitierende Faktor bei der Operationsplanung.17–19
Die Fähigkeit der Leber, auf Stimulation hin zuwachsen, ist die Grundlage für Techniken zur Vergrößerung des FLR. Bei der „portal vein embolization“ (PVE) wird durch die Embolisation des Pfortaderastes des zu resezierenden Teils der Leber eine Hypertrophie des FLR erreicht.20 Allerdings kann in bis zu 20% der Fälle trotz PVE keine Resektion durchgeführt werden. Einerseits bedingt durch eine insuffiziente Hypertrophie des FLR, andererseits aufgrund von Tumorprogression während der oftmals langen (6 Wochen und mehr dauernden) Hypertrophiephase.21
Zweizeitige Hepatektomie
Von Adam et al. wurde erstmals das Konzept der zweizeitigen Hepatektomie („two-staged hepatectomy“, TSH) beschrieben.22 Bei 16 Patient*innen mit initial nicht resektablen kolorektalen Lebermetastasen wurde in einer ersten Operation die Haupttumormasse entfernt und nach einer Periode der Konsolidierung und Parenchymregeneration (im Median 4 Monate) die Resektion in einem zweiten Schritt komplettiert. In sechs Fällen wurde die TSH mit einer PVE kombiniert, um nach der zweiten Operation ausreichend Lebervolumen übrig zu haben. Zwischen den beiden Operationen erhielten die Patienten eine systemische Chemotherapie, um das Risiko für eine Tumorprogression zu minimieren.
In einer Serie von Kianmanesh et al. wurde die TSH mit einer Ligatur („portal vein ligation“; PVL) anstatt einer Embolisation der Pfortader kombiniert.23
ALPPS
Schnitzbauer et al. haben das Konzept der TSH und PVL schließlich zur sogenannten ALPPS („Associating Liver Partition with Portal vein ligation for Staged hepatectomy“) weiterentwickelt, wo während der ersten Operation zusätzlich zur PVL eine Durchtrennung des Leberparenchyms (In-situ-Split) entlang der geplanten Resektionslinie erfolgt. Mit der Durchtrennung des Leberparenchyms werden Kollateralen zwischen dem zu resezierenden Leberteil und dem FLR unterbunden, womit ein stärkerer Hypertrophiereiz für den FLR gesetzt wird und die Komplettierung bereits innerhalb einer Zeitspanne von weniger als zwei Wochen erfolgen kann.24 Der kurze Zeitraum zwischen erster und zweiter Operation macht eine Tumorprogression unwahrscheinlicher.25 Den Vorteilen der ALPPS stehen eine hohe Rate an postoperativen Komplikationen und eine hohe Letalität (bis zu 15% Krankenhausletalität) gegenüber.26 Das initiale Konzept der ALPPS wurde mittlerweile mehrfach modifiziert: Bei der sogenannten Partial-ALPPS werden nur 50–80% des Leberparenchyms durchtrennt, bei vergleichbarer Hypertrophierate und weniger postoperativen Komplikationen.27
Die Mini-ALPPS ist eine Weiterentwicklung der Partial-ALPPS, bei der die partielle Parenchymdurchtrennung mit einer intraoperativen PVE kombiniert wird. Insgesamt ist das chirurgische Trauma geringer. Die Hilusstrukturen werden bei der ersten Operation nicht freipräpariert, womit das Risiko für eine Kompromittierung der arteriellen Versorgung gering ist.28 Eine Beeinträchtigung der arteriellen Durchblutung führt meist zu Gallengangskomplikationen und Infektionen, welche für ein Drittel der perioperativen Letalität verantwortlich sind.29
LVD
2016 wurde von Guiu et al. ein neues interventionelles Konzept, die sogenannte „liver venous deprivation“ (LVD), vorgestellt. Dabei wird zusätzlich zur PVE eine Embolisation der Lebervene(n) durchgeführt und damit eine schnellere Hypertrophie des FLR erreicht.30,31 Damit scheint dieses Verfahren risikoärmer als die ALPPS-Operation zu sein.32
Die Lebertransplantation als Behandlungsmodalität für nichtresektable Lebermetastasen
Die Oslo-Gruppe um Pal-Dag Line hat mit den Secondary-Cancer-Studien (SECA-1 und SECA-2 Trial) die Lebertransplantation (LT) als Behandlungsoption für Patienten mit nichtresektablen Lebermetastasen etabliert.33 Für selektionierte Patient*innen mit günstiger Tumorbiologie sind 5-Jahres-Überlebensraten von bis zu 83% möglich.34
Die vielversprechenden Ergebnisse dieser Studien haben das Feld der „Transplantationsonkologie“ neu aufleben lassen.33 Zu diesem Verfahren gibt es mittlerweile auch Konsensus-Empfehlungen der ILTS und der IHPBA.35,36
Ebenfalls von dieser Arbeitsgruppe stammt das sogenannte RAPID-Konzept („resection and partial liver segment 2/3 transplantation with delayed total hepatectomy“).37 Dabei wird die Hepatektomie ineinem zweizeitigen Verfahren durchgeführt: Nach einer links- oder linkslateralen Hepatektomie wird die Transplantation einer linkslateralen Splitleber (Segmente 2 und 3) durchgeführt. Die zunächst unzureichende metabolische Masse des linkslateralen Transplantats wird durch die verbleibende native Leber kompensiert, welche bei der ersten Operation unter Reduktion des Pfortaderflusses in situ belassen wird. Nach ausreichender Hypertrophie des linkslateralen Transplantats wird die restliche, von Tumor befallene Leber entfernt.
Königsrainer et al. haben eine Modifikation des RAPID-Protokolls beschrieben, bei dem das linkslaterale Transplantat nicht von einem Leichen-, sondern von einem Lebendspender stammt (LD-RAPID).38 Die Leber-Lebendspende („live donor liver transplantation“; LDLT) als Option für Patient*innen mit nicht resektablen kolorektalen Lebermetastasen wurde kürzlich auch in einer prospektiven, multizentrischen, nordamerikanischen Studie evaluiert. Die ersten Ergebnisse waren vielversprechend und wurden im März 2022 in JAMA Surgery publiziert.39 Das Gesamtüberleben nach 1,5 Jahren betrug 100%. Als Einschränkung ist der kurze Beobachtungszeitraum von 18 Monaten (Median) zu erwähnen. Die onkologischen Langzeitergebnisse sind abzuwarten.
Eine weitere Option für die chirurgische Behandlung von komplexen Tumorerkrankungen der Leber sind die Ex-situ-Resektion und anschließende Autotransplantation der tumorfreien Leber.40 Technisch-chirurgisch handelt es sich um äußerst anspruchsvolle Operationen. Die erste Ex-situ-Resektion mit anschließender Autotransplantation wurde 1988 von Pichlmayr beschrieben.41 Dieses Verfahren wird allerdings selten angewandt, da sinnvolle Indikationen selten sind und die Komplikationsrate hoch ist.
Zusammenfassung und Ausblick
Die chirurgische Resektion ist die bestetablierte kurative Option für Patienten mit kolorektalen und neuroendokrinen Lebermetastasen. Vergleicht man das 5-Jahres-Überleben von Patient*innen mit kolorektalen Lebermetastasen, die mit kurativer Intention reseziert werden, mit jenen, die eine palliative Systemtherapie erhalten, so ergeben sich deutliche Unterschiede im Überleben.42 Mittels herkömmlicher Methoden sind allerdings nur ca. 25% der Patienten resektabel.33
Vor diesem Hintergrund haben sich innovative interventionelle und chirurgische Ansätze entwickelt, um auch Patient*innen mit nicht resektablen Lebermetastasen chirurgische Therapieoptionen anbieten zu können. Die LT kann dabei als maximale Form der „Resektion“ verstanden werden. 5-Jahres-Überlebensraten von 60–80% (für selektionierte Patient*innen) zeigen eine deutlich bessere Prognose verglichen mit der Alternative einer palliativen Systemtherapie. In Zukunft wird die LT bei der Therapie von multiplen Lebermetastasen vermutlich eine größere Rolle spielen.
Für Patient*innen mit resektablen kolorektalen Lebermetastasen und hoher Tumorlast kann mit einer LT ein längeres Gesamtüberleben erreicht werden.43,44 Eine randomisiert-kontrollierte Studie, welche die LT mit der Resektion vergleicht, ist im Gange (NCT01479608). Die Ergebnisse dürfen mit Spannung erwartet werden.
Literatur:
1 de Ridder J et al.: Incidence and origin of histologically confirmed liver metastases: an explorative case-study of 23,154 patients. Oncotarget 2016; 7(34): 55368-76 2 Hellingman T et al.: The value of a dedicated multidisciplinary expert panel to assess treatment strategy in patients suffering from colorectal cancer liver metastases. Surg Oncol 2020; 35; 412-7 3 Chen Y et al.: Neoadjuvant chemotherapy followed by radiofrequency ablation may be a new treatment modality for colorectal liver metastasis: a propensity score matching comparative study. Cancers 2022; 14(21): 5320 4 Schullian P et al.: Stereotactic radiofrequency ablation (SRFA) for recurrent colorectal liver metastases after hepatic resection. Eur J Surg Oncol 2021; 47(4): 866-73 5 Line PD, Dueland S: Liver transplantation for secondary liver tumours: The difficult balance between survival and recurrence. J Hepatol 2020; 73(6): 1557-62 6 Van Cutsem E et al.: ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol 2016; 27(8): 1386-1422 7 Ciria R et al.: A systematic review and meta-analysis comparing the short- and long-term outcomes for laparoscopic and open liver resections for liver metastases from colorectal cancer. Surg Endosc 2020; 34(1): 349-60 8 Rahimli M et al.: Robotic and laparoscopic liver surgery for colorectal liver metastases: an experience from a German Academic Center. World J Surg Oncol 2020; 18(1): 333 9 Guerron AD et al.: Laparoscopic versus open resection of colorectal liver metastasis. Surg Endosc 2013; 27(4): 1138-43 10 Xie SM et al.: Laparoscopic versus open liver resection for colorectal liver metastases: A comprehensive systematic review and meta-analysis. Sci Rep 2017; 7(1): 1012 11 Gumbs AA et al.: Study: International multicentric minimally invasive liver resection for colorectal liver metastases (SIMMILR-CRLM). Cancers 2022: 14(6): 1379 12 Zimmitti G et al.: Indications, trends, and perioperative outcomes of minimally invasive and open liver surgery in non-obese and obese patients: An international multicentre propensity score matched retrospective cohort study of 9963 patients. Int J Surg 2022; 107: 106957 13 Huang MT et al.: Hand-assisted laparoscopic hepatectomy for solid tumor in the posterior portion of the right lobe: initial experience. Ann Surg 2003; 238(5): 674-9 14 Otsuka Y et al.: Laparoscopic hepatectomy for liver tumors: proposals for standardization. J Hepatobiliary Pancreat Surg 2009; 16(6): 720-5 15 Nakada S et al.: Predictors of a difficult Pringle maneuver in laparoscopic liver resection and evaluation of alternative procedures to assist bleeding control. Surg Today 2022; 52(12): 1688-97 16 Deng G et al.: Parenchymal-sparing versus extended hepatectomy for colorectal liver metastases: A systematic review and meta-analysis. Cancer Med 2019; 8(14): 6165-75 17 de Jong MC et al.: Rates and patterns of recurrence following curative intent surgery for colorectal liver metastasis: an international multi-institutional analysis of 1669 patients. Ann Surg 2009; 250(3): 440-8 18 Adam R et al.:Repeat hepatectomy for colorectal liver metastases. Ann Surg 1997; 225(1): 51-60; discussion 60-52 19 Imamura H et al.: Single and multiple resections of multiple hepatic metastases of colorectal origin. Surgery 2004; 135(5): 508-17 20 Heil J, Schadde E: Simultaneous portal and hepatic vein embolization before major liver resection. Langenbecks Arch Surg 2021; 406(5): 1295-1305 21 van Lienden KP et al.: Portal vein embolization before liver resection: a systematic review. Cardiovasc Intervent Radiol 2013; 36(1): 25-34 22 Adam R et al.: Two-stage hepatectomy: A planned strategy to treat irresectable liver tumors. Ann Surg 2000; 232(6): 777-85 23 Kianmanesh R et al.: Right portal vein ligation: a new planned two-step all-surgical approach for complete resection of primary gastrointestinal tumors with multiple bilateral liver metastases. J Am Coll Surg 2003; 197(1): 164-70 24 Schnitzbauer AA et al.: Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings. Ann Surg 2012; 255(3): 405-14 25 de Santibañes E, Clavien, PA: Playing Play-Doh to prevent postoperative liver failure: the “ALPPS“ approach. Ann Surg 2012; 255(3): 415-7 26 Schadde E et al.: ALPPS offers a better chance of complete resection in patients with primarily unresectable liver tumors compared with conventional-staged hepatectomies: results of a multicenter analysis. World J Surg 2014; 38(6): 1510-9 27 Petrowsky H et al.: Is partial-ALPPS safer than ALPPS? A single-center experience. Ann Surg 2015; 261(4): e90-92 28 de Santibañes E et al.: Inverting the ALPPS paradigm by minimizing first stage impact: the Mini-ALPPS technique. Langenbecks Arch Surg 2016; 401(4): 557-63 29 Peng SY et al.: Evolution of associating liver partition and portal vein ligation for staged hepatectomy: Simpler, safer and equally effective methods. World J Gastroenterol 2017; 23(23): 4140-5 30 Guiu B et al.: Simultaneous trans-hepatic portal and hepatic vein embolization before major hepatectomy: the liver venous deprivation technique. Eur Radiol 2016; 26(12): 4259-67 31 Kobayashi K et al.: Liver venous deprivation compared to portal vein embolization to induce hypertrophy of the future liver remnant before major hepatectomy: A single center experience. Surgery 2020; 167(6): 917-23 32 Cassese G et al.: Liver venous deprivation versus associating liver partition and portal vein ligation for staged hepatectomy for colo-rectal liver metastases: a comparison of early and late kinetic growth rates, and perioperative and oncological outcomes. Surg Oncol 2022; 43: 101812 33 Line PD: Liver transplantation for colorectal secondaries: on the way to validation. Curr Opin Organ Transplant 2022; 27(4): 329-36 34 Dueland S et al.: Survival following liver transplantation for patients with nonresectable liver-only colorectal metastases. Ann Surg 2020; 271(2): 212-8 35 Hibi T et al.: Liver Transplantation for colorectal and neuroendocrine liver metastases and hepatoblastoma. Working group report from the ILTS transplant oncology consensus conference. Transplantation 2020; 104(6): 1131-5 36 Bonney GK et al.: Liver transplantation for non-resectable colorectal liver metastases: the International Hepato-Pancreato-Biliary Association consensus guidelines. Lancet Gastroenterol Hepatol 2021; 6(11): 933-46 37 Line PD et al.: A novel concept for partial liver transplantation in nonresectable colorectal liver metastases: The RAPID Concept. Ann Surgery 2015; 262(1): e5-9 38 Königsrainer A et al.: Paradigm shift in the management of irresectable colorectal liver metastases: living donor auxiliary partial orthotopic liver transplantation in combination with two-stage hepatectomy (LD-RAPID). Ann Surg 2019; 270(2): 327-32 39 Hernandez-Alejandro R et al.: Recipient and donor outcomes after living-donor liver transplant for unresectable colorectal liver metastases. JAMA Surg 2022; 157(6): 524-30 40 Weiner J et al.: Ex vivo liver resection and autotransplantation: Should it be used more frequently? Ann Surg 2022; 276(5): 854-9 41 Pichlmayr R et al.: Ex situ operation on the liver. A new possibility in liver surgery. Langenbecks Arch Chir 1988; 373(2): 122-6 42 Engstrand J et al.: Colorectal cancer liver metastases – a population-based study on incidence, management and survival. BMC Cancer 2018; 18(1): 78 43 Dueland S et al.: Survival outcomes after portal vein embolization and liver resection compared with liver transplant for patients with extensive colorectal cancer liver metastases. JAMA Surgery 2021; 146(6): 550-7 44 Lanari J et al.: Liver transplantation versus liver resection for colorectal liver metastasis: a survival benefit analysis in patients stratified according to tumor burden score. Transpl Int 2021; 34(9): 1722-32
Das könnte Sie auch interessieren:
Hepatitis-A-Ausbrüche in den USA
Zwischen 2016 und 2022 kam es in den USA zu einer unerwarteten Häufung von Hepatitis-A-Ausbrüchen. Besonders betroffen waren sozioökonomisch benachteiligte Bevölkerungsgruppen mit ...
Neues aus der Welt der Hepatologie
Kürzlich wurden Arbeiten zu den Risiken nach TIPS-Implantation veröffentlicht und eine neue S3-Leitlinie zu autoimmunen Lebererkrankungen steht nun zur Verfügung. Aktuelles gibt es aber ...
Top-Papers Hepatologie
Ganz im Sinne des Titels der Veranstaltung wurden auch beim diesjährigen Update Gastroenterologie-Stoffwechsel vom 14. bis 16. November 2024 in Innsbruck aktuelle Themen der ...