Sonografisches Screening des Ovarialkarzinoms
Autorinnen:
Dr. med. univ. Sabrina Einig
Assistenzärztin
Frauenklinik
Universitätsspital Basel
PD Dr. med. Gwendolin Manegold-Brauer
Leitende Ärztin
Abteilung gynäkologische Sonographie und Pränataldiagnostik
Universitätsspital Basel
E-Mail: gwendolin.manegold-brauer@usb.ch
Die Prognose des Ovarialkarzinoms ist abhängig vom Tumorstadium. Angesichts dessen stellt sich die Frage nach einer effektiven Früherkennungs- bzw. Screening-Methode. Ein effektives, flächendeckendes Screening könnte sich positiv auf die Früherkennung des Ovarialkarzinoms und somit auf das Überleben von Patientinnen auswirken.
Keypoints
-
Ein Screening für das Ovarialkarzinom mithilfe von Ultraschall und CA125 führt nicht zu einer Senkung der Mortalität.
-
Adnexbefunde können mittels transvaginalen US zuverlässig in Ihrer Dignität eingeschätzt werden.
-
Mithilfe des IOTA-ADNEX-Modells kann das absolute Malignitätsrisiko ermittelt werden.
-
Basierend auf dem absoluten Malignitätsrisiko kann ein Befund in das «ovarian- adnexal reporting and data system (O-RADS)» eingeordnet werden. Zusätzlich liefert O-RADS einen Vorschlag für das weitere Management (Verlaufskontrollen, Experten US, MRI, OP am Tumorzentrum etc.).
Hintergrund
Das Ovarialkarzinom ist das dritthäufigste gynäkologische Karzinom und jenes mit der weltweit höchsten Mortalität. Das Lifetime-Risiko einer Frau, an einem Ovarialkarzinom zu erkranken, liegt schätzungsweise zwischen 1 und 2%. Weltweit werden jedes Jahr 239000 neue Fälle diagnostiziert. 152000 Patientinnen sterben jedes Jahr an dieser Erkrankung.1,2
Bei ca. 30% der Ovarialkarzinome handelt es sich um Typ I epitheliale Läsionen, wie «low grade», seröse, klarzellige, endometrioide und muzinöse Karzinome. Bei diesen Läsionen sind Vorläuferläsionen bekannt (Borderline-Tumoren für «low grade» seröse Karzinome und Endometriose für endometrioide und klarzellige Karzinome). Typ-I-Läsionen weisen einen vergleichsweise langsamen Verlauf auf.3,4 In ungefähr 70% der Fälle, also der deutlichen Mehrheit, handelt es sich um epitheliale Typ-II-Läsionen oder auch «high grade» seröse Karzinome, welche für ihr aggressives Wachstum und ihre hohe Mortalität bekannt sind.5
Die Prognose der Erkrankung ist in Abhängigkeit des Tumorstadiums bei Erstdiagnose sehr unterschiedlich. Beträgt die 5-Jahres-Überlebensrate in den FIGO-Stadien I und II noch 90%, so sinkt sie bei Personen in den Stadien FIGO III und IV auf 10–20%.2
Angesichts dieses immensen Einflusses auf das Überleben stellt sich die Frage nach einer effektiven Früherkennungs- bzw. Screening-Methode für das Ovarialkarzinom. Die Hoffnung wäre, ein flächendeckendes und effektives Screening zu etablieren und so die Früherkennung zu steigern und das Überleben der Betroffenen zu verbessern.
Screening
Hierfür muss man sich die Frage stellen, in welchen Fällen die Einführung eines Screenings flächendeckend sinnvoll ist. Das Ziel eines Screeningprogrammes ist es, die Lebenserwartung der Bevölkerungsgruppe mit erhöhtem Krankheitsrisiko zu verlängern. Um dieses Ziel zu erreichen, muss eine möglichst grosse Anzahl an Personen untersucht werden, um möglichst viele Erkrankte zu entdecken und einer Behandlung zuführen zu können.6
Ein Screening einzuführen, ist unter bestimmten Voraussetzungen sinnvoll. Zum einen muss es sich um ein wichtiges bzw. relevantes Gesundheitsproblem handeln und es muss eine etablierte Behandlungsmöglichkeit geben. Damit verbunden ist die Voraussetzung, dass der natürliche Krankheitsverlauf der Erkrankung gut verstanden sein muss, damit ein guter Screeningtest entwickelt werden kann. Letztlich muss auch der Benefit des Screening- oder Vorsorgeprogrammes höher sein als die dadurch entstehenden Kosten.6,7
Screening-Strategien beim Ovarialkarzinom
Für das Ovarialkarzinom kommen mehrere Screening-Strategien infrage. Hierfür sind bildgebende Verfahren, laborchemische Verfahren mit Tumormarkern und die Kombination beider Methoden denkbar. Zu den bildgebenden Verfahren zur Erkennung von Ovarialtumoren wird allem voran die transvaginale Sonografie verwendet.8 Die Bildgebung mit Magnetresonanztomografie und Computertomografie kommt insbesondere bei fortgeschrittener Erkrankung zum Tragen.
Zusätzlich gibt es verschiedene Biomarker, welche für das Ovarialkarzinom interessant sind, darunter CA125, CA19-9 und CEA. Als Screening-Biomarker ist vor allem CA125 klinisch relevant, da er von «high grade» serösen Ovarialkarzinomen exprimiert wird. In der Vergangenheit wurde ein Cut-off für CA125 von >35IU viel diskutiert.9 CA125 ist jedoch nicht ausreichend spezifisch (z.B. auch bei Endometriose erhöht) und für frühe Tumorstadien und Borderlinetumoren nur wenig sensitiv.10 Es gibt vielversprechende Daten, die zeigen, dass ein longitudinaler Verlauf des CA125 über die Zeit, der sogenannte ROCA («Risk of Ovarian Cancer Algorhythm»), die Detektion von Ovarialkarzinomen deutlich verbessert.11,12
Studienlage
Bisher gab es zu Screening-Strategien für das Ovarialkarzinom einige grosse randomisierte kontrollierte Studien («randomized controlled trials», RCT).
Die PLCO(«prostate, lung, colorectal and ovarian cancer screening trial»)-Studie, eine multizentrische RCT, welche in 10 Studienzentren in den USA durchgeführt wurde, untersuchte 80000 Patientinnen. Bei der einen Hälfte der Frauen wurde ein Screening bestehend aus jährlichem CA125 und transvaginalem Ultraschall für vier Jahre durchgeführt. Bei der anderen Hälfte der Teilnehmerinnen wurde kein Screening durchgeführt. Es zeigten sich in den Ergebnissen der Studie keine Mortalitätsreduktion und keine Unterschiede bzgl. Tumorstadium der Erstdiagnose zwischen den beiden Studiengruppen.13
Die UKCTOCS Studie («UK collaborative trial of ovarian cancer screening») ist die RCT mit dem bisher grössten Kollektiv. Hier wurden um die 200000 Frauen in Grossbritannien untersucht. Verglichen wurden drei Gruppen: Eine Studiengruppe hatte ein multimodales Screening, bestehend aus jährlichem CA125 (kontinuierlich nach ROCA-Algorithmus) kombiniert mit einem jährlichen Ultraschall. Die zweite Gruppe wurde ausschliesslich mit jährlichem Ultraschall gescreent. Die dritte Gruppe hatte kein Screening. Auch hier zeigte sich keine signifikante Reduktion der Mortalität.14
In der «Japanese Shizuka cohort screening study», ebenfalls eine multizentrische RCT, mit 80000 Teilnehmerinnen wurde analog zur PLCO-Studie eine Studiengruppe mit jährlichem Screening (CA125 und Ultraschall) mit einer Kontrollgruppe (kein Screening) verglichen. Hier zeigte sich lediglich ein nicht signifikanter Anstieg von erstdiagnostizierten Ovarialkarzinomen im Stadium FIGO I (63% vs. 38%).11
Die University of Kentucky hat eine prospektive Interventionsstudie durchgeführt, wobei 25000 Teilnehmerinnen mit jährlichem Ultraschall untersucht wurden und die Ergebnisse mit einer Gruppe von ungescreenten Patientinnen an der gleichen Institution verglichen wurden. Hierbei zeigte sich ein signifikanter Anstieg der 5-Jahres-Überlebensrate.15 Eine Limitation der Aussagekraft besteht jedoch aufgrund des Studiendesigns.
Insgesamt muss man also zusammenfassen, dass durch die bisherigen Screening-Strategien keine Reduktion der Mortalität erreicht werden konnte und deswegen keine Empfehlung für ein generelles Screening ausgesprochen werden kann.
Morbidität im Zusammenhang mit den bisherigen Screening-Strategien
Jedes Screening-Verfahren birgt das Risiko von Morbidität aufgrund von falsch positiven Testresultaten und damit verbundenen unnötigen Interventionen. Im Falle des Ovarialkarzinoms entsteht die Morbidität im Wesentlichen durch die perioperativen Risiken aufgrund von Interventionen bei falsch positiven Screening-Tests. In der UKCTOCS-Studie betrug der Anteil an schwerwiegenden Operationskomplikationen bei den «unnötigen» Operationen 3,5%.14 In der PLCO-Studie war der Anteil mit 15% deutlich grösser.13
Auf der anderen Seite bieten falsch negative Screening-Resultate eine falsche Sicherheit. In der UKCTOCS-Studie wurden innerhalb eines Jahres des Screenings 16% der Fälle mit Ovarial-/Tuben- und primären Peritonealkarzinomen in der multimodalen Screening-Gruppe verpasst, in der rein sonografisch gescreenten Gruppe sogar 29%.14
Das Screening in der generellen Bevölkerung durchzuführen, hatte bei denjenigen Frauen mit abnormalen Ergebnissen mit der Notwendigkeit eines Follow-ups einen negativen Einfluss auf die psychische Gesundheit.16 Bei den High-Risk-Patientinnen mit einer auffälligen Familienanamnese war die Akzeptanz der Screening-Untersuchungen deutlich grösser, wenn auch die Limitationen des Screenings nicht immer vollständig verstanden wurden.17
Dignitätseinschätzung und Triagierung von Ovarialbefunden
Im Gegensatz zum sonografischen Screening auf das Ovarialkarzinom bei asymptomatischen Frauen ist die Dignitätseinschätzung von Ovarialbefunden, die aus verschiedenen Gründen entdeckt wurden, klinisch relevant.
Bildgebende Diagnostik erfolgt aus verschiedenen Gründen. Teilweise kommt es zu Zufallsbefunden im Rahmen von Bildgebung von nicht gynäkologischen Krankheitsbildern (z.B. MRT/CT).18 Häufig erfolgt auch ein Ultraschall im Rahmen der gynäkologischen Vorsorgeuntersuchung bei sehr unspezifischen Symptomen oder unklaren Tastbefunden bei der Palpation.
Hinter Ovarialbefunden in der Bildgebung kann sich eine Reihe unterschiedlicher Krankheitsentitäten verbergen. Zu den benignen Befunden gehören funktionelle Zysten, das Corpus luteum, die Extrauteringravidität, eine Saktosalpinx, Paratubarzysten, Zystadenome, Myome, Dermoidzysten, Tubo-Ovarialabszesse, Fibrome u.v.a. Zu den malignen Befunden gehört das Ovarialkarzinom, Borderlinetumoren, aber z.B. auch Lymphome, Keimzelltumoren und Metastasen.
Insgesamt ist es sehr wichtig, solche Befunde richtig zu triagieren, um die potenziell malignen Befunde zu identifizieren und die Patientinnen einer adäquaten weiteren Diagnostik, Therapie und Nachsorge zuführen zu können.1 Engelen et al. zeigten, dass das Überleben von Patientinnen mit Ovarialkarzinomen signifikant verbessert werden konnte, wenn diese durch spezialisierte Gynäkoonkologen operiert wurden.19,20 Umso wichtiger sind also die richtige Triagierung und Erkennen der Patientinnen, die von der Zuweisung an ein gynäkologisches Tumorzentrum profitieren.
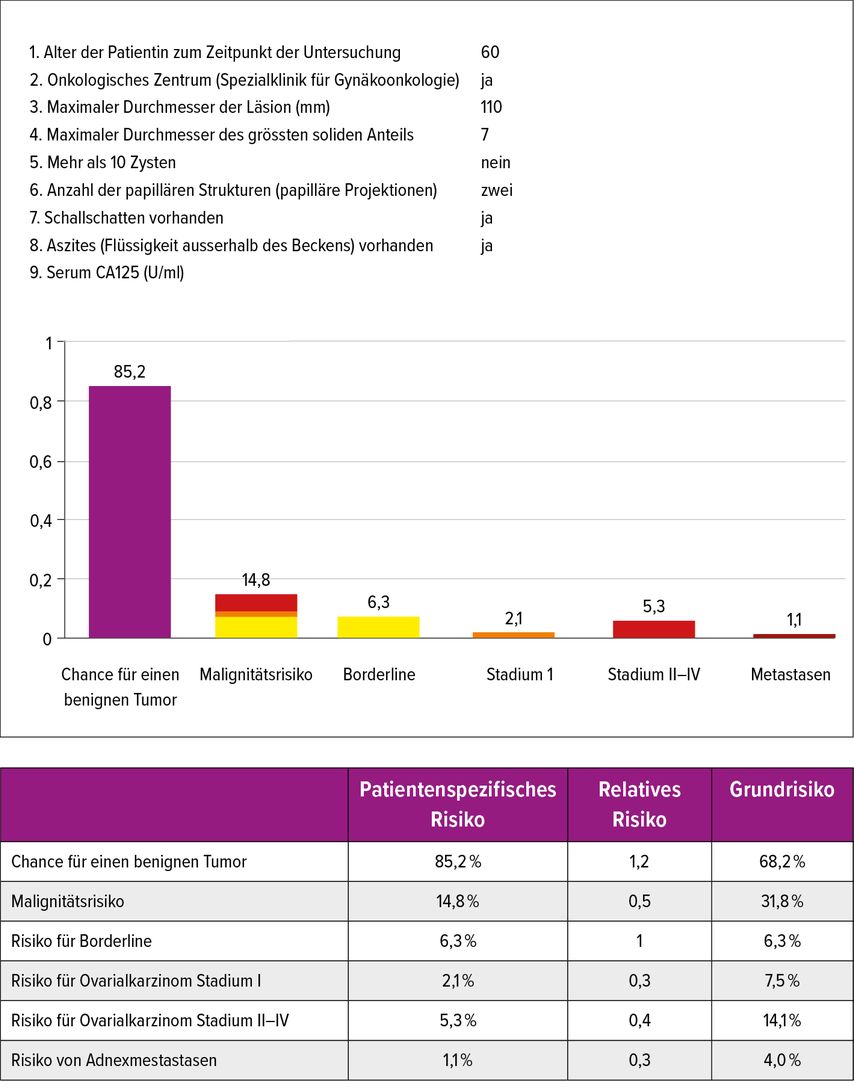
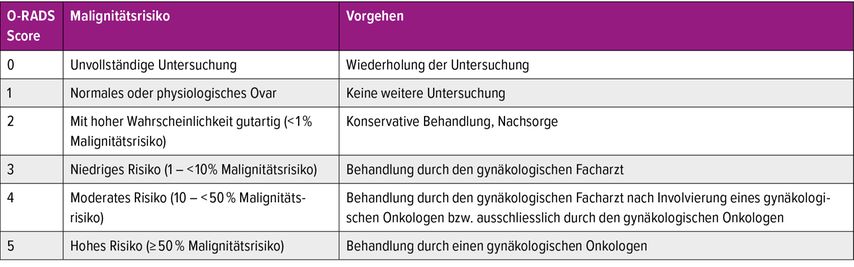
Für die Dignitätseinschätzung von Ovarialbefunden hat die IOTA(«International Ovarian Tumor Analysis»)-Gruppe verschiedene Modelle entwickelt, mit denen das Malignitätsrisiko und die zu erwartende Histologie anhand sonografischer Merkmale zuverlässig abgeschätzt werden kann. Auch wenn die subjektive Einschätzung eines Befundes durch einen Experten weiterhin die beste Diskriminierung bietet, sind die IOTA-Modelle auch bei weniger erfahrenen Untersuchern sehr zuverlässig anwendbar, wenn ein entsprechendes Training zur Nomenklatur stattgefunden hat.21,22 Mithilfe des IOTA-Adnex-Modells, welches sechs sonografische und drei klinische Parameter berücksichtigt, kann das absolute und relative Risiko für Malignität ermittelt werden (Abb.1 und Abb. 2). Basierend auf dem absoluten Malignitätsrisiko erfolgt eine Einordnung in das «ovarian-adnexal reporting and data system (O-RADS)», welches gleichzeitig ein Management vorschlägt (Tab. 1).
Abb. 1: Anhand des IOTA-Adnexmodells kann mittels Eingabe sechs sonografischer und drei klinischer Parameter das absolute und relative Risiko für Malignität ermittelt werden. Nach Eingabe der Parameter auf https://www.iotagroup.org/sites/default/files/adnexmodel/IOTA%20-%20ADNEX%20model.html wird eine grafische Darstellung generiert
Abb. 2: IOTA-Adnex-Modell: 6 Ultraschallkriterien. 1) Maximaler Durchmesser der Läsion, 2) Maximaler Durchmesser des grössten soliden Anteils, 3) Mehr als 10 Zysten («locules»), 4) Anzahl der grössten papillären Strukturen 5) Schallschatten 6) Aszites
Tab. 1: O-RADS-Klassifikation für Adnexbefunde. In Anlehnung an: American College of Radiology Committee on O-RADS™ (Ovarian and Adnexal). O-RADS™ Ultrasound v2022 — Governing Concepts. Verfügbar unter: https://www.acr.org/-/media/ACR/Files/RADS/O-RADS/O-RADS--US-v2022-Assessment-Categories.pdf, American College of Radiology. Stand: 12.04.2023
Literatur:
1 Nash Z and Menon U: Ovarian cancer screening: Current status and future directions. Best Pract Res Clin Obstet Gynaecol 2020; 65: 32-45 2 Campbell S, Gentry-Maharaj A: The role of transvaginal ultrasound in screening for ovarian cancer. Climacteric 2018; 21(3): 221-6 3 Wang S et al.: Clinical analysis of ovarian epithelial carcinoma with coexisting pelvic endometriosis. Am J Obstet Gynecol 2013; 208(5): 413-e1 4 Kurman RJ, Shih IM: The origin and pathogenesis of epithelial ovarian cancer-a proposed unifying theory. Am J Surg Pathol 2010; 34(3): 433 5 Kroeger Jr PT et al.: Pathogenesis and heterogeneity of ovarian cancer. Curr Opin Obstet Gynecol 2017; 29(1): 26 6 Sagan A et al.; World Health Organization: Screening: when is it appropriate and how can we get it right? 2020 7 Andermann A et al.: Revisiting Wilson and Jungner in the genomic age: a review of screening criteria over the past 40 years. Bull World Health Organ 2008; 86(4): 317-9 8 Kaijser J et al.: Imaging techniques for the pre-surgical diagnosis of adnexal tumours. Best Pract Res Clin Obstet Gynaecol 2014; 28(5): 683-95 9 Pinsky PF et al.: Extended mortality results for ovarian cancer screening in the PLCO trial with median 15 years follow-up. Gynecol Oncol 2016; 143(2): 270-5 10 Dochez V et al.: Biomarkers and algorithms for diagnosis of ovarian cancer: CA125, HE4, RMI and ROMA, a review. J Ovarian Res 2019; 12: 1-9 11 Skates SJ et al.: Early detection of ovarian cancer using the risk of ovarian cancer algorithm with frequent CA125 testing in women at increased familial risk–combined results from two screening TrialsOvarian cancer early detection: ROCA in increased risk women. Clin Cancer Res 2017; 23(14): 3628-37 12 Drescher CW et al.: Longitudinal screening algorithm that incorporates change over time in CA125 levels identifies ovarian cancer earlier than a single-threshold rule. J Clin Oncol 2013; 31(3): 387 13 Buys SS et al.: Effect of screening on ovarian cancer mortality: the Prostate, Lung, Colorectal and Ovarian (PLCO) cancer screening randomized controlled trial. JAMA 2011; 305(22): 2295-303 14 Jacobs IJ et al.: Ovarian cancer screening and mortality in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial. Lancet 2016; 387(10022): 945-56 15 van Nagell Jr JR et al.: Ovarian cancer screening with annual transvaginal sonography: findings of 25,000 women screened. Cancer 2007; 109(9): 1887-96 16 Barrett J et al.: Psychological morbidity associated with ovarian cancer screening: results from more than 23000 women in the randomised trial of ovarian cancer screening (UKCTOCS). BJOG 2014; 121(9): 1071-9 17 Lifford KJ et al.: A qualitative study of women’s experiences of familial ovarian cancer screening. Psychooncol 2013; 22(11): 2576-84 18 Liu J, Xu Y, Wang J: Ultrasonography, computed tomography and magnetic resonance imaging for diagnosis of ovarian carcinoma. Eur J Radiol 2007; 62(3): 328-34 19 Engelen MJ et al.: Surgery by consultant gynecologic oncologists improves survival in patients with ovarian carcinoma. Cancer 2006; 106(3): 589-98 20 Engelen MJA et al.: Debulking surgery for ovarian epithelial cancer performed by a gynaecological oncologist improved survival compared with less specialised surgeons: Abstracted from: Giede KC, Kieser K, Dodge J, Rosen B. Who should operate on patients with ovarian cancer? An evidence-based review. Gynecol Oncol 2005; 99: 447-61. Cancer Treat Rev 2006; 32(4): 320-3 21 Van Calster B et al.: Validation of models to diagnose ovarian cancer in patients managed surgically or conservatively: multicentre cohort study. BMJ 2020; 370: m2614 22 Timmerman D et al.: ESGO/ISUOG/IOTA/ESGE Consensus Statement on pre-operative diagnosis of ovarian tumors. Int J Gynecol Cancer 2021; 31(7): 961
Das könnte Sie auch interessieren:
Künstliche Intelligenz in der Brustpathologie
Die Einführung von künstlicher Intelligenz (KI) markiert einen Paradigmenwechsel in der Pathologie – insbesondere in der Brustpathologie. Validierte KI-Tools steigern bereits heute ...
Postpartale Blutung im Fokus
Wenn sich die Sonne über dem Tafelberg erhebt und das goldene Licht über Kapstadt legt, ahnt man kaum, dass sich hier im Oktober 2025 mehr als 8000 Fachpersonen aus über 130 Ländern ...
Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit ...