Liquid Biopsy, NGS, AI auf dem Weg in die klinische Praxis
Bericht:
Mag. Dr. Anita Schreiberhuber
Die personalisierte Medizin – und damit hochspezifische Methoden zur Identifizierung von neuen Targets für zielgerichtete Substanzen – nimmt einen immer bedeutenderen Raum im Bereich der Onkologie ein. Dass dabei die Multidisziplinarität im Sinne der Kooperation einzelner Fachbereiche Basis für ein optimales Patient:innenmanagement liefert, konnte auf der Jahrestagung für Senologie gar nicht oft genug betont werden.
Potenzial der Liquid Biopsy
Die Analyse von ctDNA (zirkulierende Tumor-DNA) mittels Liquid Biopsy (LB) nimmt im Rahmen der Präzisionsonkologie einen zunehmenden Stellenwert ein und bringt das Potenzial mit sich, Targets zu identifizieren, entsprechende zielgerichtete Substanzen zu entwickeln, Therapieentscheidungen zu lenken und Resistenzen/Rezidive frühzeitig zu erkennen.
„Wir alle haben DNA-Fragmente im Blut, diese stammen hauptsächlich aus dem hämatopoetischen System. Bei Krebs befinden sich Tumorfragmente in der Zirkulation. Diese reflektieren die genetische Zusammensetzung des Tumors und können als Surrogatmarker für eine Gewebebiopsie fungieren.1 Dabei dürfte die Menge mit der Tumorlast korrelieren und kann so für das Monitoring genutzt werden“, erklärte Univ.-Prof. Mag. Dr.rer.nat. Ellen Heitzer, D&F Institut für Humangenetik, Medizinische Universität (MU) Graz, die über den Stellenwert der LB in der Diagnostik des Mammakarzinoms (BC) referierte. Was die Menge an ctDNA betrifft, so ist diese bei lokalisierten Tumoren meist niedrig und kann in fortgeschrittenen Stadien 80–90% der gesamten zellfreien DNA ausmachen. Die Variabilität der ctDNA-Level variiert aber nicht nur von Tumor- zu Tumorentität, sondern wird auch durch Faktoren wie Tumor-Microenvironment, Proliferationsrate, Art der Therapie etc. beeinflusst.
Garcia-Murillas et al. haben eine prospektive, multizentrische Studie zur Detektion eines molekularen Rezidivs an 170 Frauen mit frühem Mammakarzinom (EBC) durchgeführt. Diese ist als Landmarkstudie zu werten, was die klinische Validität hinsichtlich der Prognose anbelangt: Die Detektion von ctDNA im Zuge des Follow-ups war in signifikantem Ausmaß mit dem Auftreten eines Rezidivs assoziiert, und dies unabhängig vom EBC-Subtyp (HR: 25,2; p<0,001).2 Suppan et al. haben nicht nur die Korrelation zwischen ctDNA und Outcomes nachgewiesen, sie konnten auch zeigen, wie die Höhe der ctDNA mit dem Therapieansprechen korreliert.3 „Diese Erkenntnisse wurden auch in anderen Studien bestätigt“, ergänzte Heitzer. Als Vorteil der ctDNA-Messung gegenüber einer Biopsie hob sie hervor, dass im Zuge der Tumorevolution neue genetische Alterationen auftreten können, die mittels Biopsie nicht immer nachweisbar sind. So wird auch an der MU Graz immer häufiger vom molekularen Tumorboard ein molekulares Profiling aus der LB angefordert, beispielsweise weil eine HER2-Amplifikation aufgrund von zu wenig Material nicht bioptisch detektiert werden kann.
Als wohl bekannteste Studie zur Stratifizierung von Patienten durch in der LB nachgewiesenen Mutationen, erwähnte Heitzer die offene Phase-IIa-Studie plasmaMATCH, in der Patientinnen mit fortgeschrittenem BC entsprechend den detektierten Mutationen eine zielgerichtete Therapie erhielten. Die Autoren kamen zu dem Schluss, dass diese Vorgangsweise eine ausreichende klinische Validität aufweist, um Eingang in die klinische Routinepraxis zu finden.4
NGS beim Mammakarzinom
Dr. André Oszwald, Klinisches Institut für Pathologie, MU Wien, referierte über den Einsatz von NGS („next-generation sequencing“) im Rahmen der personalisierten Therapie. Das menschliche Genom umfasst ca. 3 Millionen Basenpaare, davon sind nur 1/100 proteincodierend. NGS-Panels untersuchen nur ein Subset an Genen. „Das TSO500, das größte, das in der Routine zum Einsatz kommt, sequenziert 1,5 Basenpaare, selbst darin werden im besten Fall zwei bis drei klinisch relevante Varianten nachgewiesen“, berichtete Oszwald. Allerdings lassen sich NGS-Untersuchungen auf einfache Weise in großer Zahl gemeinsam durchführen. Aus diesem Grund empfiehlt die ESMO (European Society of Medical Oncology) PMWG (Precision Medicine Working Group), dass sie in Schwerpunktzentren angeboten werden sollen, um so den Patientinnen Zugang zu innovativen Therapien zu ermöglichen.5 „Wir haben an der MU Wien als großes Zentrum den logistischen Vorteil, dass wir viele Untersuchungen in einem Lauf machen können und dafür nur eine Person benötigen“, berichtete Oszwald. Ergänzend zu den Empfehlungen zum NGS und nachdem das Thema immer relevanter wird, hat die ESMO auch eine Übersichtsarbeit für Onkologen publiziert. Darin werden praktische Angaben zur Interpretation von NGS-Sequenzierungsbefunden gegeben, wobei auch die Relevanz der interdisziplinären Kooperation zwischen Molekularpathologen, Tumorbiologen und Klinikern hervorgehoben wird.6
Um NGS-gelenkt zielgerichtete Therapien zu verabreichen, gibt es einerseits die sog. „Umbrella-Trials“, andererseits die „Basket-Trials“. Während bei Umbrella-Trials Karzinome ein- und derselben Entität auf das Vorliegen definierter Mutationen untersucht und dementsprechend zielgerichtete Substanzen verabreicht werden, ist es bei Basket-Trials genau umgekehrt: Diverse Tumorentitäten werden auf das Vorliegen einer definierten Mutation gescreent und bei Nachweis dieser mit einer entsprechenden zielgerichteten Therapie behandelt.7
Betreffend das BC berichtete Oszwald: „Wir kennen inzwischen viele Gene, deren pathogene Mutationen mit einem höheren Risiko für die Entwicklung von BC assoziiert ist. Allgemein ist es aber so, dass die Ergebnisse, die wir produzieren, oft die klinischen Erfordernisse um ein Vielfaches übertreffen – nur ein kleiner Teil der nachgewiesenen Mutationen lenkt auch Therapieentscheidungen.“
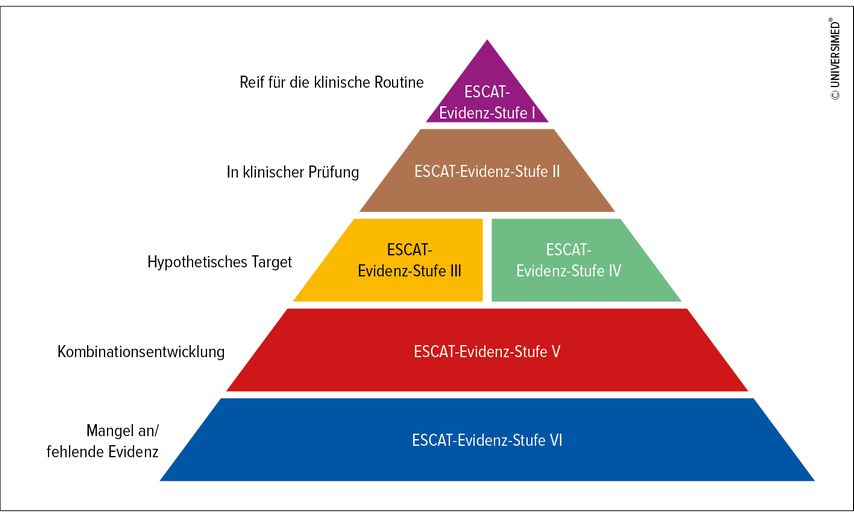
Um die Frage zu beantworten, welche onkogenen Varianten am relevantesten in Hinsicht auf eine Therapie sind, hat die ESMO das sog. ESCAT(ESMO Scale for Clinical Actionability of Molecular Targets)-Schema entwickelt, bei dem eine Einteilung nach Priorisierung in 6 Stufen vorgenommen wurde: Stufe I umfasst Targets, die bereits in die klinischen Routineentscheidungen einfließen können und für die bei Nachweis die Verabreichung einer spezifischen zielgerichteten Substanz empfohlen wird, Stufe II umfasst in klinischer Prüfung befindliche Targets, die vermutlich eine Patientenpopulation definieren, die von einer zielgerichteten Therapie profitieren, wozu aber noch weitere Daten erforderlich sind. Die Stufen III und IV stehen für hypothetische Targets, wobei bei Targets der Stufe III ein klinischer Benefit bei anderen Tumorentitäten oder ähnlichen molekularen Targets demonstriert wurde und bei Targets der Stufe IV präklinische Evidenz vorliegt. Stufe V umfasst Targets, für die Evidenz für eine relevante antitumorale Aktivität vorliegt, die sich aber nicht in einen bedeutsamen klinischen Benefit bei Gabe als Monotherapie übersetzen lässt, aber für die Entwicklung von Substanzen spricht, die an Co-Targets ansetzen. Für Targets, die der Stufe VI zugeordnet sind, gibt es keinerlei Evidenz für eine „actionability“ (Abb. 1).8
Abb. 1: ESCAT(ESMO Scale for Clinical Actionability of Molecular Targets)-Schema der ESMO. Nach Matteo J et al.8
AI – die Zukunft in der Mammadiagnostik?
Auch Assoc.-Prof. Priv.-Doz. Dr. Pascal A.T. Baltzer, Univ.-Klinik für Radiologie und Nuklearmedizin, MU Wien, der über die AI („artificial intelligence“) im Rahmen der Mammadiagnostik referierte, betonte ebenfalls die Relevanz der Interdisziplinarität und beleuchtete einerseits die Bedürfnisse der Patientin, andererseits jene des/der Radiolog:in; für die Patientin sind eine gute und frühzeitige Diagnose, schnelle Terminvereinbarung und rascher Erhalt von verständlich formulierten Befunden sowie das Gefühl der Wertschätzung und Sicherheit relevant. Für den/die Radiolog:in sind ein strukturiertes Arbeitsfeld und eine gute IT-Infrastruktur wichtig. Baltzer griff auch die Frage auf, ob denn tatsächlich jede Frau ein regelmäßiges Screening benötigt oder ob eine Risikostratifizierung und Vorselektion getroffen werden können, um Frauen zu identifizieren, bei denen auf ein reguläres Screening verzichtet werden kann. „Vorselektion halte ich für ein absolutes Muss und hier wird AI eine Rolle spielen“, konstatierte Baltzer. Zur Präzision in der Diagnostik liegen bereits viele Daten vor. So konnte bereits gezeigt werden, dass durch Kombination der Erfassung der Brustdichte mit AI das Risiko für die Entwicklung von Intervallkarzinomen vorhergesagt werden kann.9 Yoon et al. haben ein systematisches Review durchgeführt, in dem sie zeigen konnten, dass eine Standalone AI zumindest genauso gut ist wie eine digitale Mammografie und eine digitale Tomosynthese der Brust.10
Bezüglich der Herausforderungen der AI erwähnte Baltzer u.a. das sog. „automation bias“ – d.h., der Mensch neigt dazu, automatisierten Systemen blind zu folgen. Dem kann durch Maßnahmen wie gezieltes Anwendertraining und Transparenz der AI-Algorithmen entgegengewirkt werden. AI birgt aber natürlich auch ein enormes Potenzial in sich – sie reduziert potenziell die Arbeitslast und verbessert die Performance von Erstbefunden, was auch die Frage des Einsatzes von AI als Zweitbefundung aufwirft. In der Praxis ist eine unzureichende Bildqualität von Mammografien eine mögliche Ursache für falsch negative Befunde, sodass AI sowohl zur Vermeidung von falsch negativen als auch falsch positiven Befunden eingesetzt werden kann. Insgesamt gibt es viele mögliche Anwendungen der AI in der klinischen Praxis und Baltzer ist sicher, dass AI zunehmend mehr den klinischen Alltag durchdringen wird.
Wie sieht Screening 2030 aus?
Im Anschluss an die Vorträge über bildgebende Mammadiagnostik wurde eine Expertendiskussion darüber geführt, wo der Weg im Screening vermutlich hinführen wird. Dabei kam auch die Thematik der zunehmenden Präzision in der bildgebenden Diagnostik auf. Univ.-Doz. Dr. Franz Frühwald, Radiologische Gruppenpraxis, St. Pölten, erachtete es als problematisch, dass in absehbarer Zeit bereits Karzinome in der Größe zwischen 0,1 und 1mm nachweisbar sein werden. Diese können nicht operiert werden, werden aber bei den betroffenen Patientinnen zu einer hohen Verunsicherung führen und werfen die Frage nach einem Cut-off auf, der noch eine Operabilität zulässt. In seiner Forderung nach einer pragmatischen Herangehensweise wurde er von seinem deutschen Kollegen Prof. Dr. Matthias Dietzel, Radiologisches Institut, Universitätsklinikum Erlangen, bestätigt.
Ein zentrales Thema war auch die unterschiedliche Handhabung des Screenings zwischen Österreich und Deutschland: In Deutschland finden die Screeninguntersuchungen in einem eigenen Zentrum statt, wo Radiolog:innen ca. 250 Mammografien in einer Stunde befunden müssen. Eine Frau hat im Rahmen des Screenings praktisch keine Möglichkeit, eine MRT-Untersuchung zu erhalten – es sei denn, sie ist bereit, selbst die Kosten dafür zu tragen. Im Gegensatz dazu wurde die Situation in Österreich als ideal erachtet: Es besteht kein Versorgungsproblem, weil alle Patientinnen, deren Befund als suspekt erachtet wird, problemlos unter Kostenübernahme durch die Gesundheitsversicherung einer MRT-Untersuchung zugeführt werden können. Auf die Frage des Moderators, Univ.-Prof. Dr. Michael Fuchsjäger, Klinische Abteilung für allgemeine radiologische Diagnostik, MU Graz, was sich nach Meinung der Experten bis 2030 im Screening geändert haben wird, antwortete Dietzel: „Ich glaube, dass das österreichische Screeningprogramm ein großes Potenzial für die Risikostratifizierung aufweist. Nachdem 2030 nicht so weit weg ist, kann ich mir vorstellen, dass wir dann tatsächlich schon beurteilen können, ob es Frauen gibt, die tatsächlich kein Screening benötigen. Ob diese Erkenntnisse dann de facto auch schon in die klinische Entscheidung einfließen werden, wird sich weisen. Ich bin davon überzeugt, dass 20% der Frauen nur ein weitmaschiges oder gar kein Screening benötigen und vielleicht können wir jene Frauen, bei denen ein Screening erforderlich ist, noch besser selektionieren, denn es ist schon klar, dass nicht alle Frauen mit dichtem Brustgewebe Brustkrebs entwickeln.“ Nicht zuletzt wurde auch im Rahmen der Diskussion der Wunsch nach einer Intensivierung der Kooperation zwischen den einzelnen Fachdisziplinen geäußert, da die BC-Behandlung definitiv ein multidisziplinäres Konzept ist.
Quelle:
Jahrestagung der Österreichischen Gesellschaft für Senologie (ÖGS), 8.–9. September 2023, Wien
Literatur:
1 Moser T et al.: Bridging biological cfDNA features and machine learning approaches. Trend Genet 2023; 39(4): 285-307 2 Garcia-Murillas I et al.: Assessment of molecular relapse detection in early-stage breast cancer. JAMA Concol 2019; 5(10): 1473-8 3 Suppan C et al.: Untargeted assessment of tumor fractions in plasma for monitoring and prognostication from metastatic breast cancer patients undergoing systemic treatment. Cancers (Basel) 2019; 11(8): 1171 4 Turner NC et al.: Circulating tumour DNA analysis to direct therapy in advanced breast cancer (plasmaMATCH): a multicentre, multicohort, phase 2a, platform trial. Lancet Oncol 2020; 21(10): 1296-1308 5 Mosele F et al.: Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Ann Oncol 2020; 31(11): 1491-1505 6 Schmid S et al.: How to read a next-generation sequencing report-what oncologists need to know. ESMO Open 2022; 7(5): 100570 7 http://healthscientific.net/ (Zugriff: 27. September 2023) 8 Mateo J et al.: A framework to rank genomic alterations as targets for cancer precision medicine: the ESMO Scale for Clinical Actionability of molecular Targets (ESCAT). Ann Oncol 2018; 29(9): 1895-1902 9 Wanders AJT et al.: Interval cancer detection using a neural network and breast density in women with negative screening mammograms. Radiology 2022; 303(2): 269-75 10 Yoon JH et al.: Standalone AI for breast cancer detection at screening digital mammography and digital breast tomosynthesis: A systematic review and meta-analysis. Radiology 2023; 307(5): e222639
Das könnte Sie auch interessieren:
Welche Risiken sind zu erwarten?
Die präventive Mastektomie wird vor allem bei genetischer Vorbelastung, z.B. bei BRCA1/2-Mutationen, erwogen. Der Eingriff kann das Brustkrebs-Erkrankungsrisiko deutlich reduzieren, aber ...
Pharmakogenetik zur Vermeidung unerwünschter Arzneimittelwirkungen
Alle praktizierenden Mediziner:innen hatten schon einmal mit unerwünschten Arzneimittelwirkungen zu kämpfen. Wir gehen davon aus, dass diese Nebenwirkungen ein unangenehmer Teil von ...
AI in der Reproduktionsmedizin
Kein Thema bewegt derzeit die Menschen mehr als künstliche Intelligenz (AI – „artificial intelligence“). Wiewohl in der Behandlung des unerfüllten Kinderwunsches in den letzten ...