Tumoren der Leber und der Gallenwege
Bericht:
Dr. Corina Ringsell
Die Inzidenz von malignen Lebertumoren ist in den vergangenen Jahrzehnten weltweit angestiegen.1 In der westlichen Welt sind Leberfibrosen und -zirrhosen aufgrund von chronischen HCV/HBV-Infektionen, Alkoholabusus, MASLD (metabolische dysfunktions-assoziierte steatotische Leberkrankheit) und MASH (metabolische dysfunktionsassoziierte Steatohepatitis) die Hauptrisikofaktoren.1,2 Expert:innen des CCC Vienna, MedUni Wien/AKH Wien, diskutierten Fragen zu Screening, Diagnostik und Therapie.
Screening für alle? Was ist sinnvoll?
Welche Patient:innen ein Screening (einmalig zur Früherkennung) bzw. eine Surveillance (Untersuchung in regelmäßigen Abständen) erhalten sollten, erläuterte Ap. Prof. PD DDr. med. univ. et scient. med. Mattias Mandorfer, Universitätsklinik für Innere Medizin III, MedUni Wien/AKH Wien.
Laut den EASL Clinical Practice Guidelines wird allen Patient:innen mit einer Leberzirrhose eine Surveillance für ein hepatozelluläres Karzinom (HCC), zum Beispiel alle sechs Monate, empfohlen. Ausgenommen sind Personen mit einem hohen Risiko, an einer anderen Krankheit zu sterben, und Patient:innen, denen keine kurative HCC-Therapie angeboten werden kann, etwa Patient:innen mit einer Child-Pugh-Zirrhose Klasse C, die nicht für eine Lebertransplantation geeignet sind.2 Ist jedoch eine Therapie möglich, so sollten alle sechs Monate eine Ultraschalluntersuchung und die Bestimmung des Alpha-Fetoproteins (AFP) erfolgen.1
Diagnostik fokaler Leberläsionen
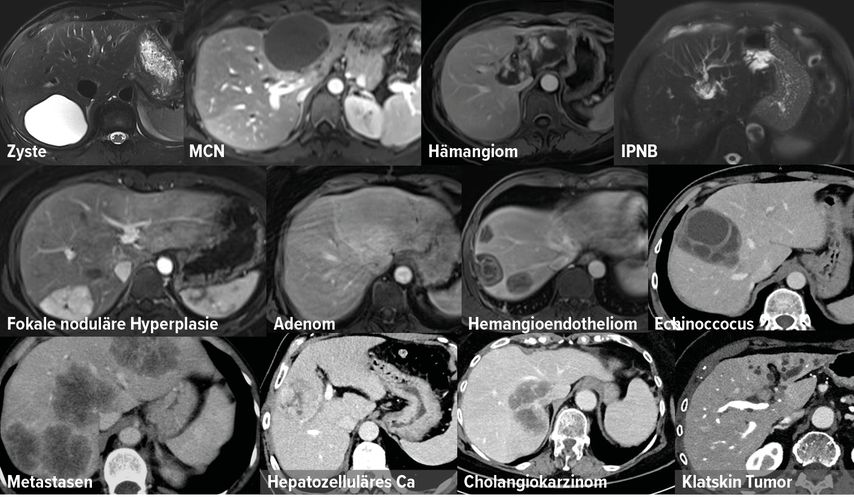
PD DDr. Ulrika Asenbaum, Universitätsklinik für Radiologie und Nuklearmedizin, MedUni Wien/AKH Wien, zeigte, dass es eine Vielzahl von fokalen Leberläsionen gibt (Abb.1). Die Inzidenz steige an, da mehr sonografische Untersuchungen, auch im niedergelassenen Bereich, vorgenommen würden, erklärte sie. Aufgabe der Radiolog:innen sei es, maligne von gutartigen Läsionen zu unterscheiden.
Werden im Ultraschall Leberläsionen entdeckt, dann wird eine Schnittbildgebung empfohlen, in der Regel eine CT, bei unklarem Befund auch eine MRT mit/ohne Kontrastmittel.3 Dazu werden entweder extrazelluläre oder hepatospezifische Kontrastmittel eingesetzt. Letztere werden in die Hepatozyten aufgenommen und anschließend biliär ausgeschieden. So lassen sich die Leberzellen und ihre Funktionsfähigkeit darstellen.4 Sinnvoll ist dies beispielsweise in der Unterscheidung eines Adenoms von einer fokalen nodulären Hyperplasie (FNH) und der Detektion von Lebermetastasen. Dabei hat eine MRT mit Gadolinium-EOB-DTPA mit 91–97% die höchste Sensitivität (vs. MRT alleine 86–93%).5
Leberläsionen detektiert – die nächsten Schritte
Wurde eine Läsion in der Leber entdeckt, hilft die molekularpathologische Untersuchung bei der Klassifizierung. Warum diese wichtig ist, erklärte Dr. Behrang Mozayani, FRCPath, Klinisches Institut für Pathologie, MedUni Wien/AKH Wien.
Die Adenome seien bereits klassifiziert und im Klinischen Institut für Pathologie werde jedes Adenom molekulargenetisch untersucht, um das Risiko einer malignen Entartung einschätzen zu können, sagte er. Am häufigsten sind inflammatorische Adenome (40–50%), die oft eine IL6ST/STAT3-Mutation aufweisen; 10% sind zusätzlich β-Catenin-mutiert, was das Entartungsrisiko steigert, wobei Mutationen des Exons3 das höchste Risiko bergen.6
Beim HCC ist in 60% der Fälle die TERT-Promoterregion mutiert. Weitere häufige Mutationen betreffen TP53, den β-Cateninpfad und viele mehr, wobei meist eine Akkumulation von Mutationen zur Tumorentstehung führt.6 Hinweise, dass bestimmte HCC-Subtypen beispielsweise schlechter auf Immuntherapien, dafür besser auf Tyrosinkinase-Inhibitoren ansprechen, seien noch nicht validiert, sagte der Pathologe. Noch könne dies nicht in die Therapieentscheidung einfließen, doch die Hoffnung sei, dass es in Zukunft zu individualisierteren Therapieentscheidungen führen könne, betonte er.
Anders sieht es beim cholangiozellulären Karzinom (CCA) aus. Hier sind Lokalisation (intrahepatisch, perihilär) und Histologie („small-duct type“, „large-duct type“) von Bedeutung. Intrahepatische Tumoren (iCCA) gehören fast ausschließlich zum „small-duct type“, während die perihilären Tumoren (pCCA) vom „large-duct type“ sind. Beide haben unterschiedliche Mutationsprofile: Während beim „small-duct type“ die häufigsten Mutationen IDH1/2 (ca. 20%), BAP1 (ca. 13%) und FGFR2 (10–20%) betreffen, sind es beim „large-duct type“ KRAS, SMAD4 und TP53.7 Therapierelevant ist auch die HER2/neu-Amplifikation, die bei pCCA häufiger vorkommt als bei iCCA.8
Therapie des HCC
Welche Therapieoptionen es für das HCC gibt, beschrieb PD Dr. med. univ. et scient. med. Bernhard Scheiner, Universitätsklinik für Innere Medizin III, MedUni Wien/AKH Wien. Die Besonderheit beim HCC sei, dass rund 90% der Betroffenen zusätzlich zum Tumor auch eine (meist) fortgeschrittene Leberkrankheit hätten, sagte er. Daher beeinflusse die Leberfunktion die Prognose ebenso wie die Tumorbiologie.9 Leider erhielten nur etwa 25% der Patient:innen die Diagnose in einem Stadium, in dem eine kurative Therapie (Resektion, Ablation, Transplantation) möglich sei, bemängelte er.
Ein weiteres Problem ist das Rezidivrisiko nach einer kurativen Resektion/Ablation: Es liegt nach drei Jahren bei rund 50%, nach fünf Jahren bei etwa 70%.10 Um das Risiko zu senken, untersuchten D’Alessio et al. die neoadjuvante Therapie mit Immuncheckpoint-Inhibitoren vor der Tumorresektion. Es zeigte sich, dass Patient:innen mit einem guten Ansprechen auf diese Behandlung auch ein signifikant längeres rezidivfreies Überleben hatten.11 In diesem Zusammenhang wies Scheiner darauf hin, dass derzeit auch an drei Zentren in Österreich* eine entsprechende Studie läuft, deren Rekrutierung gerade abgeschlossen wurde. (https://clinicaltrials.gov, NCT05908786)
Lebertransplantation
Der Vorteil einer Transplantation ist, dass der Tumor und die zugrunde liegende Leberkrankheit beseitigt werden. Wichtig ist die Auswahl geeigneter Patient:innen nach den Mailand-Kriterien (1 Tumor <5cm oder ≤3 Tumoren <3cm) ohne Metastasierung oder Makrogefäßinvasion.12 Dann können 5-Jahres-Überlebensraten von 60–70% und niedrige Rezidivraten (10–15%) erreicht werden.13
Lokoregionäre Therapien
Dazu zählen Ablation, transarterielle Chemoembolisation (TACE) und transarterielle Radioembolisation (TARE/SIRT). Diese sind für Patient:innen im Intermediärstadium (multifokales HCC mit erhaltener Leberfunktion, ohne Gefäßinvasion, ohne Metastasen) geeignet.9 In den Phase-III-Studien EMERALD-1 und LEAP-012 wurde die TACE mit jeweils einer anderen Immuntherapiekombination gegen TACE plus Placebo getestet. In beiden Studien konnte die Kombination mit Immuntherapie das progressionsfreie Überleben (PFS) signifikant verlängern. Die Daten für das Gesamtüberleben (OS) werden noch erwartet.14
Systemische Erstlinientherapie
Für das HCC im fortgeschrittenen Stadium (Gefäßinvasion oder Metastasen) sind inzwischen drei hocheffektive Immuntherapiekombinationen zugelassen: Atezolizumab/Bevacizumab, Tremelimumab/Durvalumab und aktuell Ipilimumab/Nivolumab. Alle drei konnten das OS im Vergleich zu den Standardtherapien signifikant verlängern.15,16
Für Patient:innen, die aus verschiedenen Gründen keine Immuntherapie erhalten können, etwa bei schwerer Autoimmunkrankheit oder nach Organtransplantation, stehen mit den Tyrosinkinase-Inhibitoren (TKI) Lenvatinib und Sorafenib ebenfalls wirksame systemische Erstlinientherapien zur Verfügung.2
Grundsätzlich sei es wichtig, neu diagnostizierte Patient:innen möglichst rasch an ein spezialisiertes Zentrum zu überweisen, betonte Scheiner.
Therapie des fortgeschrittenen CCA
Assoc. Prof. PD Dr. Gerald Prager, Universitätsklinik für Innere Medizin I, MedUni Wien/AKH Wien, befasste sich mit der systemischen Therapie des fortgeschrittenen CCA. Bei nicht resektabler oder metastasierter Krankheit müsse unverzüglich ein molekulares Profil erstellt werden, betonte er. Während man auf die Ergebnisse warte, sollte eine systemische Therapie mit Cisplatin, Gemcitabin und einem Checkpoint-Inhibitor (Pembrolizumab, Durvalumab) eingeleitet werden.17
Sind die Treibermutationen des Tumors identifiziert, stehen verschiedene Therapieregime zur Verfügung. Bei FGFR2-Fusionen oder -Rearrangements sind im lokal fortgeschrittenen oder metastasierten Stadium und Progress nach mindestens einer systemischen Therapie die FGFR-Inhibitoren Pemigatinib und Futibatinib zugelassen.17
Liegt eine IDH1-Mutation vor, kann bei Progress nach mindestens einer systemischen Therapie gemäß Leitlinie Ivosidenib eingesetzt werden.17
Für BRAF-V600-E-Mutationen gibt es Daten für ein gutes Ansprechen auf die Kombination aus dem BRAF-Inhibitor Dabrafenib und dem MEK-Inhibitor Trametinib.18
Bei HER2/neu-Amplifikationen konnte in der Open-Label-Phase-IIb-Studie HERIZON-BTC-01 mit dem bispezifischen Antikörper Zanidatamab bei rund 68% der Patient:innen eine Reduktion der Tumorlast erzielt werden.19
Leberchirurgie
Univ.-Prof. Dr. Klaus Kaczirek, Universitätsklinik für Allgemeinchirurgie, MedUni Wien/AKH Wien, informierte über die Möglichkeiten und Limitationen der Leberchirurgie. In der Bildgebung müsse bereits beurteilt werden, ob eine R0-Resektion technisch möglich sei. Zudem müsse ausreichend Lebergewebe übrig bleiben, um eine gute Leberfunktion zu gewährleisten, sagte er. Sollte das Restlebervolumen bzw. die zu erwartende Funktion nicht ausreichen, gibt es Verfahren zur präoperativen Vergrößerung der Restleber wie die Pfortaderembolisation, kombinierte Pfortader- und Lebervenenembolisation (Lebervenendeprivation) und zweizeitige Leberresektionen. Oft werde die Resektion intraoperativ mit einer Ablation kombiniert, um nicht betroffenes Leberparenchym zu erhalten und mehr Patient:innen eine kurative Behandlung anbieten zu können, erklärte Kaczirek. Sind alle drei Lebervenen, beide Pfortaderäste oder beide Leberarterien vom Tumor infiltriert, gelte allgemein eine Resektion als nicht mehr möglich. Allerdings gibt es auch in diesen Situationen Techniken, die eine Resektion ermöglichen. Dazu wird die Leber komplett ausgeklemmt und bei Klemmzeiten über einer Stunde auch mit einer hypothermen Präservationslösung gespült. So können auch aufwendige Gefäßrekonstruktionen innerhalb der Leber durchgeführt werden.
Robotische Leberchirurgie
Ap. Prof. PD Dr. Christoph Schwarz, Universitätsklinik für Allgemeinchirurgie, MedUni Wien/AKH Wien, ging auf die robotische Leberchirurgie ein. Vorteile seien unter anderem ein geringerer Blutverlust, weniger Konversionen zur offenen Operation, die präzisere Feinmotorik und mehr Freiheitsgrade, da die Systeme in alle Richtungen gedreht werden können. So seien auch Tumoren in schwierigen Lokalisationen besser erreichbar, sagte er.20,21
Ein Nachteil seien die hohen Kosten, sagte Schwarz. Vergleiche man allerdings die gesamten (Folge-)Kosten einer offenen mit einer robotischen Operation, so sei Letztere günstiger, da weniger Bluttransfusionen benötigt würden, die Spitalsaufenthalte sowie die intensivmedizinische Behandlung kürzer seien und es seltener zur erneuten Hospitalisierung komme, betonte er.22
Weitere interessante Vorträge behandelten die Rolle der interventionellen Radiologie, der Ernährungstherapie und des Mikrobioms. Insgesamt zeigte der Abend, dass eine Vielzahl an medizinischen und therapeutischen Berufsgruppen zusammenarbeiten muss, um Patient:innen mit Leberzirrhose und -tumoren optimal zu betreuen.
Literatur:
1 The Global Cancer Observatory 2021; https://gco.iarc.fr 2 EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2025; 82: 315-74 3 ACG Clinical Guideline: Focal liver lesions. Am J Gastroenterol 2024; 119(7): 1235-71 4 Choi Y et al.: Br J Radiol 2016; 89(1058): 20150666 5 Choi SH et al.: J Magn Reson Imaging 2018; 47(5): 1237-50 6 Nault JC et al.: Nat Rev Gastroenterol Hepatol 2022; 19(11): 703-16 7 EASL-ILCA Clinical Practice Guidelines on the management of intrahepatic cholangiocarcinoma. J Hepatol 2023; 79: 181-208 8 Mertens JC et al.: Biochim Biophys Acta Mol Basis Dis 2018; 1864(4 Pt B): 1454-60 9 Reig M et al.: J Hepatol 2022; 76(3): 681-93 10 Lim KC et al.: Br J Surg 2012; 99(12): 1622-9 11 D’Alessio A et al.: J Clin Oncol 2024; 42 (Suppl 3): Abstr. #506 12 Mazzaferro V et al.: N Engl J Med 1996; 334(11): 693-9 13 Lai Q et al.: Front Oncol 2022; 12: 877107 14 D‘Alessio A, Rimassa L: Med 2025; 6(3): 100635 15 Foy V et al.: Curr Oncol 2023; 30(9): 8665-85 16 Galle PR et al.: J Clin Oncol 2024; 42(Suppl 17): Abstr. #LBA4008 17 S3-Leitlinie „Diagnostik und Therapie des Hepatozellulären Karzinoms und biliärer Karzinome“ (2024), AWMF-Registernummer: 032-053OL 18 Subbiah V et al.: Lancet Oncol 2020; 21(9): 1234-43 19 Pant S et al.: J Clin Oncol 2023; 41(Suppl 16): Abstr. #4008 20 Liu Q et al.: Ann Surg 2023; 278(6): 969-75 21 Krenzien F et al.: Ann Surg 2024; 279(2): 297-305 22 Hawksworth J et al.: Surg Endosc 2025; 39(3): 2136-46
* Universitätsklinik für Innere Medizin III, MedUni Wien/AKH Wien; Onkologisches Zentrum, Klinik Favoriten, Wien; Klinikum Klagenfurt am Wörthersee
Das könnte Sie auch interessieren:
Hepatitis-A-Ausbrüche in den USA
Zwischen 2016 und 2022 kam es in den USA zu einer unerwarteten Häufung von Hepatitis-A-Ausbrüchen. Besonders betroffen waren sozioökonomisch benachteiligte Bevölkerungsgruppen mit ...
Neues aus der Welt der Hepatologie
Kürzlich wurden Arbeiten zu den Risiken nach TIPS-Implantation veröffentlicht und eine neue S3-Leitlinie zu autoimmunen Lebererkrankungen steht nun zur Verfügung. Aktuelles gibt es aber ...
Top-Papers Hepatologie
Ganz im Sinne des Titels der Veranstaltung wurden auch beim diesjährigen Update Gastroenterologie-Stoffwechsel vom 14. bis 16. November 2024 in Innsbruck aktuelle Themen der ...