Therapie des Morbus Crohn: Biologikabehandlung optimieren
Bericht:
Dr. Corina Ringsell
Redaktorin
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Prof. Dr. med. Iris Dotan, Rabin Medical Center, Petah Tikva, und Universität Tel Aviv (Israel), zeigte im Rahmen des 9. Postgraduate Course des IBDnet Möglichkeiten auf, wie die Biologikatherapie bei Morbus Crohn (MC) optimiert werden kann.
Keypoints
-
Bei primärem Nichtansprechen und Verlust des Ansprechens kann das Messen der Serumspiegel helfen, die Anti-TNFα- Therapie zu verbessern.
-
Nach der Induktion und zumindest einmal während der Erhaltungstherapie sollte ein proaktives Monitoring der Wirkstoffspiegel im Serum erfolgen.
-
Eine optimierte Anti-TNFα-Monotherapie ist eine mögliche Alternative zur Kombination der Anti-TNFα- mit einer Immunmodulatortherapie.
-
Es gibt Hinweise auf eine Korrelation zwischen dem Talspiegel von Biologika und dem klinischen und endoskopischen Ansprechen.
-
Zur Therapieoptimierung gehört deshalb auch die Messung der Talspiegel. Dies gilt für Infliximab, Adalimumab, Ustekinumab, weniger für Vedolizumab.
-
Die Kombination von Biologika könnte in Zukunft ein Weg zur Optimierung sein.
Wenn man die Therapie chronisch-entzündlicher Darmkrankheiten (CED) optimieren und personalisieren wolle, dann müsse man intelligenter behandeln, also eine Vorhersage treffen, wer mit welchem Medikament besser versorgt sei, erklärte Dotan. Man müsse die Therapie früher beginnen, die biochemische und endoskopische Verbesserung anstreben und effektiver behandeln. Das heisse, dass man sich damit beschäftige, was die Patient:innen tatsächlich bekommen, sagte sie.
Warum Therapieoptimierung?
Dotan betonte, dass die Optimierung sich auf jeden Teil des Medikamentenzyklus bezieht – von der Wahl des Medikaments über die Induktion und die Erhaltung bis hin zu der Frage, wie man den Verlust des Ansprechens, den viele Patient:innen erleben, verhindern und bewerten kann. So gebe es zum Beispiel die Anti-TNFα-Antikörper seit etwa 25 Jahren, doch erst nach etwa zehn Jahren habe man erkannt, dass es hinsichtlich ihres Einsatzes einen ungedeckten Bedarf gibt. Dazu zählt unter anderem, dass ein Teil der Patient:innen primär nicht auf die Medikamente anspricht, sowie der Verlust des Ansprechens. Ausserdem gebe es Patient:innen, die zwar auf die Therapie ansprächen, aber keine Remission erreichten. Hier müsse man sich fragen, was man besser machen könne, sagte Dotan. Darüber hinaus versuche man, Nebenwirkungen zu minimieren und kosteneffizient zu sein.
Um klinisch relevante Verbesserungen zu erzielen, sei eine höhere Biologikaexposition erforderlich, damit höhere Wirkstoffspiegel erreicht würden, erklärte sie.1 Hier kommen Pharmakokinetik und Pharmakodynamik monoklonaler Antikörper ins Spiel sowie Faktoren, die die Pharmakokinetik beeinflussen. Dazu zählen bei Anti-TNFα-Antikörpern unter anderem das Auftreten von Antikörpern gegen das Medikament, niedrige Albuminspiegel und hoher BMI.2,3 Daher sei es wichtig, frühzeitig die Wirkstoffspiegel zu bestimmen, um sicherzugehen, dass die Patient:innen auch tatsächlich von dem Medikament profitieren, so Dotan. Dabei sind höhere Induktionsdosen der Standarddosierung nicht unbedingt überlegen, wie die Studie SERENE CD mit Adalimumab bei MC-Patient:innen zeigte.4
Was tun bei Anti-Drug-Antikörpern?
Anti-Drug-Antikörper (ADA) können entstehen, wenn Patient:innen nur unregelmässig behandelt werden, zum Beispiel, wenn das Medikament aufgrund einer Krankheit abgesetzt wurde, auf Reisen nicht genommen wurde etc. Auch bei subtherapeutischen Serumspiegeln oder bei Patient:innen mit rascher Elimination der Substanzen zwischen den einzelnen Medikamentengaben können ADA auftreten. Ein höheres Risiko besteht auch, wenn es bereits früher zu ADA gegen eine Anti-TNFα-Therapie gekommen ist, sowei bei Patient:innen mit einer genetischen Disposition (Träger:innen des HLA-DQA1*05-Allels).5–7
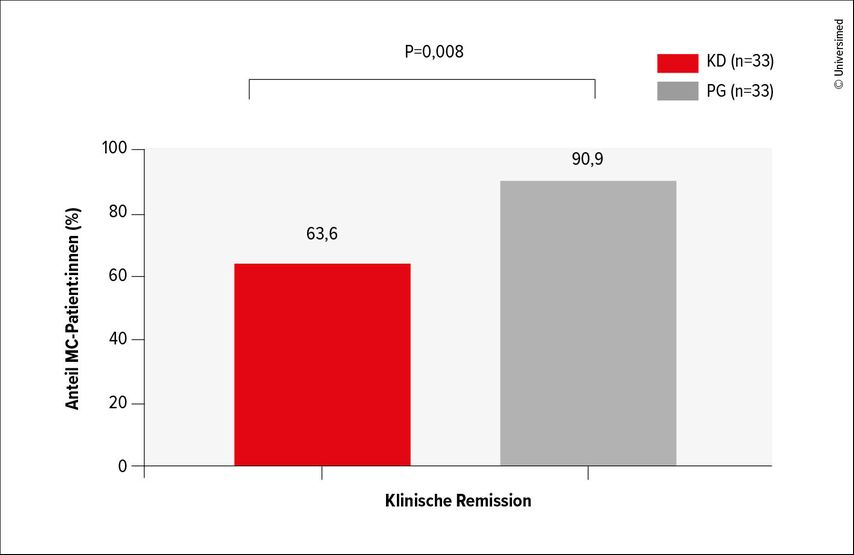
Die SONIC-Studie mit Infliximab bei MC konnte zeigen, dass eine Kombination mit Azathioprin die Bildung von ADA hemmt.8 Bei Adalimumab hingegen ist die Kombination mit Azathioprin der Monotherapie nicht überlegen.9 Dotan wies darauf hin, dass nicht jeder Verlust des Ansprechens auf Immunogenität und ADA zurückzuführen ist.10 Deshalb sollte man alle Faktoren berücksichtigen, die das Ansprechen beeinflussen können, zum Beispiel Fettleibigkeit, Rauchen und den Albuminspiegel. Auch die Bestimmung der Talspiegel der Medikamente ist wichtig, um die Infusionsintervalle und die Dosierung entsprechend anzupassen.11 Eine solche präzisionsgesteuerte Dosierung verlängert die Dauer der Wirkung von Infliximab, führt zu höheren Raten klinischer Remission und reduziert die Immunogenität (Abb. 1).12–14
Abb. 1: Raten klinischer Remission nach zwölf Monaten bei Patient:innen mit Morbus Crohn (MC), die entweder nach einem konventionellen Dosierungsschema (KD) oder präzisionsgesteuert (PG) behandelt wurden (mod. nach Strik AS et al. 2021)14
Korrelation von Serumspiegeln und Ansprechraten
Die SEAVUE-Studie war ein direkter Vergleich von Adalimumab und Ustekinumab bei Patient:innen mit moderatem oder schwerem MC, die noch nicht mit Biologika behandelt worden waren. Unter anderem wurde auch die Korrelation der jeweiligen Talspiegel mit der klinischen Remission und dem endoskopischen Ansprechen bewertet. Es zeigte sich, dass das endoskopische Ansprechen bei den Patient:innen mit den höheren Quartilen der Talspiegelwerte beider Wirkstoffe höher war.15 Es gebe daher einen Grund, sich auch die Ustekinumab-Wirkstoffspiegel anzusehen, was normalerweise in der klinischen Praxis nicht gemacht werde, sagte Dotan. Die Therapie zu optimieren, schliesse deshalb auch die Messung der Talspiegel ein. Das gelte für Infliximab, Adalimumab, Ustekinumab, weniger für Vedolizumab,16 betonte sie. Die erforderlichen Talspiegel müssten festgelegt und überprüft werden, um die verfügbaren Wirkstoffe richtig einzusetzen und nicht einfach zur nächsten Therapie zu wechseln.
Für bestimmte Patient:innen könnte auch eine duale Therapie, bei der verschiedene Wirkmechanismen kombiniert werden, vorteilhaft sein. Dies wurde in der Open-Label-Studie EXPLORER gezeigt.17 Sie untersuchte die Dreifachkombination aus Vedolizumab, Adalimumab und Methotrexat bei Patient:innen mit neu diagnostiziertem MC, die noch keine Biologika erhalten hatten. Primärer Endpunkt war die endoskopische Remission in Woche 26, sekundärer Endpunkt die klinische Remission in Woche 10 und 26. Zu Woche 26 führte die Kombinationstherapie bei 34% der Patient:innen zu einer endoskopischen Remission und bei 54% zur klinischen Remission ohne neue Sicherheitssignale. Die Dreifachkombination führte im Vergleich zur Vedolizumab- bzw. Adalimumab-Monotherapie mit einer Wahrscheinlichkeit von 86% bzw. 71% zu höheren Raten an endoskopischer Remission.17 Die Kombinationstherapie sei daher ein weiterer Weg, um die Behandlung von MC zu optimieren, wobei weitere Studien mit unterschiedlichen Wirkstoffkombinationen nötig seien, so Dotan.
Quelle:
IBDnet 9th Postgraduate Course, 5. bis 7. Dezember 2024, Ermatingen
Literatur:
1 Yarur AJ et al.: Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn’s disease. Aliment Pharmacol Ther 2017; 45: 933-40 2 Brandse JF et al.: Pharmacokinetic features and presence of antidrug antibodies associate with response to infliximab induction therapy in patients with moderate to severe ulcerative colitis. Clin Gastroenterol Hepatol 2016; 14: 251-8.e1-2 3 Ordás I et al.: Anti-TNF monoclonal antibodies in inflammatory bowel disease: pharmacokinetics-based dosing paradigms. Clin Pharmacol Ther 2012; 91: 635-46 4 D’Haens GR et al.: Higher vs standard adalimumab induction dosing regimens and two maintenance strategies: randomized SERENE CD trial results. Gastroenterology 2022; 162: 1876-90 5 Vermeire S et al.: Effectiveness of concomitant immunosuppressive therapy in suppressing the formation of antibodies to infliximab in Crohn’s disease. Gut 2007; 56: 1226-31 6 Kennedy NA et al.: Predictors of anti-TNF treatment failure in anti-TNF-naive patients with active luminal Crohn’s disease: a prospective, multicentre, cohort study. Lancet Gastroenterol Hepatol 2019; 4: 341-53 7 Sazonovs A et al.: HLA-DQA1*05 carriage associated with development of anti-drug antibodies to infliximab and adalimumab in patients with Crohn’s disease. Gastroenterology 2020; 158: 189-99 8 Colombel JF et al.: Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010; 362: 1383-95 9 Matsumoto T et al.: Adalimumab monotherapy and a combination with azathioprine for Crohn’s disease: a prospective, randomized trial. J Crohns Colitis 2016; 10: 1259-66 10 Alsoud D et al.: Letter: immunogenicity is not the root cause for loss of response to anti-TNF agents in patients with IBD in TDM era. Aliment Pharmacol Ther 2022; 55: 885-6 11 Dotan I et al.: Patient factors that increase infliximab clearance and shorten half-life in inflammatory bowel disease: a population pharmacokinetic study. Inflamm Bowel Dis 2014; 20: 2247-59 12 Dubinsky MC et al.: Dashboard-driven accelerated infliximab induction dosing increases infliximab durability and reduces immunogenicity. Inflamm Bowel Dis 2022; 28: 1375-85 13 Vermeire S et al.: Forecasted infliximab concentrations during induction predict time to remission and sustained disease control of inflammatory bowel disease. Clin Res Hepatol Gastroenterol 2024; 48: 102374 14 Strik AS et al.: Efficacy of dashboard driven dosing of infliximab in inflammatory bowel disease patients; a randomized controlled trial. Scand J Gastroenterol 2021; 56: 145-54 15 Sands BE et al.: Ustekinumab versus adalimumab for induction and maintenance therapy in biologic-naive patients with moderately to severely active Crohn’s disease: a multicentre, randomised, double-blind, parallel-group, phase 3b trial. Lancet 2022; 399: 2200-11 16 Takenaka K et al.: Transmural remission characterized by high biologic concentrations demonstrates better prognosis in Crohn’s disease. J Crohns Colitis 2023; 17: 855-62 17 Colombel JF et al.: Vedolizumab, adalimumab, and methotrexate combination therapy in Crohn’s disease (EXPLORER). Clin Gastroenterol Hepatol 2024; 22: 1487-96.e12
Das könnte Sie auch interessieren:
Kann der Lifestyle eine IBD verhindern?
Es gibt immer mehr Hinweise, dass die Entstehung und der Krankheitsverlauf von entzündlichen Darmerkrankungen durch Umwelt- und Lifestylefaktoren beeinflusst werden. Am 9. Postgraduate ...
Behandlung der Sigmadivertikulitis
Die Divertikulitis gehört zu den häufigsten Krankheitsbildern bei akuten Bauchschmerzen. Die Inzidenz nimmt mit dem Alter stark zu und immer mehr jüngere Patienten erkranken an einer ...
Therapie des Morbus Crohn: bewährte Konzepte und neue Strategien
Welche Behandlungsziele haben Ärzt:innen, die Patient:innen mit Morbus Crohn (MC) behandeln, und haben die Betroffenen die gleichen Ziele? Lassen sich die Therapieziele erreichen, wenn ...