Die Lunge im Fokus von gastrointestinalen Erkrankungen
Bericht:
Mag. Andrea Fallent
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Aus dem Bauch heraus: So könnte man jene gastrointestinalen Erkrankungen subsumieren, die sich auf verschiedensten Wegen auf die Lunge auswirken können. Dazu zählen u.a. Reflux und chronisch-entzündliche Darmerkrankungen. Prof. Dr. Michael Kreuter, Mainz, präsentierte in seinem Kongressvortrag zu seltenen Lungenerkrankungen eine Auswahl pulmonaler Manifestationen aufgrund von Darm- und Lebererkrankungen.
Anatomisch trennt das Zwerchfell die Organe des Thorax von jenen des Abdomens. Dennoch haben Atmungs- und Verdauungstrakt so einiges gemein, wie Prof. Dr. Michael Kreuter, Mainz, einleitend erklärte. Neben der embryologischen Herkunft und der großen Kontaktfläche nach außen, die u.a. viel Raum für immunologische Reaktionen bietet, stellt nicht zuletzt auch der wahrscheinliche Zusammenhang des Darm-Lungen-Mikrobioms („lung-gut axis“) einen Schnittpunkt dar, der auch im Mittelpunkt wissenschaftlicher Untersuchungen steht. „Es gibt einige interessante Daten, wenngleich auch aus kleinen Studien, zum Zusammenhang zwischen dem Darm und Erkrankungen wie COPD, Asthma und Mukoviszidose“, erläuterte Kreuter. Dass ein Blick über den Tellerrand bzw. jenseits des Diaphragmas bei so manchen pulmologischen Befunden durchaus hilfreich sein kann, zeigte der Experte anhand von wissenschaftlichen Daten und klinischen Erfahrungsberichten.
Reflux und idiopathische Lungenfibrose
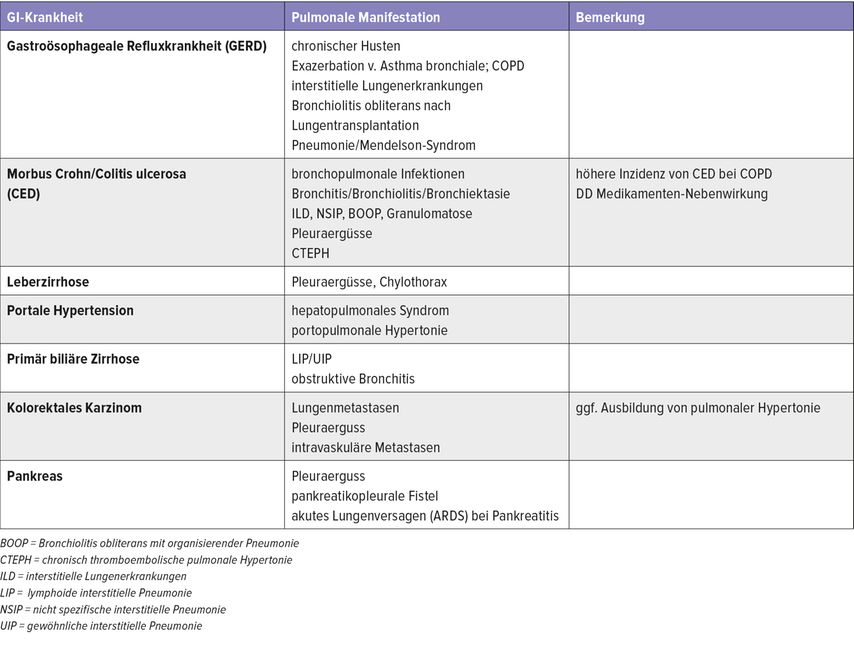
Die möglichen pulmonalen Manifestationen von Reflux sind mittlerweile auch häufig Thema in der pulmologischen Praxis (Tab. 1). Konkret ging Kreuter auf die idiopathische Lungenfibrose (IPF) und die Erkenntnis ein, dass Reflux bei IPF-Patient:innen häufiger vorkommt.1
Tab. 1: Pulmonale Manifestationen bei gastrointestinalen (GI) Erkrankungen (modifiziert nach Kreuter M et al. 2022)8
Interessanterweise beschleunigt die gastroösophageale Refluxkrankheit (GERD) den Verlauf der IPF nicht nachteilig, sondern sie stellt im Gegenteil einen möglichen Überlebensvorteil dar.2,3 Woran das liegen könnte, wird laut Kreuter heiß debattiert, „auch wenn es bis heute keine Antwort darauf gibt“. Eine mögliche Erklärung könnte eine Therapie mit Protonenpumpen-Inhibitoren (PPI) sein. Dennoch wurden Empfehlungen, IPF-Patienten zusätzlich mit PPI zu behandeln, wieder revidiert, da dazu gegensätzliche Studienergebnisse vorliegen.
Granulome der Leber und der Lunge
Bei den granulomatösen Erkrankungen sprach Kreuter kurz die Auslöser an, die sowohl in der Leber als auch in der Lunge Granulome verursachen können, allen voran Mykobakterien, Cytomegalieviren sowie Sarkoidose und Kollagenosen.
Detaillierter erläuterte Kreuter in diesem Kontext die primär biliäre Cholangitis (PBC), eine autoimmune Lebererkrankung, die eigenständig, aber auch im Zusammenhang mit anderen Autoimmunerkrankungen, z.B. der rheumatoiden Arthritis, auftreten kann. In ca. 50 bis 60% der Fälle verläuft die Erkrankung asymptomatisch, weshalb es sich dabei oft um einen Zufallsbefund handelt. Die häufigsten Symptome der PBC sind Fatigue und Pruritus sowie erhöhte Leberwerte (Transaminasen). Histologisch sind Anzeichen einer Cholangitis bzw. Granulome nachweisbar. Ein Flussdiagramm zur Diagnose der PBC findet sich in den Leitlinien für autoimmune Lebererkrankungen.4
Zu den bislang beschriebenen pulmonalen Manifestationen der PBC zählen interstitielle Lungenerkrankungen (ILD) in verschiedenen Ausprägungen, Sarkoidose-ähnliche Granulome, Bronchiolitis-organisierende Pneumonie und lymphozytäre Pneumonitis sowie nekrotisierende sarkoidale Granulomatose.5 Bei den von Kreuter angeführten Beispielen führte eine Steroidtherapie zu einer bezeichnenden Besserung.5,6
Chronisch-entzündliche Darmerkrankungen (CED)
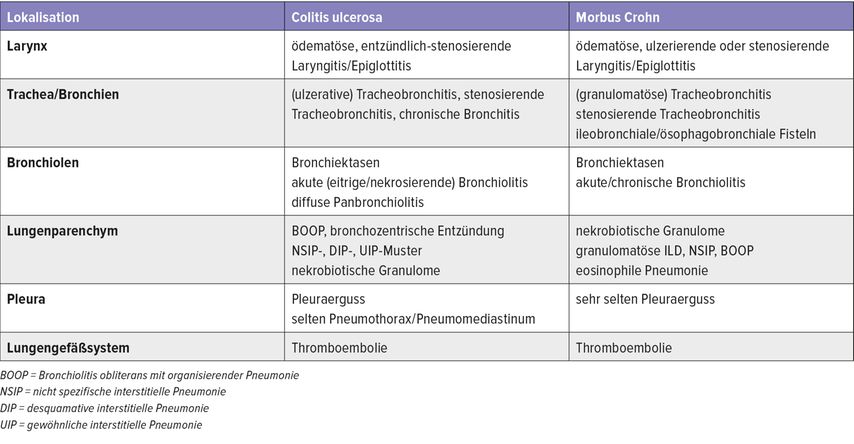
Chronisch-entzündliche Darmerkrankungen (CED) lassen sich nach heutigem Wissen nicht mehr nur auf den Verdauungstrakt beschränken, betonte Kreuter. Die in der Literatur angegebene Inzidenz von extraintestinalen Manifestationen liegt zwischen 21 und 41%. In relativ seltenen Fällen (<0,5%) kann auch die Lunge betroffen sein. Als Manifestationen werden chronische Bronchitis, Bronchiolitis, Bronchiektasie, akute Laryngotracheitis, tracheale Stenose, Pleuritis bzw. Serositissowie Bronchiolitis-obliterans-organisierende Pneumonie (BOOP) beschrieben. Während bei Morbus Crohn häufiger granulomatöse Lungenmanifestationen auftreten, findet man bei der Colitis ulcerosa öfter Pleuraergüsse: „Viele Mitbeteiligungen sind aber bei beiden Erkrankungen zu finden“, so Kreuter (Tab. 2).
Tab. 2: Pulmonale Manifestationen bei chronisch-entzündlichen Darmerkrankungen (modifiziert nach Kreuter M 2023)
Wichtig ist, mögliche Differenzialdiagnosen wie eine Medikamententoxizität durch die CED-Therapie mit Sulfasalazin/Mesalazin, Methotrexat, Infliximab, Azathioprin etc. sowie infektiöse Komplikationen wie die Infliximab-asssoziierte Tuberkulose zu berücksichtigen. Unklar bleibt, wie eine pulmonale Manifestation behandelt werden sollte: „Ob Immunmodulatoren das Bild eher verbessern oder verschlechtern ist bis heute leider vollkommen unklar“, so Kreuter. „Hierzu gibt es wie bei vielen seltenen Erkrankungen keinerlei Studiendaten.“
Hepatopulmonales Syndrom (HPS)
Eine gar nicht so seltene Komplikation sind Affektionen der Lunge als Folge von chronischen Lebererkrankungen. Dazu zählen vorrangig das hepatopulmonale Syndrom (HPS) und die portopulmonale Hypertonie. Ein hepatopulmonales Syndrom sollte bei allen Patienten mit bekannter Lebererkrankung in Betracht gezogen werden, die über Dyspnoe berichten. Dazu brachte Kreuter eine Kasuistik: Eine 53-jährige Patientin zeigte seit drei Monaten eine Belastungsdyspnoe mit Platypnoe und Orthodeoxie. Die Anamnese ergab eine Leberzirrhose durch Alkoholabusus, Ösophagusvarizen und Hämorrhoiden.
Die Lungenfunktion war relativ wenig eingeschränkt, allerdings konnten eine schwere Diffusionsstörung sowie eine signifikante Shuntfraktion festgestellt werden. Weitere Hinweise lieferte die Blutgasanalyse. Die radiologische Untersuchung zeigte dennoch keine eindeutige Pathologie. „Bei diesen Symptomen und Parametern sollten Sie an ein hepatopulmonales Syndrom denken“, so Kreuter. Die Diagnostik erfolgt durch eine Kontrast-Echokardiografie oder Lungenperfusionsszintigrafie. Mittels Lungenperfusionsscan können Nieren- und ZNS-Shunts sichtbar gemacht werden.
Welcher Pathomechanismus hinter dem HPS steckt, ist bis heute nicht eindeutig geklärt. Kreuter: „Die Patienten sind schwer hypoxisch, tolerieren das aber relativ gut. Trotzdem sollte man eine Sauerstofftherapie initiieren.“ In Einzelfällen hat sich ein transjugulärer intrahepatischer portosystemischer Shunt bzw. eine Embolisation der größeren AV-Anastomosen als hilfreich erwiesen. Das Einzige, was den Status längerfristig verbessert, ist die Behandlung der Grunderkrankung durch eine Lebertransplantation.
Portopulmonale Hypertonie (PoPH)
Eine weitere mögliche Folge der Leberzirrhose stellt die portopulmonale Hypertonie (PoPH) dar, die auch häufig gleichzeitig mit dem hepatopulmonalen Syndrom auftritt und als pulmonalarterielle Hypertonie (PAH) im Kontext einer portalen Hypertension definiert ist. Die Häufigkeit bei Patienten mit fortgeschrittener Leberkrankung wird mit ca. 5% angegeben.
Auch hier sind Therapieempfehlungen aufgrund der geringen Fallzahlen bzw. Evidenz schwierig. Hilfreich dazu ist laut Kreuter das französische PH-Register mit klinischen Daten. Eine Anti-PAH-Therapie bringt dem Register zufolge relativ gute Überlebensraten (84%/1 Jahr; 69%/3 Jahre; 51%/5 Jahre). Eine Lebertransplantation verbessert den Zustand deutlich, allerdings muss ein hohes perioperatives Risiko berücksichtigt werden.
Pulmonale Hämochromatose/sekundäre Hämosiderose
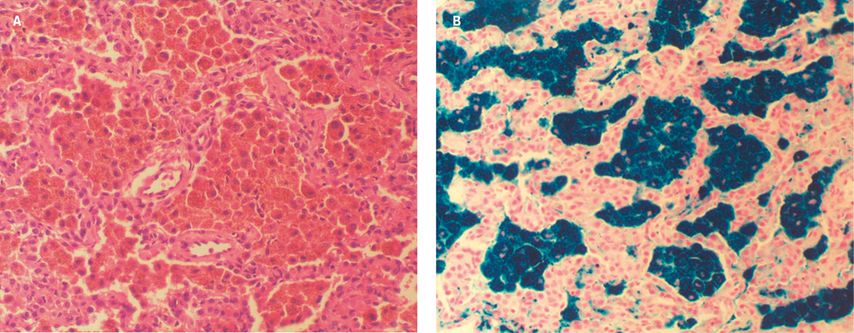
Zum nächsten relativ unbekannten Phänomen sind weder Häufigkeit noch Therapieoptionen bekannt: die Hämochromatose bzw. die sekundäre Hämosiderose in der Lunge. Hämosiderose ist definiert als abnorme Ansammlung von Eisen in den parenchymatösen Organen, die zu Organtoxizität führt (Abb. 1). Sie kann erblich bedingt sein (Hämochromatose) bzw. sekundär durch Pathologien der Erythropoese und die Behandlung dieser Erkrankungen mit Bluttransfusionen verursacht werden. Kreuter zeigte den konkreten Patientenfall eines Mannes mit Hämosiderose in der Lunge aufgrund einer Thalassämietherapie mit Bluttransfusionen.7
Abb. 1: Idiopathische pulmonale Hämosiderose (IPH): unspezifische Verdickung der Alveolarsepten und zahlreiche hämosiderinbeladene Makrophagen in den Alveolarräumen (A: Hämatoxylin- und Eosinfärbung, B: Berliner-Blau-Färbung; modifiziert nach Ioachimescu OC et al. 2004)10
Alpha-1-Antitrypsinmangel
Der Zusammenhang von Alpha-1-Anti-trypsinmangel und Lungenemphysem wurde 1963 erkannt, 1968 auch der Konnex zur Leberzirrhose. Zu den pulmonalen Symptomen zählen Husten, Giemen, Dyspnoe, häufigere und länger dauernde akut exazerbierte COPD, leberseitig finden sich ein prolongierter Neugeborenen-Ikterus, eine chronische nichtvirale Hepatitis und evtl. ein höheres Risiko für das hepatozelluläre Karzinom (HCC).8
Bezüglich der Therapie könnte laut Kreuter eine Substitutionstherapie bei Nichtrauchern erwogen werden, die einen geringeren Verlust der CT-densitorisch gemessenen Lungendichte bewirken kann und mögliche Effekte auf den FEV1-Abfall hat. Die Therapie zeigt jedoch nur pulmologische Effekte, aber keinen Einfluss auf die Zirrhose. Auch hier kommt daher in letzter Instanz nur die Lebertransplantation infrage, so das Resümee.
Mukoviszidose (CF)
Die Mukoviszidose (zystische Fibrose; CF) ist die häufigste angeborene Lungenerkrankung. Extrapulmonal manifestiert sich die Erkrankung sehr häufig durch eine exokrine Pankreasinsuffizienz (90% der Neugeborenen mit CF), Mekoniumileus, distales intestinales Obstruktionssyndrom sowie als CF-bedingte Lebererkrankung mit Sekretstau in den intrahepatischen Gallengängen, die zu biliärer Leberzirrhose mit portaler Hypertension und der Ausbildung von Ösophagusvarizen führt.
Telomeropathien
Abschließend zeigte Kreuter den Fall eines Patienten mit progredienter Belastungsdyspnoe seit 3 Jahren ohne Exposition. Zu den Vorerkrankungen waren eine nichtalkoholische Steatohepatitis (NASH) sowie Thrombo- und Leukozytopenie bekannt. Die bildgebende Diagnostik ergab eine Lungenfibrose. Anhand der genannten Symptomatik (Trias: Leber, Knochenmark, Lunge) und der seit Jugendjahren ergrauten Haare ergab sich der Verdacht auf eine TERC-Mutation, die als Dyskeratosis congenita in die Gruppe der Telomeropathien fällt und u.a. auch eine Lungenfibrose hervorrufen kann. In diesem Zusammenhang erwähnte Kreuter die Klinik für Hämatologie, Onkologie, Hämostaseologie und Stammzelltransplantation (Med. Klinik IV) der Uniklinik RWTH Aachen. Hier wurde ein Zentrum für Telomeropathien etabliert, mit dem Kreuter eng zusammenarbeitet, das klinische Studien durchführt und Patientenberatungen anbietet.9
Quelle:
„Seltene Lungenerkrankungen meets… Gastroenterologie“, Vortrag von Prof. Dr. Michael Kreuter, Lungenzentrum Mainz, Klinik für Pneumologie, Beatmungs- und Schlafmedizin, Marienhaus Klinikum Mainz und Klinik für Pneumologie, Zentrum für Thoraxerkrankungen, Universitätsmedizin Mainz, beim DGP-Kongress in Düsseldorf am 30. März 2023
Literatur:
1 Savarino E et al.: EUR Respir J 2013; 42: 1322-31 2 Kreuter M et al.: Lancet Res Med 2016; 4(5): 381-9 3 Lee JS et al.: Lancet Res Med 2013; 1(5): 369-76 4 Strassburg CP et al.: S2k Leitlinie Autoimmune Lebererkrankungen. Z Gastroenterol 2017; 55: 1135-1226 5Laudenbach K, Seese B: Dtsch Med Wochenschr 2015; 140: 264-6 6 Shen M et al.: J Clin Gastroenterol 2009;43(7): 676-9 7 Ucar BI et al.: Respir Case Rep 2014; 3(3): 138-40 8 Kreuter M et al.: Seltene Lungenerkrankungen. 2. Auflage. Berlin Heidelberg: Springer-Verlag, 2022. 495-511 9 https://www.ukaachen.de/kliniken-institute/klinik-fuer-haematologie-onkologie-haemostaseologie-und-stammzelltransplantation-med-klinik-iv/forschung/zentrum-fuer-telomererkrankungen-telomeropathien/ ; zuletzt aufgerufen am 16.6.2023 10 Ioachimescu OC et al.: Idiopathic pulmonary haemosiderosis revisited. Eur Respir J 2004; 24(1): 162-69
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Transition bei CED: Fallbeispiel für einen strukturierten Übergang
Die Transition bei chronisch-entzündlichen Darmerkrankungen stellt eine wichtige Brücke zwischen Jugendlichen und Erwachsenen dar und birgt einige Herausforderungen. Am ...