Immuncheckpoint-Inhibitorinduzierte Erkrankungen
Bericht:
Dr. Andreas Billich
Fallbeispiele präsentiert von
Dr. Anna-Maria Tiefenthaller
Ordensklinikum Linz
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Therapie mit Immuncheckpoint-Inhibitoren kann das Überleben von Tumorpatient:innen verlängern, doch häufig treten autoimmune Nebenwirkungen auf. Diese Problematik, mit Schwerpunkt auf dem Management gastrointestinaler Komplikationen, behandelte OÄ Dr. Stephanie Hametner-Schreil, Linz, beim Fortbildungskurs der ÖGGH.
Durch Immuncheckpoint-Inhibitoren (ICI) induzierte Erkrankungen können jedes Organsystem betreffen. Für die Gastroenterolog:innen sind diese immunvermittelten Nebenwirkungen (NW) der ICI von besonderer Bedeutung, denn häufige Komplikationen betreffen (unabhängig von der Tumorlokalisation) den Gastrointestinal(GI)-Trakt. Zudem werden ICI auch in der Immuntherapie (ITx) von GI-Tumoren eingesetzt; sie sind zugelassen zur Behandlung von Tumorerkrankungen des luminalen GI-Trakts und der Leber, z.B. bei speziellen Konstellationen des Platten- oder Adenokarzinoms des Ösophagus oder Magenkarzinoms, beim MSI-high-Kolorektalkarzinom sowie beim hepato- und cholangiozellulären Karzinom.
Mechanismen von Wirkung und Nebenwirkung
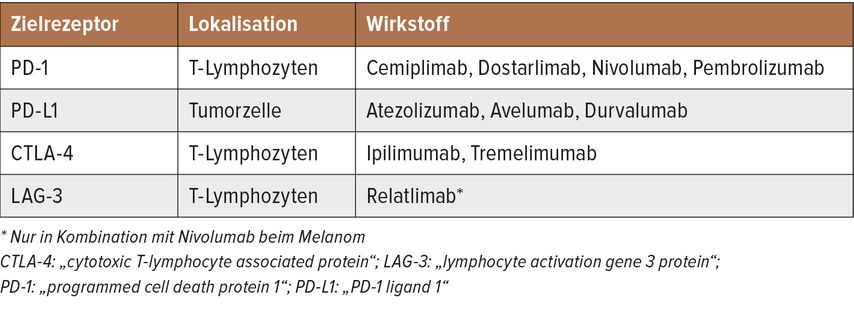
ICI aktivieren die Tumorabwehr, indem entzündungsdämpfende Interaktionen zwischen T-Lymphozyten und Antigen-präsentierenden Zellen bzw. Tumorzellen unterbrochen werden. Prominente Beispiele sindmonoklonale IgG-Antikörper gegen die Rezeptoren CTLA-4 und PD-1 auf T-Zellen undgegen PD-L1, das von Tumorzellen stark exprimiert wird. Eine Übersicht über die zugelassenen Wirkstoffe bietet die Tabelle 1.
Die Mechanismen der unerwünschten autoimmunen Wirkungen der ICI umfassen die Aktivierung autoreaktiver T-Lymphozyten mit Infiltration des entsprechenden Organs, die Dysregulation von B-Lymphozyten mit Bildung von kreuzreaktiven Antikörpern, direkte Toxizität und die vermehrte Produktion proinflammatorischer Zytokine und Chemokine.1 Auch Wechselwirkungen mit dem Mikrobiom und genetische Varianten spielen eine Rolle. Durch die Vielzahl der Einflussfaktoren kommt es bei den Patient:innen zu unterschiedlicher Ausprägung von Autoimmunität, Entzündung und Gewebsschädigung unter einer ICI-Therapie.
Komplikationen unter ICI-Therapie
Durch eine ICI-Therapie können Autoimmunerkrankungen neu entstehen und subklinisch vorbestehende demaskiert werden. Klinisch werden dann immunbezogene unerwünschte Ereignisse sowie Schübe bestehender Autoimmunerkrankungen und vermehrtes Auftreten paraneoplastischer Symptome beobachtet.
Am häufigsten sind kutane NW der ICI-Therapie (Juckreiz, makulopapulöser Ausschlag, Entwicklung von Lichen planus oder Vitiligo bis hin zu schweren Erkrankungen wie DRESS- und Stevens-Johnson-Syndrom. Häufig sind GI-Komplikationen (vor allem Kolitis und Hepatitis) und Endokrinopathien (z.B. Thyreoiditis, Hypophysitis). Es kommen auch neurologische NW (meist das periphere Nervensystem betreffend) vor sowie rheumatologische NW (Arthritiden meist großer Gelenke), thrombotische Mikroangiopathien, Vaskulitiden und Pneumonitis. Kardiale Komplikationen sind selten.
ICI-induzierte Erkrankungen: Fallbeispiele
Fall 1 – Kolitis
Bei einem 65-jährigen männlichen Patienten wurde im April 2022 ein Melanom an der linken Brust diagnostiziert. Nach primärer Tumorexzision wurde eine adjuvante Therapie mit Tyrosinkinaseinhibitoren begonnen, die jedoch nach zwei Monaten toleranzbedingt beendet werden musste, wonach auf Nivolumab umgestellt wurde. Nach Auftreten zerebraler Metastasierung im Oktober 2022 wurden eine kombinierte ITx mit Ipilimumab plus Nivolumab und parallel eine stereotaktische Radiotherapie eingeleitet. Bereits nach zwei Zyklen trat eine schwere ICI-assoziierte Kolitis mit bis zu zwölf wässrig-blutigen Stühlen pro Tag und reduziertem Allgemeinzustand auf. Koloskopisch wurde eine ausgeprägte Pankolitis mit Ulzerationen nachgewiesen. Die ITx wurde pausiert. Eine Steroidtherapie und auch die Kombination mit Infliximab in der Grunddosis von 5mg/kgKG ergaben kein ausreichendes Ansprechen; erst eine Dosiseskalation auf 10mg/kgKG führte zur Beschwerdebesserung.
Fall 2 – Hepatitis
Eine 68-jährige Patientin wurde im April 2021 wegen eines Hypopharynxkarzinoms operiert und erhielt ab Juni eine adjuvante ITx mit vier Zyklen Pembrolizumab. Danach zeigte sich ein Anstieg der Leberfunktionsparameter (LFP). Trotz des Fehlens von Auffälligkeiten in der auf Lebererkrankungen fokussierten Anamnese, in der Bildgebung und im Labor hinsichtlich Autoimmun- oder Speicherkrankheiten ergab sich daraus der Verdacht auf eine ICI-assoziierte Hepatitis. Die ITx wurde beendet und eine Behandlung mit Prednisolon parenteral etabliert, worauf sich schon nach 1–2 Wochen die Leberwerte und der Allgemeinzustand besserten. Unter ausschleichender Steroidtherapie kam es zu einer anhaltend vollständigen Normalisierung der LFP.
Fall 3 – Hypophysitis
Eine 83-jährige Patientin mit rezidiviertem Endometriumkarzinom wurde ab Februar 2021 mit Pembrolizumab behandelt. Wegen oraler und genitaler Aphthen, die durch Lokaltherapie nicht zu beherrschen waren, sowie eines leichten passageren LFP-Anstiegs musste diese ITx schon nach kurzer Zeit beendet werden. Es wurde im Juni 2021 auf Atezolizumab umgestellt, welches zunächst gut vertragen wurde. Nach sechs Monaten kam es jedoch zu einer Verschlechterung des Allgemeinzustands mit zunehmender Schwäche, Zittrigkeit und Erbrechen; schließlich trat eine Synkope auf. Die Schilddrüsenparameter waren normal, doch Cortisol basal und ACTH nicht messbar und der Synacthen-Test pathologisch. In der Zusammenschau musste von einer sekundären Nebennierenrindeninsuffizienz im Rahmen einer ICI-assoziierten Hypophysitis ausgegangen werden. Eine Hydrocortisonsubstitution wurde begonnen und eine Notfallschulung durchgeführt. Die Patientin ist bis dato beschwerde-frei und die ITx konnte unter Substitution fortgesetzt werden.
Fall 4 – Gastritis
Eine bei Erstdiagnose 75-jährige Patientin mit primär metastasiertem Bronchialkarzinom erhielt im Anschluss an drei Chemotherapien ab Oktober 2015 eine ITx mit Pembrolizumab. Unter dieser ICI-Therapie zeigte sich über 3½ Jahre eine Regredienz des Primums und der Metastasen. Nach 63 Zyklen lag im Mai 2019 eine anhaltende Komplettremission vor, jedoch musste die ICI-Therapie wegen ausgeprägter Mukositis pausiert werden. Im September 2019 wurde die Patientin wegen Schwäche, Inappetenz und Hämoglobinabfall stationär aufgenommen. Die Gastroskopie zeigte großflächige, unscharf begrenzte Schleimhautdefekte und eine immunvermittelte ulzeröse Gastroduodenitis wurde diagnostiziert. Die symptomatische Therapie bestand aus Pantoprazol und Sucralfat sowie Substitution der Anämie. Kausal wurde mit Steroiden behandelt, worunter es jedoch nach einem Monat zu keiner wesentlichen Besserung kam. Daher wurde eine ergänzende Therapie mit Rituximab eingeleitet, worauf sich ein gutes Ansprechen zeigte. Die Patientin ist bis heute in Komplettremission.
Die Häufigkeit der NW ist vor allem bei den CTLA-4-Inhibitoren dosisabhängig. Kombinationen von PD-1- und CTLA-4-Inhibitoren haben höhere NW-Raten. Grad I/II-NW treten mit CTLA-4-Antikörpern in bis zu 70% der Fälle auf, mit Hemmern der PD-1-Achse bei 50–60%; Grad-III/IV-NW sind mit 20% bei CTLA-4-Inhibitoren ebenfalls häufiger als bei PD-1/PD-L1-Hemmern (5–10%). NW mit tödlichem Ausgang haben eine Prävalenz von unter 1%. Die autoimmunen NW treten typischerweise 6–12 Wochen nach Therapiebeginn auf, doch gibt es Fälle, bei denen NW erst ein Jahr nach Beendigung der Therapie manifest wurden.
Therapie immunbedingter NW der ICI
Die Therapie kann sich an einschlägige ESMO-Leitlinien, die 2022 aktualisiert wurden, anlehnen.2 Auf Diagnose und Grading der NW sowie Ausschluss von Differenzialdiagnosen folgt bei einem Schweregrad ≥2 die Auswahl einer adäquaten Immunsuppression. Deren Wirksamkeit soll nach drei Tagen evaluiert werden, um gegebenenfalls die Therapie anzupassen.
Zur Wirksamkeit der Medikation bei immunbedingten NW der ICI gibt es keine prospektiven Studien, doch werden in erster Linie Glukokortikoide empfohlen. Wenn diese nicht ausreichend wirken, können Biologika (z.B. Antikörper gegen TNFα, CD20 und proinflammatorische Interleukine) in der Zweitlinie zum Einsatz kommen. Auch die Verwendung alternativer Immunsuppressiva (z.B. Mycophenolat-Mofetil [MMF], Tacrolimus, Cyclosporin, Cyclophosphamid, Methotrexat, JAK-Inhibitoren) kann erwogen werden.
Die ESMO-Leitlinien schlagen detaillierte Algorithmen zum Management der verschiedenen ICI-bedingten NW mit diesen Therapieoptionen vor.2
Meist sind die Toxizitäten der ICI gut behandelbar, wie eine Reihe von Fallbeispielen verdeutlicht (siehe Kasten).
ICI-bedingte Diarrhö und Kolitis
Diarrhö und Enterokolitis sind die häufigsten durch ICI verursachten Komplikationen im GI-Trakt. Die Häufigkeit ist bei Therapie mit CTLA-4-Inhibitoren deutlich höher (bis zu 35%) als mit Inhibitoren der PD-1-Achse (bis zu 10%).
Die Symptome dieser NW sind bekannt: Durchfall, Bauchschmerzen, Fieber, Gewichtsverlust, Elektrolytveränderungen etc. Differenzialdiagnostisch ist die ICI-bedingte Kolitis abzugrenzen von infektiösen Kolitiden, chronisch-entzündlichen Darmerkrankungen (CED), ischämischer Kolitis, durch Medikamente (z.B. NSAR) ausgelöster Kolitis und der Divertikulitis.
Die Diagnostik sollte Stuhlkulturen (inklusive Clostridium difficile) sowie den CMV-Nachweis aus dem Blut und ggf. aus einer Schleimhautbiopsie enthalten. Die Bildgebung ist sehr unsensitiv und hilft bei der Diagnosestellung nur wenig; sie ist nur bei schwerer Kolitis geboten, um Komplikationen wie Kolonperforation, Abszesse und Megakolon auszuschließen. Eine Endoskopie sollte ab Grad II durchgeführt werden; hier kann man bei ICI-induzierter Kolitis Rötungen, Erosionen, Ulzerationen, Blutungen und eine Granularität der Schleimhaut sehen. Histologisch zeigt sich bei leichtem Befall eine Verdickung der Lamina propria mit Einwanderung von Entzündungszellen und intraepithelialer Lymphozytenansammlung; bei schwerer Entzündung kommen eine Kryptitis und Kryptenabszesse und schließlich Ulzerationen hinzu. Im Vergleich zur CED sind Störungen der Kryptenarchitektur selten.
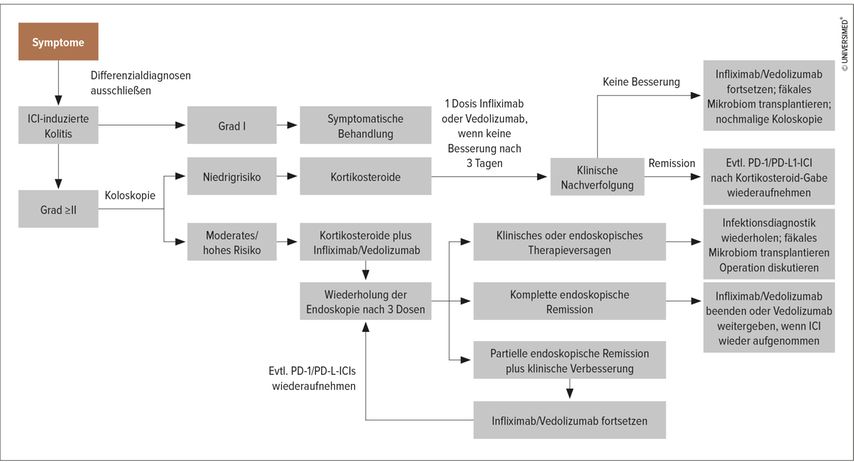
Ein Therapiealgorithmus, der speziell für die klinischen Gastroenterolog:innen nützlich erscheint, wurde 2020 publiziert (Abb. 1).3 Demgemäß wird die ICI-bedingte Kolitis vom Grad 1 symptomatisch behandelt (ballaststoffarme Diät und evtl. Loperamid). Ab Grad 2 sollen Immunsuppressiva eingesetzt werden. Niedrigrisiko-Patient:innen erhalten zunächst Kortikosteroide; wenn eine Besserung ausbleibt, kann deren Dosis erhöht werden oder auf einen Anti-TNF-(Infliximab) oder Anti-α4β7-Integrin-Antikörper (Vedolizumab) gewechselt werden. Bei schwerem Befall (z.B. tiefen und großen Ulzerationen oder Befall oberhalb des linksseitigen Kolons) soll man mit einer Kombinationstherapie aus Kortikosteroid und Infliximab beginnen; nach drei Tagen soll der Therapieerfolg evaluiert werden, um gegebenenfalls die Dosis anzupassen oder auf eine Drittlinie umzustellen. Für die Drittlinie stehen unter anderem der fäkale Mikrobiomtransfer, JAK-Inhibitoren, Ustekinumab, Cyclosporin und Calcineurin-Inhibitoren zur Verfügung.
Abb. 1: Algorithmus zum Management von ICI-induzierter Diarrhö und Kolitis (modifiziert nach Gong Z, Wang Y 2020)3
Etwa die Hälfte der Patient:innen reagiert sehr gut auf Kortikosteroide in der Erstlinie. Bei denjenigen mit unzureichendem Ansprechen tritt oft mit Anti-TNF Besserung ein. Nur rund 10% der Patient:innen benötigen eine Drittlinientherapie.
Eine zweite Form der Kolitis, die durch ICI ausgelöst werden kann, ist die mikroskopische Kolitis mit den Subformen der lymphozytären und kollagenen Kolitis, bei denen die Endoskopie meist nur milden Befall mit Schleimhautschwellung und diffuser Rötung zeigt. Leitsymptom ist bei beiden Formen die wässrige Diarrhö. Bei der lymphozytären Kolitis wird histologisch eine Infiltration der Lamina propria mit intraepithelialen Lymphozyten beobachtet, bei der kollagenen Kolitis eine diskontinuierliche Verdickung des Kollagenbandes. Behandelt wird auch hier in erster Linie mit einem Kortikosteroid (z.B. Budesonid über 12 Wochen).
ICI-induzierte Hepatitis
Unter einer ICI-Therapie tritt in 5–10% der Fälle eine Hepatitis auf. Die ICI-bedingte Hepatitis ist histologisch nur schwer von einer Autoimmunhepatitis zu unterscheiden. Meist sind die Patient:innen beschwerdearm, doch sind die Transaminasen erhöht; diese sollten daher in jedem Zyklus einer ICI-Therapie kontrolliert werden. Selten kommt es zu Ikterus, Fieber, Übelkeit oder Inappetenz. Bei Patient:innen, die wegen eines hepatozellulären Karzinoms eine ICI-Therapie erhalten, besteht eine erhöhte Wahrscheinlichkeit für das Auftreten der Hepatitis als NW.
Ist eine ICI-induzierte Hepatitis diagnostiziert, soll die ICI-Behandlung pausiert werden. Die Therapie bei Grad II der Hepatitis besteht aus oralen Glukokortikoiden; ab Grad III wird deren Dosis gesteigert und eine i.v. Gabe erwogen. In der Zweitlinie stehen z.B. MMF, IL-6- und Calcineurin-Inhibitoren sowie Azathioprin zur Verfügung.
Rechallenge nach ICI-induzierter Erkrankung?
Im Prinzip kann eine erneute ICI-basierte Therapie nach einer zuvor behandelten ICI-induzierten Erkrankung erfolgen. Jedoch werden in bis zu 50% der Fälle wieder immunbedingte NW auftreten. Man kann versuchen, das NW-Risiko zu reduzieren, z.B. indem man statt einer ICI-Kombinationstherapie nur eine Komponente gibt oder indem man die ICI-Klasse wechselt (PD-1- statt CTLA-4-Inhibitor oder umgekehrt); auch wird eine niedrig dosierte Immunsuppression zusätzlich zur ICI-Therapie in Einzelfällen diskutiert.
Quelle:
Vortrag von OÄ Dr. Stephanie Hametner-Schreil, Ordensklinikum Linz – Barmherzige Schwestern, und Fallpräsentation von Dr. Anna-Maria Tiefenthaller, Ordensklinikum Linz, beim 33. Fortbildungskurs der ÖGGH in Graz am 15. Juni 2023
Literatur:
1 Heinzerling L et al.: Checkpoint-Inhibitoren – Diagnostik und Therapie von Nebenwirkungen. Dtsch Arztebl Int 2019; 116: 119-26 2 Haanen J et al.: Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2022; 33: 1217-38 3 Gong Z, Wang Y: Immune checkpoint inhibitor-mediated diarrhea and colitis: A clinical review. JCO Oncol Pract 2020; 16: 453-61
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Transition bei CED: Fallbeispiel für einen strukturierten Übergang
Die Transition bei chronisch-entzündlichen Darmerkrankungen stellt eine wichtige Brücke zwischen Jugendlichen und Erwachsenen dar und birgt einige Herausforderungen. Am ...