Entzündung: Grundlage von Erkrankungen und therapeutisches Target
Bericht:
Dr. Andreas Billich
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Entzündung ist ein Eckpfeiler in der Entstehung und Chronifizierung von Erkrankungen aller Organsysteme. Anlässlich des 60. Geburtstags von Univ.-Prof. Dr. Herbert Tilg, Innsbruck, diskutierten bei dem Symposium „Sixty Years of Inflammation“ Expertinnen und Experten Mechanismen der Entzündung, die zu Erkrankungen insbesondere auch des Verdauungssystems führen und die Ansatzpunkte für die Therapie bieten.
Ende April trafen sich einige Wissenschaftlerinnen und Wissenschaftler von Weltrang im Congresspark Igls, um über die Entzündung zu sprechen. Die Österreichische Gesellschaft für Gastroenterologie & Hepatologie (ÖGGH) hatte gemeinsam mit dem Department für Innere Medizin der Medizinischen Universität Innsbruck acht hochkarätige Sprecherinnen und Sprecher eingeladen, um zu Ehren von Univ.-Prof. Dr. Herbert Tilg, der heuer seinen 60. Geburtstag feiert, den Hauptmechanismus von Tilgs Forschungsschwerpunkt – den chronisch-entzündlichen Darmerkrankungen – von allen Seiten zu beleuchten. Neben Prof. Dr. Arthur Kaser, University of Cambridge, UK, Univ.-Prof. Dr. Alexander Moschen, Linz, und Prof. Dr. Charles Dinarello, Colorado, USA, referierten weitere renommierte Wissenschaffende, deren Vorträge wir für Sie zusammengefasst haben.
Das Mikrobiom als Entzündungsquelle
Die Arbeitsgruppen von Prof. Dr. Eran Elinav am Weizmann-Institut (Rehovot, Israel) und am DKFZ (Heidelberg, Deutschland) erforschen die Wechselwirkungen zwischen Wirt und Mikrobiom. Die gewonnenen Erkenntnisse könnten in Zukunft zur besseren Behandlung jener Erkrankungen beitragen, bei denen das Mikrobiom eine besondere Rolle spielt, insbesondere der chronisch-entzündlichen Darmerkrankungen (CED).
Derzeit auf das Mikrobiom gerichtete Behandlungsformen wie Probiotika, Präbiotika und Stuhltransplantation sind unspezifisch und wenig evidenzbasiert. Das Ziel sei daher, so Elinav, spezifische und durch Daten gestützte Therapien zu entwickeln. Dazu gehören Methoden, die in den nächsten zehn Jahren die Therapielandschaft verändern könnten, z.B. personalisierte Ernährung, Postbiotika, autologe Stuhltransplantation oder – bislang noch nicht realisiert – die gezielte Elimination von Pathobionten.
Es gibt überwältigende Evidenz für eine Beteiligung des Darmmikrobioms an der Pathogenese der CED. Jedoch wurden bis heute keine reproduzierbaren Signaturen eines „CED-Mikrobioms“ identifiziert. Die CED-Therapie ist deshalb nicht personalisiert und beschränkt sich auf nachgeordnete Targets des adaptiven Immunsystems. Neue Therapieansätze sind also gefordert.
IBD-assoziierte Bakterienstämme
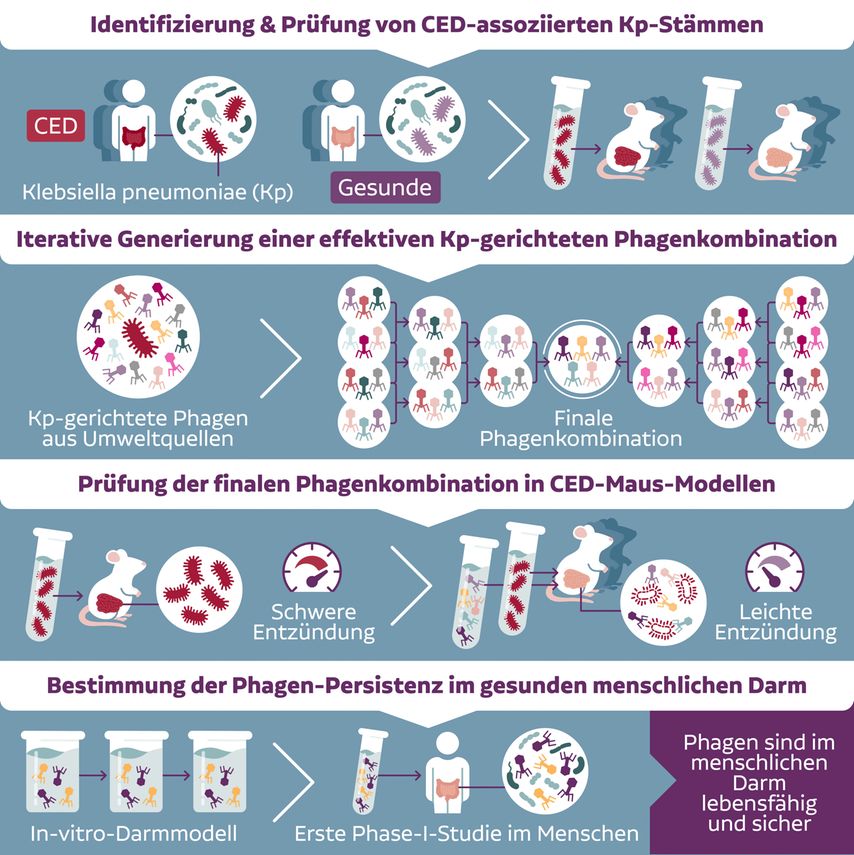
Elinav präsentierte ein Projekt zur Identifizierung von Pathobionten, die mit CED-Exazerbationen weltweit (also unabhängig von Ethnien und unterschiedlichen Diäten) assoziiert sind (Abb. 1).1 Hierfür wurde das Mikrobiom von 537 Patienten mit Morbus Crohn (MC) und Colitis ulcerosa (CU) aus vier Ländern (Deutschland, USA, Frankreich, Israel) sequenziert. Insgesamt war das Mikrobiom der Patienten (unabhängig vom Ursprungsland) von dem gesunder Personen deutlich verschieden; wichtig war die Beobachtung, dass es sich auch funktionell, d.h. hinsichtlich metabolischer Fähigkeiten, unterschied. Eine kurze Liste von kommensalen Mikroorganismen, die in allen Ländern mit Exazerbationen von MC und CU assoziiert sind, wurde erstellt und schließlich fokussierte man auf einen Kandidaten – Klebsiella pneumoniae (Kp).
Abb. 1: Entwicklung von Phagenkombinationen zur gezielten Elimination CED-assoziierter Bakterien (modifiziert nach Federici S et al. 2022)1
Die weitere Analyse ergab, dass nur eine Subgruppe von Kp-Stämmen – die Kp2-Klade – mit CED assoziiert ist. Nun stellte sich die Frage, ob diese Stämme auch die ursächliche Triebkraft für die intestinale Entzündung sind. In der Tat lösten isolierte Kp2-Stämme in CED-suszeptiblen Mäusen spezifisch eine proinflammatorische Antwort aus und verursachten eine Entzündung und schwere Gewebsschädigung des Kolons.
Spezifische Hemmung von Kp2-Stämmen
Prinzipiell könnte eine effiziente Hemmung der CED-assoziierten Kp2-Stämme mit Bakteriophagen gelingen, welche eine hohe Spezifität für Bakterienspezies haben, menschliche Zellen nicht angreifen und daher als sicher gelten, fuhr Elinav fort. Als Problem erweist sich jedoch die hohe Immunogenizität dieser Phagen nach parenteraler Dosierung, die allenfalls eine kurzzeitige Wirkung zulässt. Als Ausweg verfolgte Elinav die orale Gabe der Phagen, um dem Immunsystem weitgehend auszuweichen.
Ein zweites Problem ist die rasche Resistenzentwicklung der Bakterien gegenüber den Phagen. Die Lösung hierfür war die gleichzeitige Anwendung von Phagen mit verschiedenen Rezeptoren und Mechanismen, sodass die Bakterien keine Resistenz erlangen konnten. Es wurde eine Vielzahl von Bakteriophagen (isoliert aus Umweltquellen, z.B. Abwässern) gescreent und schließlich wurden Kombinationen von fünf verschiedenen Phagen identifiziert, die alle verfügbaren Kp2-Stämme ohne Resistenzentwicklung hemmten. Auch in Mäusen, die mit Kp2-Stämmen infiziert wurden, supprimierte eine dieser Phagenkombinationen die Bakterien mit hoher Effizienz.
Schließlich wurde in Mausmodellen der CED gezeigt, dass die mit den Kp2-Stämmen assoziierte Immunantwort in der Darmmukosa durch die Phagenkombination gehemmt werden konnte. Beispielsweise supprimierten die Phagen in dem klassischen Modell der DSS-Kolitis nicht nur den Kp2-Titer, sondern auch die Zytokinantwort (IFNγ, IL-15, IL-17, IL-9) in der Mukosa und verbesserten den histopathologischen Score. In Langzeitstudien über 40 Tage reduzierte die Behandlung mit der Phagenkombination die mit dem Entzündungsmodell verbundene Mortalität signifikant.1
Anwendung beim Patienten
Ex-vivo-Studien zeigten, dass die Phagen durch den niedrigen pH-Wert des Magens inaktiviert werden; durch den Einsatz eines Protonenpumpenhemmers (PPI) konnte dieses Problem jedoch umgangen werden. In einer ersten klinischen Phase-I-Studie erhielten gesunde Probanden den PPI vor und während der oralen Dosierung der Phagenkombination bzw. von Placebo an drei aufeinanderfolgenden Tagen. Die Quantifizierung der fünf Phagen im Stuhl zeigte, dass diese im unteren Gastrointestinaltrakt akkumulierten und persistierten. Ein Off-target-Effekt der Phagenkombination zeigte sich nicht, denn das Profil des Mikrobioms der Probanden blieb unter der Phagenbehandlung erhalten. Da aber bei den gesunden Studienteilnehmern fast keine Kp2-Stämme detektierbar waren, konnte ein Wirksamkeitsnachweis nicht erbracht werden. Eine Studie mit CED-Patienten wird daher der nächste Schritt in der Entwicklung dieser experimentellen Therapie sein.
Ausblick
CED ist nur ein prominentes Beispiel für die Anwendung dieses neuen therapeutischen Konzepts. Auch bei anderen Mikrobiom-assoziierten inflammatorischen Erkrankungen könnten auf die Identifizierung der kausal mit der Krankheit verbundenen Bakterienstämme die schrittweise Generierung von effektiven Phagenkombinationen und deren Prüfung in präklinischen Modellen und schließlich beim Patienten folgen, schlussfolgerte der Experte (Abb. 1).
Neue Therapieform bei Autoimmunerkrankungen
Können Autoimmunkrankheiten geheilt werden? Diese herausfordernde Frage stellte Prof. Dr. Georg Schett vom Universitätsklinikum Erlangen in seinem Vortrag, wobei er auf den systemischen Lupus erythematodes (SLE) als Modellerkrankung fokussierte.
Pathogenese des SLE
SLE ist durch die Ablagerung von Immunkomplexen in verschiedenen Geweben charakterisiert, z.B. in der Haut (Schmetterlingserythem), den Nieren (mit Glomerulonephritis und Niereninsuffizienz als Folge), der Lunge oder dem Herzmuskel.2 SLE beginnt mit der Freisetzung von intranukleärem Material in den extrazellulären Raum (z.B. durch den Tod von Epithelzellen bei einem Sonnenbrand oder durch Bildung von „neutrophil extracellular traps“ bei einer Infektion). Solches Material wird normalerweise vom Immunsystem schnell beseitigt, bedingt durch genetische Defekte jedoch nicht beim SLE, bei dem es daher zur Aktivierung des adaptiven Immunsystems kommt. Über Toll-like-Rezeptoren werden plasmazytoide dendritische Zellen zu einer Typ-I-IFN-Antwort angeregt, und in der Folge werden B- und T-Zellen aktiviert. So kommt es zur Bildung von Antikörpern gegen intranukleäre Antigene und Ablagerung von Immunkomplexen in verschiedenen Organen. Bei SLE-Patienten werden solche Autoantikörper schon Jahre vor dem Ausbruch der Krankheit gebildet.3
Therapie des SLE
Klassisch wird SLE mit Hydroxychloroquin behandelt, welches die Funktion von Neutrophilen dämpft, oder auch mit Immunsuppressiva wie Cyclophosphamid oder Mycophenolat Mofetil (MMF). Auch gegen B-Zellen gerichtete Antikörper (z.B. Belimumab) werden angewendet. Neu zugelassen zur SLE-Therapie ist Anifrolumab, ein Antikörper gegen den Typ-I-IFN-Rezeptor. Doch insgesamt reichen diese Therapien nicht aus, um die Erkrankung zu kontrollieren, und Glukokortikoide werden oftmals benötigt, um eine Remission zu erzielen. Die Wirksamkeit von Rituximab als klassischem B-Zell-depletierendem Antikörper in einer Studie bei SLE-Patienten war enttäuschend.4 Grund hierfür könnte sein, dass Rituximab zwar B-Zellen in der Zirkulation depletiert, nicht jedoch in den sekundären lymphatischen Organen.5
Erste CAR-T-Zell-Therapie
Mit diesen ernüchternden Therapieoptionen im Hintergrund stellte Schett einen Patientenfall vor, der eine bahnbrechende neue Therapiemöglichkeit aufzeigt: Eine 20-jährige SLE-Patientin mit Nephritis, Pleuritis und Endokarditis war gegen das ganze Spektrum verfügbarer Medikamente, die bei SLE eingesetzt werden, refraktär; sie wies extrem hohe Spiegel von Antikörpern gegen doppelsträngige (ds) DNA auf und hatte eine ausgeprägte Proteinurie. In dieser Situation entschied sich Schett dafür, bei der Patientin eine tiefe Depletion der B-Zellen durch „Chimeric antigen receptor“(CAR)-T-Zellen, die gegen das B-Zell-Oberflächenantigen CD19 gerichtet sind, zu versuchen.6 Zur Herstellung der CAR-T-Zellen wurden T-Zellen aus dem peripheren Blut der Patientin gewonnen, mit dem CAR-Transgen transduziert und in vitro expandiert. Die CD19-gerichteten CAR-T-Zellen wurden dann der Patientin einmalig infundiert.
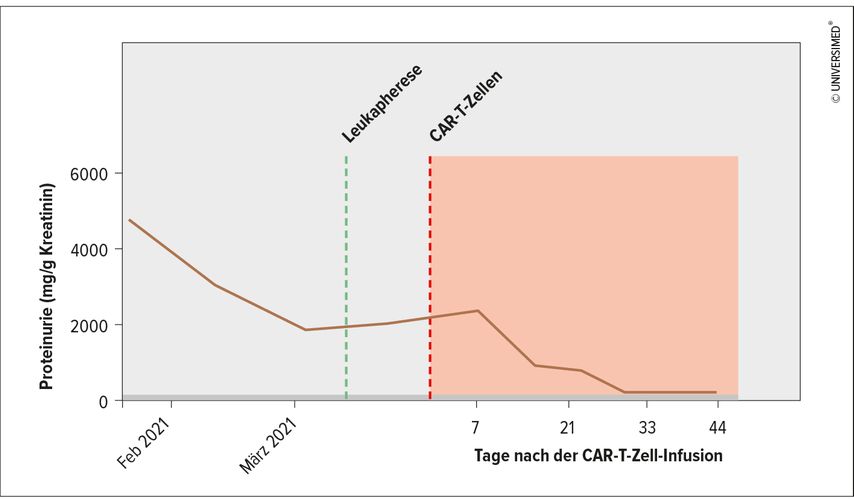
In vivo expandierten die CAR-T-Zellen bis zum Tag 9 massiv, um danach abzunehmen; niedrige Spiegel waren auch nach Monaten noch nachweisbar.6 Die zirkulierenden B-Zellen nahmen nach der CAR-T-Zell-Therapie rasch und nachhaltig ab, und die Anti-dsDNA-Antikörper verschwanden nach 21 Tagen vollständig. Dies war begleitet von einer Normalisierung der Spiegel der Komplementfaktoren C3 und C4 und einem völligen Abklingen der Proteinurie binnen 30 Tagen (Abb. 2).
Abb. 2: Verlauf der Proteinurie bei einer SLE-Patientin vor und nach CD19-CAR-T-Zell-Therapie (modifiziert nach Mougiakakos A et al. 2022)6
Konsistenter Erfolg der CAR-T-Zell-Therapie
Durch diese eindrucksvollen Ergebnisse ermutigt wurden in der Folge fünf weitere SLE-Patienten mit einem Transfer von CD19-CAR-T-Zellen behandelt.7 Es zeigte sich eine konsistente und stabile Expansion der Zellen in vivo, und hervorragende klinische Ergebnisse wurden erzielt: Normalisierung der Komplementspiegel, Rückgang der Proteinurie, Abnahme der dsDNA-Antikörper sowie der Fatigue als Hauptsymptom der Erkrankung. Fast alle Autoantikörper gegen verschiedene nukleäre Antigene waren nach der CAR-T-Zell-Therapie auf normale Spiegel abgesunken, wohingegen diverse Impftiter stabil geblieben waren (vermutlich, weil diese von langlebigen CD19-negativen Plasmazellen im Knochenmark stammen). Die CD19-CAR-T-Zell-Therapie eliminiert somit selektiv die pathogenen, nicht aber die protektiven Antikörper.
Die durch die Therapie zunächst vollständig depletierten B-Zellen kehrten nach ca. 100 Tagen wieder in die Zirkulation zurück. Hierbei handelte es sich jedoch ausschließlich um naive B-Zellen, nicht um Gedächtniszellen. Daher kehrte die Krankheit nicht zurück, und ein Ausbleiben neuer B-Zell-Antworten (z.B. auf eine Impfung) ist nicht zu befürchten, wie Schett erklärte. Während der bisherigen Nachverfolgungszeit der fünf Patienten(3 bis 15 Monate) blieben die SLE-Aktivität und die dsDNA-Antikörpertiter auf null. Auch die oben besprochene erste Patientin ist seit 600 Tagen nach der Infusion in vollständiger Remission und bedarf keiner weiteren Behandlung.
Die Verträglichkeit der CAR-T-Zell-Therapie war gut. Es gab kein höhergradiges Zytokinfreisetzungssyndrom. Die Therapie war von Fieber während der ersten vier Tage und von einem Anstieg des C-reaktiven Proteins begleitet, was leicht kontrollierbar war.
Fazit und Ausblick
Diese Studien zeigen, dass die CAR-T-Zell-Therapie bei Autoimmunerkrankungen durchführbar ist und im Falle des SLE zu nachhaltigem Verschwinden von pathogenen B-Zellen, Anti-dsDNA-Antikörpern und der SLE-Symptomatik führt. Immunsuppressive Medikamente konnten abgesetzt werden. Die B-Zellen kehrten zwar in die Zirkulation zurück, was aber nicht zu einem Rückfall führte.
Wird dieser Erfolg der CAR-T-Zell-Therapie bei anderen Autoimmunerkrankungen wiederholbar sein? Ein sehr gutes Ansprechen auf diese Therapieform wurde auch bei einem ersten Patienten mit refraktärer Autoimmunmyositis (Antisynthetase-Syndrom) erzielt, wie von Schett kürzlich publiziert.8 Auch noch unveröffentlichte Resultate der ersten CAR-T-Zell-Behandlung eines Patienten mit systemischer Sklerose sind vielversprechend. Es eröffnet sich somit durch die CAR-T-Zellen eine neue Ära im Management der Autoimmunerkrankungen, zumindest für einige von ihnen. Ein Potenzial für diese Therapie sieht Schett vor allem auch bei entzündlichen Erkrankungen des Nervensystems und auch bei Erkrankungen des Gastrointestinaltrakts mit Autoimmunkomponenten.
Infektion, Immunität und die Leber: Fortschritte und Durchbruch
Prof. Dr. Michael Manns, Medizinische Hochschule Hannover, unterstützte in seinem Vortrag einen Paradigmenwechsel in der Hepatologie: weniger Fokus auf das Endstadium der Lebererkrankungen, mehr Forschung zu frühen Stadien und zur Prävention.9 Grund hierfür ist, dass die Mortalität durch Lebererkrankungen in den letzten Dekaden zugenommen hat, mit zwei Dritteln der Todesfälle bei Menschen unter 60 Jahren. Neben der Virushepatitis sind Alkoholabusus und Adipositas häufige Ursachen. Anhand eines berühmten Patientenfalls illustrierte Manns die Problematik: Ludwig van Beethoven starb im Alter von 57 Jahren an Leberzirrhose – wie man erst seit Kurzem weiß, aufgrund einer Hepatitis-B-Infektion zusätzlich zu übermäßigem Alkoholkonsum.10 Darüber hinaus hatte er ein erhöhtes genetisches Risiko für Lebererkrankungen.
Die Klassifikation der chronischen Hepatitis hat sich in den letzten 60 Jahren gewandelt: Anfangs unterteilte man aufgrund der Histopathologie in persistente vs. aggressive Hepatitis.11 Nach der Entdeckung der Hepatitisviren B–E (HBV, HCV, HDV, HEV) und der Charakterisierung der Autoimmunhepatitis teilte man die Hepatitiden 1994 in virale und autoimmune Hepatitis ein.12
Virale Hepatitiden
Manns gab einen Überblick über den Stand der Dinge bezüglich der viralen Hepatitiden:
Hepatitis C ist mit einer großen Erfolgsgeschichte verbunden.13 Seit 2001 war pegyliertes IFN plus Ribavirin der Therapiestandard; er wurde ab 2013 durch Substanzen, die gezielt die HCV-Replikation hemmen, abgelöst. Heute kann damit in über 95% der Fälle eine Heilung der Hepatitis C bewirkt werden, und die Zahl der Lebertransplantationen wegen dieser Erkrankung hat drastisch abgenommen.
Für Hepatitis B gibt es eine prophylaktische Impfung, jedoch ist diese in den meisten Ländern Afrikas, in denen das Risiko am höchsten ist, nicht implementiert.14 Es gibt medikamentöse Therapien (Nukleosid/Nukleotid-Analoga), die HBV komplett supprimieren und das Risiko für HBV-assoziierte Leberkarzinome senken.15 Eine komplette Heilung ist wegen der Integration von HBV ins Wirtsgenom nicht möglich; doch wenn es zusätzlich zur Hemmung der Virusreplikation gelingt, die Expression des Oberflächenantigens von HBV komplett zu verhindern, kommt das einer „funktionellen Heilung“ gleich. Es gibt viele neue therapeutische Ansätze in verschiedenen klinischen Phasen der Entwicklung, um dieses Ziel zu erreichen. Besonders aussichtsreich sind Antisense-Oligonukleotide mit TLR(„toll-like receptor“)-Aktivität (z.B. Bepirovirsen)16 und die Kombination von siRNA mit Immuntherapien.
HDV benötigt zu seiner Replikation eine Koinfektion mit HBV. Eine IFN-Therapie erreicht in nur etwa 25% der Fälle eine Beseitigung der viralen RNA.17 Verlängerte IFN-Behandlung oder Hinzufügen von HBV-supprimierender Therapie ergaben keine Verbesserung.17, 18 Bulevirtid, ein Inhibitor der Aufnahme von HBV und HDV, zeigte in einer Phase-III-Studie nach 48 Wochen bei ca. 50% der Patienten mit Hepatitis D eine Normalisierung der Alanin-Aminotransferase (ALT);19 es erhielt 2020 eine Zulassung bei dieser Erkrankung, muss allerdings dauerhaft subkutan verabreicht werden. Darüber hinaus scheint die Kombination von antiviraler und immunmodulierender Therapie aussichtsreich zu sein.
Hepatitis E ist in Asien verbreitet, doch chronische Fälle werden bei immunkompromittierten Patienten zunehmend auch in Europa beobachtet.
Die chronische Hepatitis kann zum hepatozellulären Karzinom (HCC) führen. Neben der Hepatitis B ist in der westlichen Welt zunehmend die nichtalkoholische Steatohepatitis (NASH) Ursache des HCC. HCC wird heute mit Checkpoint- und VEGF-Inhibitoren behandelt, wobei der Therapieerfolg beim HCC aufgrund einer viralen Hepatitis größer zu sein scheint als beim HCC infolge einer Fettleber.
Autoimmunhepatitis
Die Autoimmunhepatitis (AIH) ist durch ein Ungleichgewicht der Immunregulation bei genetisch prädisponierten Personen bedingt, das durch Umweltfaktoren (Infektion, Toxine etc.) verstärkt wird, fuhr Manns fort. Bei der AIH liegt ein heterogenes Spektrum von Autoantikörpern vor.
Therapiestandard sind Steroide mit und ohne Azathioprin.20 Das Problem ist, dass nur 50% der Patienten mit dieser Behandlung eine ALT-Normalisierung erreichen und selbst diese im Laufe der Jahre eine Leberzirrhose entwickeln. Zweitlinientherapien sind noch nicht zugelassen; derzeit wird MMF oder Tacrolimus eingesetzt. Als experimentelle Therapien können auch Biologika verwendet werden, darunter B-Zell-gerichtete Anti-CD20- (Rituximab) oder Anti-BAFF-Rezeptor-Antikörper (VAY736). Für VAY736 (Lanalumab) läuft zurzeit eine prospektive Studie bei AIH-Patienten (NCT03217422).
Fazit
Während einige entzündliche Lebererkrankungen heute gut behandelt werden können – mit der hohen Heilungschance bei Hepatitis C als prominentem Beispiel –, gibt es bei anderen noch große Defizite – insbesondere bei AIH und Hepatitis D.
CED-Therapie: gestern, heute und morgen
Ein Blick zurück
Vor 10 Jahren waren die Anti-TNF-Biologika und ihre Biosimilars bereits fester Bestandteil der CED-Therapie, und 2014 kam mit dem Anti-Integrin Vedolizumab ein Antikörper mit neuem Wirkprinzip hinzu. Wie Prof. Dr. Séverine Vermeiere, Universitätsklinikum Leuven, Belgien, ausführte, waren die Gastroenterologen sehr zufrieden, nun endlich potente Medikamente zu haben, die das Leben der Patienten verbesserten. Jetzt wurde die Heilung der Mukosa das neue Therapieziel, denn man konnte zeigen, dass endoskopische Heilung den Lauf der Krankheit ändert.21 Während die ersten Anti-TNF-Therapien noch basierend auf klinischem Ansprechen zugelassen worden waren, wurden später Endoskopie und Histologie zum Studienendpunkt. Auch in der klinischen Routine ist die Endoskopie wesentlich für Behandlungsbeginn und Verlaufskontrolle geworden. Man lernte somit, die Entzündung zu behandeln, nicht nur die Symptome der CED.
Die heutige Situation
In den letzten zehn Jahren sind weitere Biologika zugelassen worden, darunter auch Inhibitoren von IL-23 bzw. IL-12/IL-23. Weiters sind nun auch zwei Klassen von niedermolekularen Substanzen verfügbar geworden (JAK-Inhibitoren und S1P-Modulatoren). Die Zahl der Medikamente hat also zugenommen, doch ein Vergleich aller Studien zeigt, dass mit keinem eine Remissionsrate von 30% überschritten wird, gab Vermeiere zu bedenken.22 Problematisch sei zudem, dass nicht immer das erste für einen Patienten gewählte Medikament das richtige ist, denn prädiktive Biomarker, die diese Wahl leiten könnten, fehlen derzeit; auch sinken die Chancen für eine Remission mit jeder weiteren Therapielinie. Ein weiteres nicht unerhebliches Problem sind die Kosten der neuen Therapien.
Die Zukunft
Wie sieht die CED-Therapie in zehn Jahren aus? Vermeiere sagt voraus, dass es zukünftig möglich sein wird, früh und effizient mit der Behandlung zu beginnen – bei dem richtigen Patienten und mit der richtigen Therapie. Auch werden Kombinationen von Wirkstoffen Bedeutung erlangen; erste Studien mit Biologika zweier verschiedener Wirkklassen (Anti-TNF und Anti-IL-23) sind unterwegs. Durch solche Kombinationen könnte die Remissionsrate auf z.B. 60% steigen, doch eine Remission bei fast jedem Patienten zu erreichen wird vermutlich auch damit nicht möglich sein.
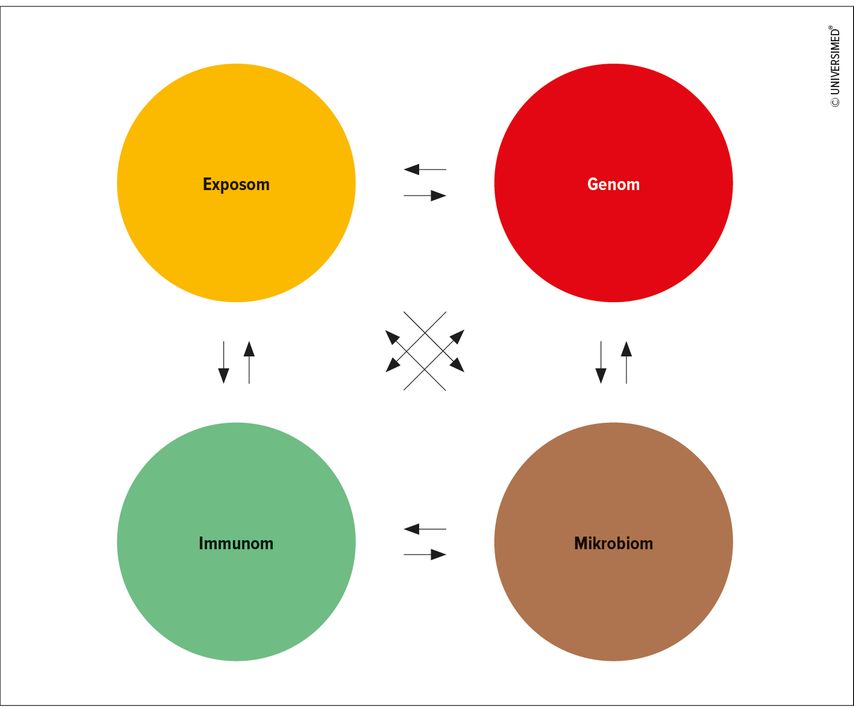
Vermeiere betonte, dass derzeit zwar die immunologische Komponente der CED-Pathogenese mit den verfügbaren Medikamenten adressiert wird, die Einflüsse von Mikrobiom, Diät und Umweltfaktoren aber ignoriert werden. Nur wenn auch diese Faktoren in der Therapie berücksichtigt würden, sind Remissionsraten >90% denkbar (Abb. 3). Eine Vielzahl von Studien, die z.B. die Effekte von Biologika im Zusammenspiel mit verschiedenen Diäten untersuchen, sind in der Pipeline.
Abb. 3: Zusammenspiel von Einflussfaktoren, die für eine CED-Therapie mit hoher Remissionsrate berücksichtigt werden müssen (modifiziert nach Vortrag Prof. Vermeiere)
Zukünftig werden anspruchsvollere Endpunkte breitere Anwendung finden, z.B. die umfassende Remission (d.h. klinisch und endoskopisch/histologisch). Solch eine „disease clearance“ ist auch heute schon in der klinischen Praxis erreichbar, jedoch nur bei rund einem Fünftel der Patienten.23 Des Weiteren könnten die Heilung der intestinalen Barriere, gemessen mittels konfokaler Endomikroskopie,24 und die molekulare Heilung neue Endpunkte zur Vorhersage einer dauerhaften Remission werden.
Der Traum wäre, Biomarker zu haben, die eine personalisierte Therapie der CED ermöglichen. Vermeiere hält es für realistisch, in der Zukunft Signaturen zu finden, die ein Ansprechen auf bestimmte Wirkstoffklassen vorhersagen.
Bei der CED besteht zudem ein hoher medizinischer Bedarf hinsichtlich der Fibrose, die kaum behandelt werden kann und die den wichtigsten Grund für Operationen darstellt. Auch fehlt es an Möglichkeiten, ein postoperatives Rezidiv vorherzusagen. Zusätzlich sind perianale Fisteln, eine schlimme Komplikation beim MC, sehr schwer zu behandeln. Diese drei Problemfelder sollten daher einen Schwerpunkt der künftigen Forschung darstellen, schloss die Expertin.
Quelle:
Ausgewählte Vorträge des ÖGGH-Symposiums „Sixty Years of Inflammation“ zu Ehren von Univ.-Prof. Dr. Herbert Tilg am 21.April 2023 in Innsbruck-Igls
Literatur:
1 Federici S et al.: Cell 2022; 185: 2879-2898.e24 2 Wener MH: In: Systemic Lupus Erythematosus (G. Tsokos, ed.). Academic Press 2020 3 Arbuckle MR et al.: N Engl J Med 2003; 349: 1526-33 4 Merrill JT et al.: Arthritis Rheum 2010; 62: 222-33 5 Kamburova EG et al.: Am J Transplant 2013; 13: 1503-11 6 Mougiakakos D et al.: N Engl J Med 2021; 385: 567-9 7 Mackensen A et al.: Nat Med 2022; 28: 2124-32 8 Müller F et al.: Lancet 2023; 401: 815-8 9 Karlsen TH et al.: Lancet 2022; 399: 61-116 10 Begg TJA et al.: Curr Biol 2023; 33: 1431-47.e22 11 De Groote J et al.: Lancet 1968; 2:626-8 12 Desmet VJ et al.: Hepatology 1994; 19: 1513-20 13 Manns MP et al.: Nat Rev Dis Primers 2017; 3:17006 14 Spearman CW et al.: Lancet Gastroenterol Hepatol 2017; 2: 900-9 15 Yip TC et al.: J Hepatol 2019; 70: 361-70 16 Yuen MF et al.: N Engl J Med 2022; 387: 1957-68 17 Wedemeyer H et al.: N Engl J Med 2011; 364: 322-31 18 Wedemeyer H et al.: Lancet Infect Dis 2019; 19: 275-86 19 Wedemeyer H et al.: International Liver Congress 2022; Abstract #GS006 20 Mack CL et al.: Hepatology 2020; 72: 671-722 21 Frøslie KF et al.: Gastroenterology 2007; 133: 412-22 22 Alsoud D et al.: Lancet Gastroenterol Hepatol 2021; 6: 589-95 23 D‘Amico F et al.: United European Gastroenterol J 2022; 10: 775-82 24 Rath T et al.: Gastroenterology 2023; 164: 241-55
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Transition bei CED: Fallbeispiel für einen strukturierten Übergang
Die Transition bei chronisch-entzündlichen Darmerkrankungen stellt eine wichtige Brücke zwischen Jugendlichen und Erwachsenen dar und birgt einige Herausforderungen. Am ...