Endoskopische Blickdiagnose: Schlüssel zu Dysplasien und Frühkarzinomen
Autorin:
Dr. Rebecca Marion Trattnig
Klinik für Allgemein- und Viszeralchirurgie
Kepler Universitätsklinikum Linz
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Blickdiagnosen sind ein zentrales Element der endoskopischen Beurteilung und erfordern geschulte visuelle Kompetenz, Erfahrung und systematisches Vorgehen. Trotz technologischer Fortschritte bleibt die präzise visuelle Einschätzung durch den Endoskopiker unverzichtbar. Besonders bei der Erkennung von Dysplasien und Frühkarzinomen im Ösophagus und Magen ist die differenzierte optische Beurteilung essenziell für eine frühzeitige und zielgerichtete Therapie.
Keypoints
-
Blickdiagnosen bleiben trotz KI und moderner Bildgebung unverzichtbar für die frühe Tumorerkennung im oberen GI-Trakt.
-
Standardisierte Klassifikationen verbessern die diagnostische Sicherheit und die interdisziplinäre Kommunikation.
-
KI unterstützt, ersetzt aber nicht die endoskopische Expertise – strukturierte Ausbildung bleibt unverzichtbar.
Die endoskopische Diagnostik unterliegt einem kontinuierlichen Wandel, getrieben durch technologische Innovationen und wachsende Anforderungen an diagnostische Präzision. Die visuelle Einschätzung endoskopischer Befunde – die sogenannte Blickdiagnose – bleibt trotz zunehmender technischer Unterstützung durch moderne Bildgebungstechniken und Integration künstlicher Intelligenz (KI) ein zentrales Element in der Detektion präneoplastischer und neoplastischer Veränderungen, insbesondere im oberen Gastrointestinaltrakt.
Die einfache Durchführung einer Gastroskopie ist überholt – es wird eine strukturierte, risikoadaptierte und morphologisch präzise Untersuchung erwartet. Insbesondere die Detektion früher neoplastischer Läsionen im Ösophagus und Magen erfordert eine differenzierte visuelle Beurteilung. Entsprechend steigt der Anspruch an die endoskopische Expertise. Hochauflösende Bildgebung, virtuelle Chromoendoskopie und standardisierte Klassifikationen bilden heute die Grundlage für eine strukturierte optische Befundung, insbesondere bei Risikopatienten.
Mit technologischem Fortschritt und Aufkommen KI-basierter Diagnostikmodule rückt die Fähigkeit zur fundierten optischen Beurteilung erneut in den Fokus, um diese Unterstützungssysteme verantwortungsvoll in die klinische Entscheidungsfindung einzubetten.1
Von der Makroskopie zur Mikroskopie
Die optische Diagnostik in der oberen gastrointestinalen (GI) Endoskopie erfolgt idealerweise nach einem strukturierten, stufenweisen Vorgehen – von der makroskopischen Standardbeurteilung bis hin zur mikroskopisch anmutenden Bildanalyse mit modernen digitalen Verfahren.2 Die Weißlichtendoskopie bleibt als Grundlage zur Einordnung superfizieller Läsionen anhand ihres Wachstumsverhaltens mit Implikationen für das Invasionsrisiko und die Resektabilität weiterhin der Ausgangspunkt.3 Ergänzend verbessern virtuelle Chromoendoskopie-Techniken, wie z.B. „narrow-band imaging“ (NBI) oder i-Scan, die Darstellung vaskulärer und mukosaler Muster und ermöglichen eine präzise Charakterisierung suspekter Läsionen.4 Insbesondere in Kombination mit Klassifikationssystemen verbessert sich hiermit die diagnostische Treffsicherheit bei Dysplasien und Frühkarzinomen.5 Strukturierte Bildanalyse und Klassifikationen fördern nicht nur die Detektionsrate, sondern auch die konsistente Kommunikation zwischen Endoskopiker und Pathologie – essenziell für eine adäquate Therapieentscheidung.6–8
Die Europäische Gesellschaft für Gastrointestinale Endoskopie (ESGE) und auch ein Positionspapier der World Endoscopy Organization unterstreichen die Bedeutung der Untersuchungsstandards zur optimalen Beurteilung des oberen Gastrointestinaltrakts. Beispielsweise wird als qualitätssichernde Maßnahme neben adäquaten Inspektionszeiten (mind. 7 Minuten pro Gastroskopie, mind. 1 Minute pro Zentimeter bei Barrett-Ösophagus) auch die Verwendung standardisierter Dokumentation und Terminologie gefordert.2,9
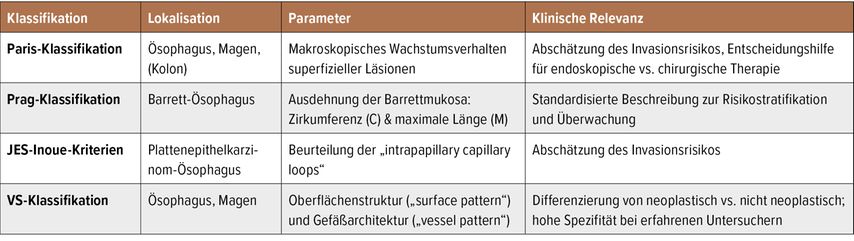
Häufig verwendete Klassifikationen zur Beschreibung von meta-, dys- und (prä-)neoplastischen Läsionen in Ösophagus und Magen umfassen neben der Paris-Klassifikation auch die Prag-Klassifikation, die JES-Inoue-Kriterien und die VS-Klassifikation (Tab.1).
Tab. 1: Überblick über validierte Dys-/Neoplasie-relevante Klassifikationen in der Endoskopie des oberen Gastrointestinaltrakts
Ösophagus
Die endoskopische Frühdiagnostik neoplastischer Veränderungen im Ösophagus stellt trotz technischer Fortschritte weiterhin eine klinische Herausforderung dar. Besonders beim Barrett-Ösophagus ist die visuelle Differenzierung zwischen nicht dysplastischer Schleimhaut, Low-Grade-Dysplasien (LGD) und Frühkarzinomen anspruchsvoll. Während sich das Seattle-Protokoll mit Vierquadranten-basierten Biopsien als Goldstandard etablierte,10 zeigen neuere Studien, dass gezielte Biopsien auf Basis optisch auffälliger Areale – insbesondere unter Nutzung von NBI oder vergleichbaren Verfahren – eine höhere diagnostische Ausbeute bei gleichzeitig reduziertem Probenumfang ermöglichen.
Die Surveillance bei Vorliegen eines Barrett-Ösophagus erfordert eine hochauflösende Endoskopie mit entsprechender Fotodokumentation sowie konsequenter Angabe der Prag-Klassifikation und Paris-Klassifikation (bei suspekten Arealen, mit Anzahl und Lokalisation in Zentimeter ab Zahnreihe). Biopsien sollten, in separaten Gefäßen, an allen umschriebenen Veränderungen und gemäß dem Seattle-Protokoll entnommen werden. Bei Patienten mit einer sichtbaren, suspekten Läsion oder Dysplasienachweis sind eine Referenzpathologie und die Überweisung in ein spezialisiertes Zentrum indiziert. Bei nicht dysplastischem Barrettösophagus orientieren sich die Surveillance-Intervalle an der maximalen Ausdehnung nach oral (1–3cm: alle 5 Jahre, 3–10cm: alle 3 Jahre, >10cm: ad Zentrum).11
Auch bei Plattenepithel-Neoplasien des Ösophagus gewinnt die optische Diagnose zunehmend an Bedeutung, insbesondere in Hochrisikogebieten. Die Lugol-Chromoendoskopie gilt nach wie vor als hochsensitiv für die Detektion von Dysplasien. NBI mit erweiterten Klassifikationen (z.B. JES-Inoue-Kriterien) erlaubt eine differenzierte, morphologische Beurteilung. Charakteristisch für dysplastische Areale sind unregelmäßige, punktförmige oder schleifenförmige Kapillaren mit zentraler Depression und klarer Abgrenzung zur umgebenden Mukosa.12 Aufgrund der Epidemiologie sind Screenings nur in Hochrisikogebieten Asiens effektiv.13
Magen
Besonders die Detektion von Magenatrophie und intestinaler Metaplasie – den entscheidenden Risikofaktoren für die Entwicklung von Magenkarzinomen – gewinnt durch standardisierte Bewertungssysteme wie OLGA (Operative Link on Gastritis Assessment) und OLGIM (Operative Link on Gastric Intestinal Metaplasia Assessment) zunehmend an klinischer Bedeutung.14,15 Hochauflösende Endoskopie in Kombination mit virtueller Chromoendoskopie wurde Voraussetzung für eine endoskopiebasierte Stadieneinteilung zur Behandlung präneoplastischer Veränderungen im Magen. Diese lassen sich unter Weißlicht häufig durch blassere, transluzente Schleimhautareale mit sichtbaren subepithelialen Gefäßen identifizieren. Die Verwendung von bildverstärkenden Verfahren wie NBI verbessert die Detektion intestinaler Metaplasie signifikant.16,17 Typische Muster wie „light blue crest“ oder „white opaque substance“ unter NBI sind prädiktiv für intestinale Metaplasie und damit assoziierte Frühneoplasien.18,19 Biopsien werden entsprechend dem Sydney-Protokoll empfohlen.2,20
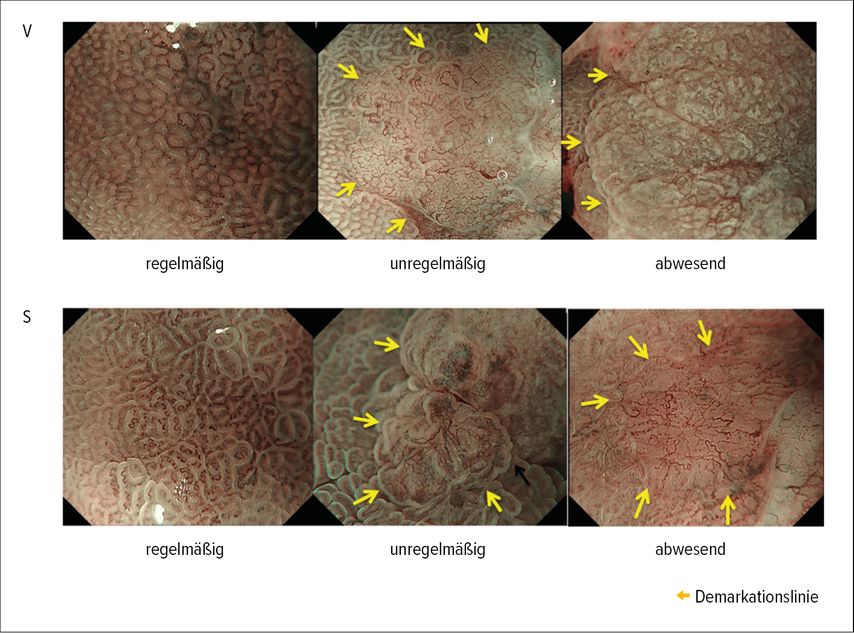
Bei der Erkennung früher Magenkarzinome kommt der makroskopischen Beurteilung nach der Paris-Klassifikation eine entscheidende Rolle zu. Flache (Typ 0–IIb) oder leicht eingesenkte (Typ 0–IIc) Läsionen, oft nur subtil von der umgebenden Schleimhaut abweichend, erfordern besondere Aufmerksamkeit. Unter NBI erlauben die MESDA(Magnifying Endoscopy Simple Diagnostic Algorithm)-Guidelines 21 sowie die Yao-Kriterien22 eine standardisierte Einschätzung suspekter Areale auf Basis mikrovaskulärer und mikroskopischer Muster. Ein irreguläres vaskuläres Netzwerk, Verlust der Oberflächenstruktur und Demarkationslinien (Abb.1) gelten als hochverdächtig für Neoplasien und sollten gezielt biopsiert oder reseziert werden. In der Praxis entscheidet die Qualität der Blickdiagnose damit zunehmend über die adäquate therapeutische Strategie.8,23
Abb. 1: VS-Klassifikation: Die Gefäßarchitektur (V) und die Oberflächenstruktur (S) werden als regelmäßig/unregelmäßig/abwesend klassifiziert; die Pfeile weisen auf die Demarkationslinie (modifiziert nach Yao K et al. 2020)22
Blickdiagnose im Wandel? Expertise versus künstliche Intelligenz
Die Integration von Assistenzsystemen in klinische Anwendungen hat in der Endoskopie bereits festen Fuß gefasst. Eine Vielzahl von Studien beschäftigt sich bereits mit Deep-Learning-Modellen und KI-Assistenzsystemen zur Detektion von Dysplasien oder (Prä-)Kanzerosen im oberen Gastrointestinaltrakt. Die Rolle von solchen KI-gestützten Assistenzprogrammen im klinischen Alltag bleibt jedoch (noch) Gegenstand der Forschung. Ein Trend zur Verbesserung der Detektionsraten, auch für erfahrene Endoskopiker, lässt sich mit zunehmend komplexen und präzisen programmierten Modellen erkennen.24 Erfahrene Endoskopiker werden in Zukunft eine gestaltende Rolle einnehmen müssen, um die Integration der sich rasch ankündigenden technologischen Neuerungen, insbesondere KI-gestützter Systeme, in den klinischen Alltag und die Patientenversorgung zu optimieren.
Die solide Grundlage für die fachgerechte Beurteilung und das Erfassen von Blickdiagnosen wird somit weiterhin die Expertise des Untersuchers bleiben. Diese fundierte endoskopische Erfahrung setzt fundiertes Training, morphologische Sicherheit sowie klinisches Urteilsvermögen voraus. Die ESGE bietet mit einem rezenten Positionspapier zur Ausbildung in der Endoskopie,25 Kursangeboten und einer eLearning Academy der Bedeutung der strukturierten Ausbildung eine Plattform. Im nationalen Setting werden Hands-on-Kurse und Onlineressourcen seitens der Österreichischen Gesellschaft für Gastroenterologie und Hepatologie (ÖGGH) wie auch der Österreichischen Gesellschaft für Chirurgie bzw. des Berufsverbandes Österreichischer Chirurgen angeboten. In der heutigen Endoskopie bleibt die Fähigkeit zur präzisen Blickdiagnose als Zusammenspiel von Erfahrung, systematischer Beurteilung und technologischer Unterstützung eine Schlüsselkompetenz mit unmittelbaren Konsequenzen für Patientenmanagement und Langzeitprognose.
Literatur:
1 Popovic D et al.: The importance of artificial intelligence in upper gastrointestinal endoscopy. Diagnostics (Basel). 2023; 13(18): 2862 2 Bisschops R et al.: Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy 2016; 48(9): 843-64 3 The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003; 58(6): 3-43 4 Yao K, Iwashita A: Diagnosis of early gastric cancer: endoscopic diagnosis and classification: VS classification system for the diagnosis of early gastric cancer by magnifying endoscopy. In: Chiu PWY (Hrsg.) et al.: Endoscopy in Early Gastrointestinal Cancers. Singapur: Springer, 2021 5 Hirai R et al.: Endoscopic evaluation by the Kyoto classification of gastritis combined with serum anti-Helicobacter pylori antibody testing reliably risk-stratifies subjects in a population-based gastric cancer screening program. J Gastroenterol 2023; 58(9): 848-55 6 Toyoshima O et al.: Endoscopy-based Kyoto classification score of gastritis related to pathological topography of neutrophil activity. World J Gastroenterol 2020; 26(34): 5146-55 7 Kawamura M et al.: Kyoto classification risk scoring system and endoscopic grading of gastric intestinal metaplasia for gastric cancer: multicenter observation study in Japan. Dig Endosc 2022; 34(3): 508-16 8 Yao K et al.: Diagnostic criteria for early gastric cancer: current consensus and future perspectives. Dig Endosc 2020; 32(4): 543-60 9 Emura F et al.: Principles and practice to facilitate complete photodocumentation of the upper gastrointestinal tract: World Endoscopy Organization position statement. Dig Endosc 2020; 32(2): 168-79 10 Wani S, Gaddam S: Editorial: best practices in surveilance of barrett’s esophagus. Am J Gastroenterol 2017; 112(7): 1056-60 11 Weusten B et al.: Endoscopic management of Barrett’s esophagus: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy 2017; 49(2): 191-8 12 Inoue H et al.: Magnification endoscopy in esophageal squamous cell carcinoma: a review of the intrapapillary capillary loop classification. Ann Gastroenterol 2015; 28(1): 41-8 13 Domper Arnal MJ et al.: Risk factors, screening and endoscopic treatment in Western and Eastern countries. World J Gastroenterol 2015; 21(26): 7933-43 14 Rugge M et al.: OLGA gastritis staging for the prediction of gastric cancer risk: a long-term follow-up study of 7436 patients. Am J Gastroenterol 2018; 113(11): 1621-8 15 Lee JWJ et al.: Severity of gastric intestinal metaplasia predicts the risk of gastric cancer: a prospective multicentre cohort study (GCEP). Gut 2022; 71(5): 854-63 16 Kaise M: Advanced endoscopic imaging for early gastric cancer. Best Pract Res Clin Gastroenterol 2015; 29(4): 575-87 17 Matsuo K et al.: Diagnosis of early gastric cancer using narrow band imaging and acetic acid. World J Gastroenterol 2015; 21(4): 1268-74 18 Miyaoka M et al.: Diagnosis of early gastric cancer using image enhanced endoscopy: a systematic approach. Transl Gastroenterol Hepatol 2020; 5: 50 19 Kawamura M et al.: Endoscopic and histological risk stratification for gastric cancer using gastric intestinal metaplasia. J Gastroenterol Hepatol 2024; 39(9): 1910-6 20 Banks M et al.: British Society of Gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma. Gut 2019; 68(9): 1545-75 21 Muto M et al.: Magnifying endoscopy simple diagnostic algorithm for early gastric cancer (MESDA-G). Dig Endosc 2016; 28(4): 379-93; Erratum in: Dig Endosc 2016; 28(5): 630 22 Yao K et al.: Guidelines for endoscopic diagnosis of early gastric cancer. Dig Endosc 2020; 32(5): 663-98 23 Tziatzios G et al.: Endoscopic grading and sampling of gastric precancerous lesions: a comprehensive literature review. Curr Oncol 2024; 31(7): 3923-38 24 Fockens KN et al.: A deep learning system for detection of early Barrett’s neoplasia: a model development and validation study. Lancet Digit Health 2023; 5(12): e905-e16 25 Antonelli G et al.: Training in basic gastrointestinal endoscopic procedures: a European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Gastroenterology and Endoscopy Nurses and Associates (ESGENA) position statement. Endoscopy 2024; 56(2): 131-50
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Transition bei CED: Fallbeispiel für einen strukturierten Übergang
Die Transition bei chronisch-entzündlichen Darmerkrankungen stellt eine wichtige Brücke zwischen Jugendlichen und Erwachsenen dar und birgt einige Herausforderungen. Am ...