Biofilme bei Reizdarmsyndrom und chronisch-entzündlichen Darmerkrankungen
Autor:
Dipl.-Ing. Dr. Maximilian Baumgartner
Klinische Abteilung für Gastroenterologie und Hepatologie
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Endoskopisch sichtbare Biofilme visualisieren Störungen im Gallensäuren-Metabolismus und beeinflussen die Mikrobiota von Patient*innen mit Reizdarmsyndrom und chronisch-entzündlichen Darmerkrankungen. Ihr Nachweis könnte die Krankheitsklassifikation erweitern und neue individuelle Therapiemöglichkeiten eröffnen.
Keypoints
-
Bakterielle Biofilme werden mit Infektionen der Gallengänge, des Magens und der Blase sowie mit Darmkrebs in Zusammenhang gebracht.
-
Eine Studie untersuchte den Biofilm auf der Darmmukosa mit Darmspiegelung im Übergang von Dick- zuDünndarm.
-
Membranartige Auflagerungen kamen bei mehr als der Hälfte der RDS- und bei über einem Drittel der CED-Patient*innen vor.
-
Die Biofilme korrelierten mit einer verminderten bakteriellen Diversität, einem gestörten Gallensäuren-Metabolismus und erhöhten Entzündungsparametern.
Die Inzidenz von das Verdauungssystem betreffenden Erkrankungen nimmt weltweit zu. In Industriestaaten leidet heute schon jede Zehnte an einer funktionellen Darmerkrankung wie etwa dem Reizdarmsyndrom (RDS). Schätzungen gehen davon aus, dass 2030 auch die Prävalenz von chronisch-entzündlichen Darmerkrankungen (CED) in mehreren Ländern über 1% liegen wird. Durch die zunehmende Industrialisierung steigt die Inzidenz von gastrointestinalen Erkrankungen im 21. Jahrhundert auch in Entwicklungsländernrasch.
Einfluss des Mikrobioms
Bei der Entstehung dieser multifaktoriellen Erkrankungen spielen neben Umweltfaktoren und einer gewissen genetischen Prädisposition auch das Immunsystem und das bakterielle Ökosystem im Darm (Mikrobiota) eine entscheidende Rolle. Als Umweltfaktor kommt vor allem ein westlicher Lebensstil mit zunehmendem Antibiotikakonsum und bakterienschädigenden Nahrungszusatzstoffen infrage.
Der Einfluss des Mikrobioms wird vor allem auch dadurch bestätigt, dass die Transplantation von gesundem Stuhl zu einer dauerhaften Symptomlinderung bei manchen RDS- und CED-Patient*innen führen kann. Woran es liegt, dass manche Patient*innen auf solch eine Therapie ansprechen und andere nicht, wird noch diskutiert. Es scheinen aber die Zusammensetzung und „funktionelle Kapazität“ der bakteriellen Gene sowohl bei Empfänger*innen als auch Spender*innen eine Rolle zu spielen.
Die Mikrobiomforschung hat sich in den letzten Jahren vor allem auf die relative Zusammensetzung der Bakterienpopulation und ein vermehrtes bzw. vermindertes Vorkommen einzelner „Bakterienarten“, Metaboliten oder auch Gene fokussiert. Der Großteil der durchgeführten Studien wurde zusätzlich mittels relativ einfach zu sammelnder Stuhlproben durchgeführt.
Studie zur Biofilmbildung
In der 2021 im Journal „Gastroenterology“ erschienenen Studie „Mucosal biofilms are an endoscopic feature of irritable bowel syndrome and ulcerative colitis“ haben wir uns mit der Bildungbakterieller Biofilme auseinandergesetzt.
Bakterielle Gemeinschaften betten sich dabei in eine komplexe extrazelluläre Matrix ein und verwenden diese Wachstumsart, um sich zu schützen und dadurch einen Wachstumsvorteil zu erzielen. Dies erlaubt einzelnen Bakterien, sich zu spezialisieren und Nahrung sowie Botenstoffe miteinander zu teilen. Tatsächlich ist die Biofilmbildung die bevorzugte Wachstumsart von Bakterien in nahezu allen Öko-systemen.
Die bekannteste Erkrankung, welche mit Biofilmen assoziiert wird, ist Karies. Aber auch Infektionen der Gallengänge, des Magens und der Blase sowie Darmkrebs sind mit mikroskopisch identifizierten bakteriellen Biofilmen in Zusammenhang gebracht worden. Die Reduktion von mikroskopisch sichtbaren Biofilmen wurde auch mit einer 5-Aminosalicylat-Therapie bei Colitis-ulcerosa-Patient*innen in Zusammenhang gebracht.
Untersuchungsmethoden
In unsere multizentrische Studie wurden 1426 Patient*innen rekrutiert und mittels Darmspiegelung untersucht. Wir beobachteten membranartige grün-gelbe Auflagerungen im Übergangsbereich zwischen Dünn- und Dickdarm, bei ansonsten guter Darmvorbereitung (Boston Bowel Prep Scale >5), welche sich unter Spülung mit dem Endowasher wie eine zweite Haut von der Mukosa loslösten (s. supplementary video 1 aus Baumgartner M et al.: Gastroenterology 2021).
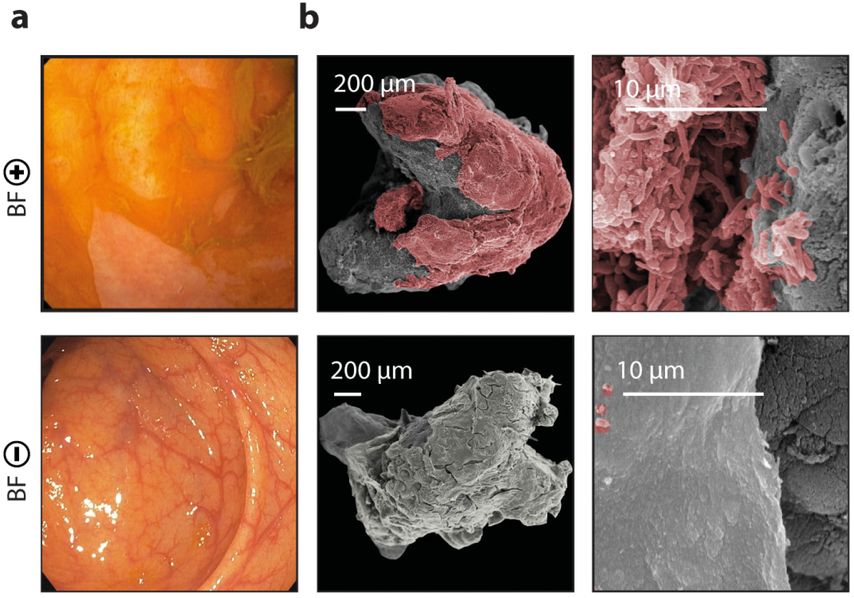
Diese Auflagerungen kamen bei mehr alsder Hälfte der RDS- und bei über einem Drittel der CED-Patient*innen vor. Mit umfassender interdisziplinärer Methodik wie Amplikon-Sequenzierung, Metabolomik, Elektronenmikroskopie, konfokaler Lasermikroskopie, Bioinformatik mit „machine learning“ und In-vitro-Biofilm-Assays konnten wir zeigen,dass diese Auflagerungen tatsächlich mukosalen bakteriellen Biofilmen entsprechen (Abb. 1).
Abb. 1: Unterschied zwischen Kolon-Biopsieproben von RDS-Patient*innen mit endoskopisch sichtbaren Biofilmen (BF-pos) und ohne endoskopisch sichtbare Biofilme (BF-neg). a: Endoskopiebilder von charakteristischen, grün-gelben membranartigen Auflagerungen im Coecum. b: Die Elektronenmikroskopie zeigt dichtgepackte Bakterien an der Darmschleimhaut in BF-pos-Patient*innen, verglichen mit einer intakten Schleimschicht mit einzelnen Bakterien in BF-neg-RDS-Patient*innen (modifiziert nach Baumgartner M et al.: Gastroenterology 2021)
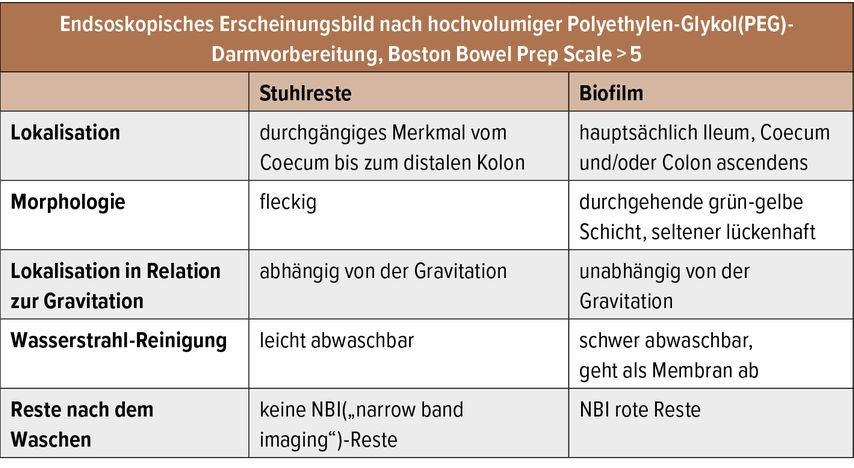
Die von unserer Forschungsgruppe bei der Arbeit verwendete Definition solcher endoskopisch sichtbaren Biofilme ist in Tabelle 1 aufgelistet. Patient*innen mit dem endoskopischen Bild eines Biofilms hatten eine höhere Konzentration an Bakterien, welche auch in die inneren Darmschleimschichten hineinreichte.
Tab. 1: Definition von endoskopisch sichtbaren Biofilmen (modifiziert nach Baumgartner M et al.: Gastroenterology 2021)
Biofilme, Mikrobiota und Gallensäuren-Metabolismus
Des Weiteren konnten wir das Vorhandensein von Biofilmen an der Schleimhaut mit einer aus dem Gleichgewicht gebrachten Mikrobiota in Zusammenhang bringen. Patient*innen, die einen Biofilm im Darm haben, hatten eine verminderte bakterielle Diversität in Dickdarmbiopsien mit den überwachsenden bakteriellen Spezies Escherichia coli und Ruminococcus gnavus.
Zusätzlich hatten „Biofilm-positive“ Patient*innen einen gestörten Gallensäuren-Metabolismus. Ein Phänomen, das aus der RDS-Forschung unter idiopathischer Gallensäuremalabsorption bekannt ist und sich durch erhöhte Konzentrationen von primären Gallensäuren im Stuhl zeigt. Es ist bekannt, dass primäre Gallensäuren im Dickdarm Symptome wie Schmerzen und Durchfall auslösen können und bei etwa einem Drittel der RDS-Patient*innen vorkommen.
Veränderungen im Gallensäuren-Metabolismus und verminderte bakterielle Diversität spielen auch bei der Entstehung von CED eine Rolle. Wir konnten zeigen, dass Biofilme mit erhöhten Entzündungsparametern bei Colitis-ulcerosa-Patient*innen verbunden sind. Die Krankheitsaktivität von CED geht auch mit einem „dysbiotischen Shift“ in der Mikrobiotazusammensetzung einher. Biofilme könnten also eine Art „Kipp-Punkt“ bei Dysbiose im Ökosystem des Darms darstellen. Die dreidimensionale Organisation und Wachstumsart des Mikrobioms sowie die Interaktion mit dem Darmepithel stellen eine zusätzliche Dimension dar, welche in zukünftige Mikrobiomstudien miteinbezogen werden sollte.
Zusammenfassung
Der Hauptpunkt dieser Studie war eindeutig, dass Biofilme endoskopisch sichtbar waren. So konnten wir zum ersten Mal ein „gestörtes“ Mikrobiom makroskopisch visualisieren und mit dem Paradigma brechen, dass RDS nicht mitsichtbaren Veränderungen im Darm verbunden ist. Endoskopisch sichtbare Biofilme haben das Potenzial, die Krankheitsklassifikation von RDS und CED zu revolutionieren, und könnten neue individuelle Therapiemöglichkeiten eröffnen. Weitere Studien werden zeigen, ob RDS-Patient*innen mit Biofilmen von deren Entfernung oder von Gallensäuren- bzw. Mikrobiom-modulierendenTherapien wie etwa Gallensäurebindern oder Stuhltransplantationen profitieren.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Behandlung der Sigmadivertikulitis
Die Divertikulitis gehört zu den häufigsten Krankheitsbildern bei akuten Bauchschmerzen. Die Inzidenz nimmt mit dem Alter stark zu und immer mehr jüngere Patienten erkranken an einer ...
Therapie des Morbus Crohn: bewährte Konzepte und neue Strategien
Welche Behandlungsziele haben Ärzt:innen, die Patient:innen mit Morbus Crohn (MC) behandeln, und haben die Betroffenen die gleichen Ziele? Lassen sich die Therapieziele erreichen, wenn ...
Therapie des Morbus Crohn: Biologikabehandlung optimieren
Prof. Dr. med. Iris Dotan, Rabin Medical Center, Petah Tikva, und Universität Tel Aviv (Israel), zeigte im Rahmen des 9. Postgraduate Course des IBDnet Möglichkeiten auf, wie die ...