Achalasie: welche Therapie für welchen Patienten?
Autor*innen:
Ass. Dr. Hansjörg Schlager
Ass. Dr. Julia Konrad
FÄ DDr. Franziska Baumann-Durchschein
Klinische Abteilung für Gastroenterologie und Hepatologie
LKH-Universitätsklinikum Graz
Korrespondierender Autor:
E-Mail: hansjoerg.schlager@medunigraz.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Zur Behandlung der Achalasie stehen medikamentöse, endoskopische und chirurgische Optionen zur Auswahl. Das primäre Therapieziel ist Beschwerdefreiheit respektive die bestmögliche Symptomkontrolle.
Keypoints
-
Für die Therapieentscheidung sind patientenspezifische Charakteristika vorrangig.
-
Die aktuellen Guidelines stufen die pneumatische Dilatation, die Heller-Myotomie und die perorale endoskopische Myotomie als gleichwertige Optionen ein.
-
Verhindern Komorbiditäten eine definitive Therapie, stellt die Botox-Injektion bzw. die medikamentöse Behandlung eine mögliche Alternative dar.
-
Die Ösophagektomie sollte nur als allerletzte Möglichkeit angedacht werden.
Die primären Motilitätsstörungen des Ösophagus stellen eine Gruppe seltener Erkrankungen dar, welche durch Symptome wie Dysphagie, nichtkardialen Thoraxschmerz, Regurgitation sowie konsekutiv Gewichtsverlust gekennzeichnet sind. Das häufigste Krankheitsbild ist die Achalasie mit einer Inzidenz von 0,3–3 pro 100000 und einer Prävalenz von ca. 1,8– 12,6 pro 100000 Einwohner*innen. Der Altersgipfel liegt nach dem 50. Lebensjahr. Wie bereits der Name im Griechischen (αχαλασία = fehlendes Nachlassen) suggeriert, besteht das Charakteristikum darin, dass durch eine Zerstörung der inhibitorischen Neurone des Plexus myentericus die schluckinduzierte Öffnung des unteren Ösophagussphinkters (LES) gestört ist. Dadurch kommt es zum Rückstau des Nahrungsbreis innerhalb der Speiseröhre, wodurch die zuvor beschriebenen Symptome erklärt werden können.
Ätiologie
Die Ätiologie ist bis dato ungeklärt, es werden jedoch virale Infektionen (Masern-, Varicella-Zoster-, Herpes-simplex- oder humane Papillomaviren) beziehungsweise dadurch getriggerte autoimmune Prozesse bei genetischprädisponierten Individuen diskutiert.1 Normalerweise handelt es sich um einen schleichenden Prozess, der über einen langen Zeitraum von den Patient*innen kompensiert wird und daher auch oft erst in fortgeschrittenen Stadien diagnostiziert wird. Sollte es jedoch innerhalb von 12 Monaten zu einer ausgeprägten Dysphagie, vor allem auch bei Flüssigkeiten, sowie zu einem Gewichtsverlust von >10kg kommen, muss vor allem bei Patient*innen über dem 55. Lebensjahr an das Vorliegen einer Pseudoachalasie im Rahmen einer (para-)neoplastischen Genese gedacht werden.2
Diagnose
Die Diagnose der Achalasie kann heutzutage mithilfe der Chicago-Klassifikation (CCv4.0) gestellt werden. Das Hauptcharakteristikum ist die fehlende Öffnung des LES, was in der High-Resolution-Manometrie (HRM) durch einen erhöhten integrierten Relaxationsdruck (IRP) widergespiegelt wird.
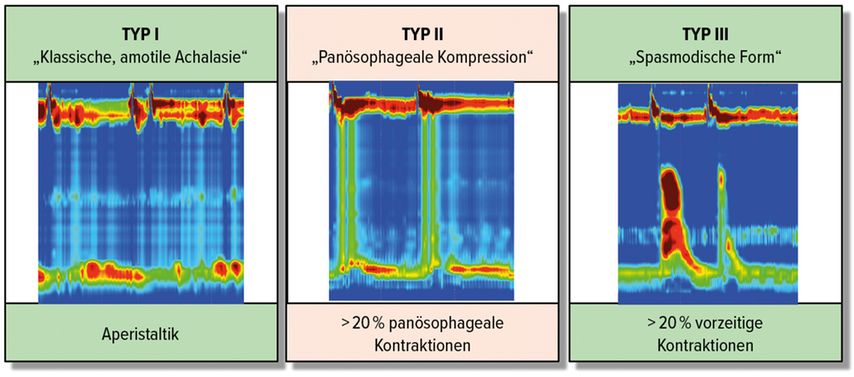
Es können drei Untertypen unterschieden werden: die klassische Achalasie Typ I, welche keine tubuläre Kontraktilität aufweist, die Achalasie mit panösophagealen Kompressionen (Typ II) und die Achalasie Typ III mit vorzeitigen (spastischen) Kontraktionen. Die optischen Unterschiede sind in der Abbildung 1 dargestellt.3 Die Einteilung mag akademisch wirken, jedoch hat sich in Studien gezeigt, dass die Achalasie Typ III schwieriger zu behandeln ist und besser auf eine perorale endoskopische Myotomie (POEM) anspricht.4
Abb. 1: Die unterschiedlichen Typen der Achalasie (High-Resolution-Manometrie) (modifiziert nach Yadlapati R et al. 2021)3
Therapie
Da es bereits zu einer Destruktion der Neurone gekommen ist, kann keine Heilung erzielt werden. Als primäres Therapieziel sollte daher eine Beschwerdefreiheit beziehungsweise die bestmögliche Symptomkontrolle mit Steigerung der Lebensqualität im Vordergrund stehen. Um diese zu evaluieren, kann als einfaches Tool der Eckardt-Score herangezogen werden, welcher aus den vier Hauptsymptomen (Dysphagie, Regurgitationen, Thoraxschmerz, Gewichtsverlust) gebildet wird. Diese werden nach der Häufigkeit (nein = 0, gelegentlich = 1, jeden Tag = 2 und jede Mahlzeit = 3) beziehungsweise nach der Höhe des Gewichtsverlusts (0 = kein, 1 = < 5 kg, 2 =5–10 kg und 3 = ≥ 10 kg) bewertet. Bei einer Reduktion um 50 % oder bei einem Gesamtscore von ≤ 3 Punkten kann von einem zufriedenstellenden Ergebnis gesprochen werden.5
Als zusätzlicher Parameter kann die verbesserte Entleerung des Speisebreis im Videoschluckaktröntgen herangezogen werden. Das Protokoll des „Timed Barium Esophagogram“, bei dem 100–200ml Kontrastmittel mit niedriger Dichte getrunken werden, erlaubt hier eine standardisierte Beurteilung. Einen Monat nach der Therapie sollte im 5-Minuten-Bild keine Kontrastmittelsäule größer als 5cm vorliegen.6 Umgekehrt spricht eine Abnahme von weniger als 50% im selben Bild unabhängig von der symptomatischen Besserung für das Auftreten eines Rezidivs.7
Zur Behandlung der Achalasie stehen medikamentöse, endoskopische und chirurgische Optionen zur Auswahl. Die erste und zentralste Fragestellung, über die man sich in der Therapie der Achalasie Gedanken machen muss, sind die Komorbiditäten beziehungsweise die vermutete Lebenserwartung des Patienten.
Botox
Nur wenn es hier zu Einschränkungen kommt, sollte eine Botox-Injektion in den LES durchgeführt werden.5,8,9 Es kann von einem initialen Therapieansprechen von 77% ausgegangen werden, jedoch liegt die Wirkungsdauer bei etwa 6–12 Monaten und nimmt mit jeder Injektion stetig ab. Trotz der einfachen Durchführbarkeit und der Reversibilität des Effekts sollte eine Botox-Injektion nur im Einzelfall bei „therapietauglichen“ Patient*innen durchgeführt werden.10
Medikamentöse Therapie
Sollte dies bei der oben genannten Therapiegruppe keinen Effekt erbringen, kann noch ein medikamentöser Therapieversuch durchgeführt werden. Hier stehen Sildenafil (max. 50mg/d) oder Diltiazem (max.180–240mg/d) als Dauertherapie beziehungsweise Isosorbiddinitrat (max. 5–10mg) oder Nifedipin (10–30mg) 5 bis 10 Minuten vor der Nahrungsaufnahme zurVerfügung. Das therapeutische Ansprechen ist meist nur mäßig und wird aufgrund der Nebenwirkungslast (Kopfschmerz, Hypotension, Ödeme) durch die hohen Tagesdosen schlecht toleriert.8 Auch die Einnahme von Pfefferminzöl kann vor allem Schmerzsymptome positiv beeinflussen.11
Um eine adäquate Energie- und Nährstoffzufuhr zu gewährleisten, sind häufig hochkalorische und eiweißreiche Trinknahrungen als Ergänzung notwendig. Sind nur noch pürierte oder flüssige Speisen möglich, ist vor allem auf Anreicherungsmöglichkeiten, wie z.B. mit Maltodextrin, hochwertigen Ölen oder Eiweißpulver, zu achten, um einem Gewichtsverlust entgegenzuwirken.
Endoskopische und chirurgische Optionen
Gesunde Patient*innen (abseits der Achalasie) beziehungsweise Patient*innen mit einer hohen Lebenserwartung sollten wenn möglich immer eine definitive Therapie erhalten. Dazu zählen die pneumatische Dilatation (PD) und die perorale endoskopische Myotomie (POEM) – zwei endoskopische Modalitäten – und die laparoskopische Heller-Myotomie (LHM). Die Auswahl der richtigen Methode hängt vor allem von patientenspezifischen Charakteristika wie dem Alter und von manometrischen Aspekten ab.
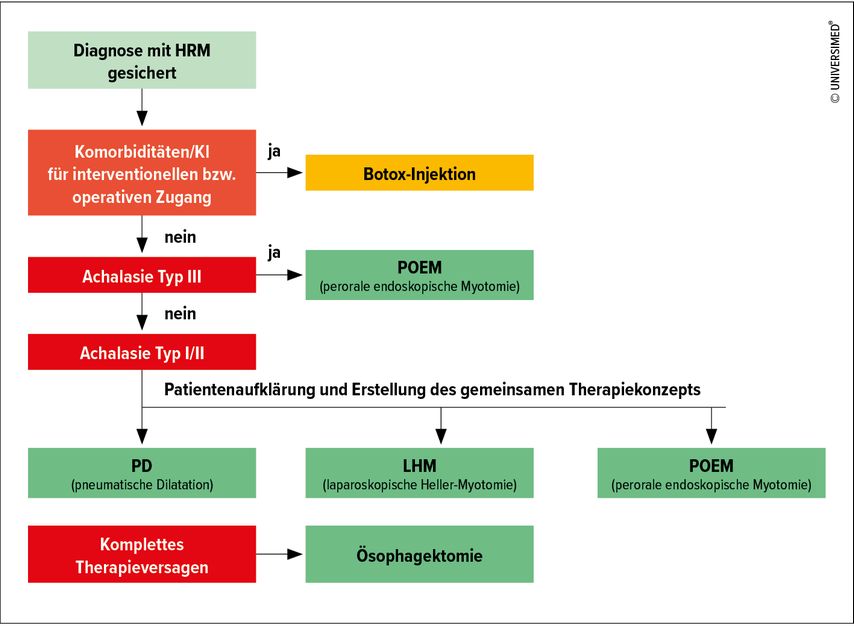
Bei einer Achalasie Typ III hat sich gezeigt, dass vor allem die POEM einen deutlichen Vorteil in der Symptomkontrolle zeigt. Dies wird vor allem auf die Möglichkeit einer verlängerten sowie an die spastische Kontraktionsfront angepassten Myotomie zurückgeführt.4 Bei den Typen I und II werden derzeit alle drei Optionen von den aktuellen Guidelines empfohlen und sollten nach ausreichender Aufklärung und Besprechung der Vor- und Nachteile mit dem Patienten abgewogen werden (Abb. 2).5,8,9 Im Folgenden werden kurz die Methoden und deren Wirksamkeit im Vergleich angeführt.
Abb. 2: Mögliches therapeutisches Vorgehen nach den derzeitigen Leitlinien (modifiziert nach den europäischen, ACG- und ASGE-Leitlinien 2020)5, 8, 9
Pneumatische Dilatation
Bei der pneumatischen Dilatation wird ein Ballon im Bereich des LES platziert und mit Luft (etwa 6–15psi) gefüllt, was zur Überdehnung des Sphinkterapparats führt. Dies wird stufenweise von 30mm auf 35mm (selten 40mm) in mehreren Sitzungen durchgeführt. Die Effektivität wird um die 50–93% angegeben, nimmt jedoch nach gewisser Zeit ab und muss daher in vereinzelten Fällen wiederholt werden. Vorteile sind die breitere Verfügbarkeit, die geringeren postinterventionellen Refluxraten und die kurze Eingriffsdauer. Nachteil ist jedoch das Perforationsrisiko, welches zwischen 2 und 4% angegeben wird.8
Perorale endoskopische Myotomie
Bei der peroralen endoskopischen Myotomie als neueste endoskopische Methode erfolgt nach submukosaler Tunnelung eine gezielte Myotomie der zirkulären Muskelfasern im Bereich des gastroösophagealen Übergangs mit Fortsetzung in den Magen und in die distale Speiseröhre. Die Eintrittsstelle im mittleren Ösophagus wird mit Clips verschlossen. Diese Methode benötigt eine hohe Expertise und ist mit einer längeren Eingriffsdauer behaftet. Häufig treten periinterventionell ein Pneumomediastinum oder ein Pneumoperitoneum auf, was jedoch selten zu Komplikationen führt. Sehr selten kommt es zu schwerwiegenderen Komplikationen wie Blutung, Pleuraergüssen, Pneumothorax, Wunddehiszenz und Mediastinitis. Es zeigt sich ein ausgezeichnetes klinisches Ansprechen, welches mit bis 98% beschrieben wird. Die erhöhten postinterventionellen Refluxraten von bis zu 40% sind die Kehrseite dieser neuen Therapieoption.10
Laparoskopische Heller-Myotomie
Als chirurgische Alternative steht die laparoskopische Heller-Myotomie zur Verfügung, welche mit einer Fundoplicatio zur Prophylaxe einer ausgeprägteren postinterventionellen Refluxkomponente kombiniert wird. Die Effektivitätsdaten zeigen mit 60–94% ebenfalls ein sehr gutes initiales Ansprechen mit geringer Abnahme über die Zeit. Auch in diesem Fall müssen der längere Eingriff und Krankenhausaufenthalt sowie das perioperative Risiko einkalkuliert werden.8
Studiendaten
Mit dem Vergleich der unterschiedlichen Optionen haben sich viele Metaanalysen beschäftigt und kommen zu unterschiedlichen Ergebnissen beziehungsweise Auslegungen. Die prospektiv randomisierten Studien zeigen folgendes Bild: Im Vergleich von PD mit LHM zeigt sich ein ähnliches Ansprechen mit 90% vs. 93%. Dieses liegt nach 2 Jahren immer noch bei 86% vs. 90%.12
In der Studie von Ponds et al. wird eine deutliche Überlegenheit der POEM mit 93% gegenüber der PD mit 54% suggeriert, jedoch wurden meist nur 1 bis 2 Dilatationen durchgeführt und somit wurde vom Standardprotokoll abgewichen.13 Auch im Vergleich von POEM mit LHM konnte kein relevanter Unterschied mit einer Effektivität von 95% vs. 89% gezeigt werden.14
Bei 1–5% der Betroffenen kann keine der zuvor erwähnten Therapieoptionen, auch nicht in Kombination, einen therapeutischen Erfolg erbringen. In diesen Fällen sollte nach Berücksichtigung der Symptomlast und des Allgemeinzustandes der Patientin/des Patienteneine Ösophagektomie diskutiert werden. Das Komplikationsrisiko mit 19–50% und das Mortalitätsrisiko mit 3,8% müssen dabei mit in Betracht gezogen werden.5
Nachsorge
Die klinische Nachsorge erfolgt anhand der Symptomlast des Patienten. Sollte es zu einem Rezidiv der Beschwerden kommen, kann nach aktuellen Leitlinien eine Kombination der zuvor beschriebenen Methoden durchgeführt werden. Zur objektiven Evaluierung können auch eine neuerliche HRM, ein TBE oder eine Endoflip-Untersuchung herangezogen werden.
Neben der Reevaluierung der Symptome und eines möglichen Rezidivs sollte vor allem auch, je nach Auswahl der Methode, auf eine Behandlung einer Refluxkomponente geachtet werden. Vor allem das erhöhte Risiko für die Entwicklung von Karzinomen der Speiseröhre (70-fach für Plattenepithelkarzinome, 7-fach für Adenokarzinome) sollte in der Nachsorge bedacht werden. Dieses bleibt auch nach erfolgter Therapie bestehen.Allerdings empfehlen internationale Leitlinien kein generelles Screening.5
Resümee
Im Vordergrund der Therapieentscheidung bei Achalasie stehen vor allem patientenspezifische Charakteristika. Sollten Komorbiditäten eine definitive Therapie verhindern, sollte eine Botox-Injektion in den LES versucht werden. Bei Versagen dieser kann neben einer ausreichenden Sicherung der Ernährungssituation eine medikamentöse Therapie versucht werden. Eine definitive Therapie sollte erst nach manometrischer Charakterisierung erfolgen, da bei einer Achalasie Typ III aufgrund des besseren Ansprechens eine POEM durchgeführt werden sollte. Bei Typ I und II sollte der/die Patient*in nach ausführlicher Aufklärung über Vor- und Nachteile sowie Komplikationen in die Therapieentscheidung eingebunden werden. Es sollte nach deren Präferenz die richtige Methode gewählt werden, da sowohl die pneumatische Dilatation als auch die Heller’sche Myotomie und die perorale endoskopische Myotomie von den aktuellen Guidelines als gleichwertige Optionen erachtet werden. Die Ösophagektomie sollte nur als allerletzte Möglichkeit angedacht werden.
Literatur:
1 Blonski W et al.: Update on the diagnosis and treatment of achalasia. Dysphagia 2023; 38(2): 596-608 2 Pandolfino JE, Gawron AJ: Achalasia: a systematic review. JAMA 2015; 313(18): 1841-52 3 Yadlapati R et al.: Esophageal motility disorders on high-resolution manometry: Chicago classification version 4.0. Neurogastroenterol Motil 2021; 33(1): e14058 4 Andolfi C, Fisichella PM: Meta-analysis of clinical outcome after treatment for achalasia based on manometric subtypes. Br J Surg 2019; 106(4): 332-41 5 Oude Nijhuis RAB et al.: European guidelines on achalasia: United European Gastroenterology and European Society of Neurogastroenterology and Motility recommendations. United European Gastroenterol J 2020; 8(1): 13-33 6 de Oliveira JM et al.: Timed barium swallow: a simple technique for evaluating esophageal emptying in patients with achalasia. AJR Am J Roentgenol 1997; 169(2): 473-9 7 Vaezi MF et al.: Timed barium oesophagram: better predictor of long term success after pneumatic dilation in achalasia than symptom assessment. Gut 2002; 50(6): 765-70 8 Vaezi MF et al.: ACG Clinical Guidelines: Diagnosis and management of achalasia. Am J Gastroenterol 2020; 115(9): 1393-411 9 Khashab MA et al.: ASGE guideline on the management of achalasia. Gastrointest Endosc 2020; 91(2): 213-27.e6 10 Weusten B et al.: Endoscopic management of gastrointestinal motility disorders – part 1: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2020; 52(6): 498-515 11 Khalaf MHG et al.: Impact of peppermint therapy on dysphagia and non-cardiac chest pain: apilot study. Dig Dis Sci 2019; 64(8): 2214-8 12 Boeckxstaens GE et al.: Pneumatic dilation versus laparoscopic Heller’s myotomy for idiopathic achalasia. N Engl J Med 2011; 364(19): 1807-16 13 Ponds FA et al.: Effect of peroral endoscopic myotomy vs pneumatic dilation on symptom severity and treatment outcomes among treatment-naive patients with achalasia: a randomized clinical trial. JAMA 2019; 322(2): 134-44 14 Werner YB et al.: Endoscopic or surgical myotomy in patients with idiopathic achalasia. N Engl J Med 2019; 381(23): 2219-29
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Transition bei CED: Fallbeispiel für einen strukturierten Übergang
Die Transition bei chronisch-entzündlichen Darmerkrankungen stellt eine wichtige Brücke zwischen Jugendlichen und Erwachsenen dar und birgt einige Herausforderungen. Am ...