Von der Grundlagenforschung bis zur Artificial Intelligence
Bericht:
Mag. Dr. Anita Schreiberhuber
Neben Präsentationen zu aktuellen Studienergebnissen und zum Status quo in der Dermatologie wurde auf der ÖGDV-Jahrestagung 2020 auch der Grundlagenforschung und futuristischen Technologien Platz eingeräumt. Eine eigene Session war in diesem Zusammenhang dem modernen Thema der „Artificial Intelligence“ gewidmet.
Univ.-Prof. Dr. Klaus Wolff war eine Persönlichkeit, die die österreichische Dermatologie nicht nur bedeutsam geprägt, sondern auch dazu beigetragen hat, sie auf internationales Niveau zu heben. Zu Ehren Wolffs findet jährlich im Rahmen der ÖGDV-Jahrestagung die Klaus-Wolff-Vorlesung statt, 2020 wurde sie von Prof. Dr. Nikolaus Romani abgehalten. Romani ist ein Biologe, der im Jahr 1980 an die Medizinische Universität Innsbruck kam und sich bald auf dem Forschungsgebiet der Dermatoimmunologie betätigte. Er hat mit Wolff zwar nur ein Jahr (von 1980 bis 1981) zusammengearbeitet, dies hat ihn aber dazu motiviert, in Wolffs Forschungsgebiet tätig zu werden.
Langerhanszellen und dendritische Zellen
Die Erforschung der Langerhans-Zellen, die 1868 von Paul Langerhans entdeckt worden waren, bestimmte die wissenschaftliche Tätigkeit von Wolff über viele Jahre hinweg. Bereits 1967 publizierte er eine Arbeit zur ultrastrukturellen Beschreibung der Feinstruktur dieser Zellen.1 Mit Prof. Dr. Gerold Schuler, der für lange Zeit sein Mentor war, ging Romani 1987 nach New York an die Rockefeller University, wo er zu einem der engsten Mitarbeiter von Ralph Steinmann wurde und maßgeblich an dessen Entdeckung der dendritischen Zellen mitbeteiligt war. Aus diesem Grund wurde er auch von dessen Witwe nach Stockholm eingeladen, wo Steinmann für diese wissenschaftliche Leistung posthum mit dem Nobelpreis ausgezeichnet wurde. Schuler wiederum konnte zeigen, dass Langerhans-Zellen Teil der dendritischen Zellfamilie sind.2
Aus Monozyten gezüchtete dendritische Zellen wurden weltweit für die experimentelle Behandlung von Melanompatienten eingesetzt. Auch hier zählt Prof. Schuler zu den führenden Forschern. Erst vor wenigen Jahren erfolgte eine Zusammenfassung der Daten zur Behandlung von Krebszellen mit dendritischen Zellen als Monotherapie.3 „Auch wenn diese im Zeitalter von Checkpointinhibitoren keine Option mehr darstellen, sind dendritische Zellen dennoch interessant“, merkte Romani an. An der Universität Innsbruck wurde unter der Mitarbeit von Romani in der Forschergruppe um Univ.-Prof. Anh Nguyen Daten publiziert, anhand deren vor 10 Jahren gezeigt wurde, dass eine Chemotherapie in Kombination mit dendritischen Zellen zu einer Überlebensverlängerung führt.4
Rezente und aktuelle Forschung zu dendritischen Zellen
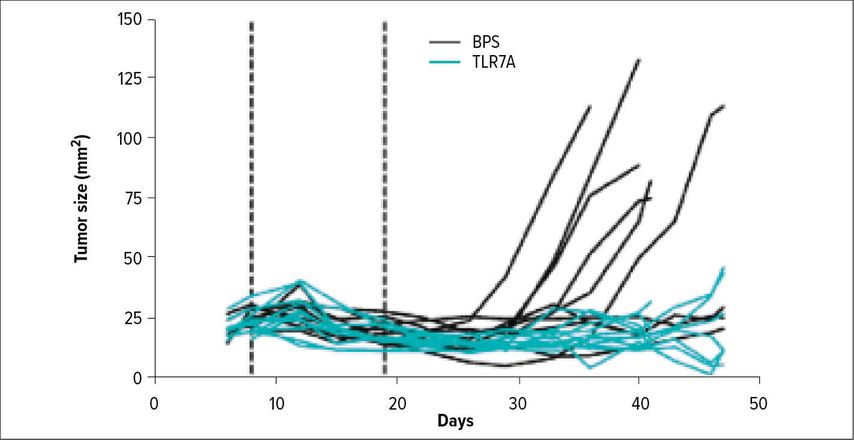
„Um dendritische Zellen rational besser einsetzen zu können, ist die Grundlagenforschung weiterhin relevant“, so die einleitenden Worte von Romani zum Status quo in der Forschung an der Medizinischen Universität Innsbruck. Die wissenschaftlichen Errungenschaften, die – ausgehend von Wolff – von Schuler und Romani erzielt worden sind, werden aktuell in der Arbeitsgruppe um Prof. Patrizia Stoitzner forschungsmäßig weiter vorangetrieben. Prof. Romani präsentierte einige spannende Beispiele aus der rezenten Forschung, unter anderem eine Arbeit, die Ansatzpunkte dafür liefert, wie dendritische Zellen bei Tumorerkrankungen zum Einsatz kommen bzw. wie deren Effekte genutzt werden könnten: Die medikamentöse BRAF-Inhibition kommt beim BRAF V600E-mutierten (-m) Melanom schon seit vielen Jahren zum Einsatz, der à la longue sich entwickelnden Resistenz konnte bisher noch nicht effektiv begegnet werden. Am Mausmodell zum Melanom konnte in einer präklinischen Untersuchung gezeigt werden, dass in der frühen Behandlungsphase Tumoren unter BRAF-Inhibitor-Therapie hochimmunogen sind und viele infiltrierende T- und NK-Zellen aufweisen, was in der Phase der Resistenz nicht mehr der Fall ist. Wenn man jedoch in der BRAF-sensitiven Phase peritumoral einen TLR(„toll-like receptor“)-Agonisten injiziert, wird eine Verstärkung der NK- und der T-Zell-Funktion erzielt, was in einer Tumorschrumpfung und somit einer Verbesserung der klinischen Prognose resultiert (Abb. 1). Diese Ergebnisse könnten die Basis für eine neue Therapiestrategie beim BRAF V600E-mMelanom liefern.5
In einer anderen Untersuchung wurden Mäuse mit einem Boost an dendritischen Zellen behandelt. Dadurch kam es zu einer Vermehrung der dendritischen Zellen in den Tumoren bei einer gleichzeitigen Reduktion in der gesunden Haut. Die Kombination dieser Strategie mit einem Checkpointinhibitor führt zu einer deutlichen Überlebensverlängerug.6 „Ich denke, die verschiedenen experimentellen Ansätze können sehr wohl dazu beitragen, dass Therapien verbessert werden, und als PhD und Biologe möchte ich generell betonen, dass Grundlagenforschung wichtig ist“, so die Conclusio von Romani.
Artificial Intelligence bei entzündlichen Hauterkrankungen
Der Einsatz von künstlicher Intelligenz (Artificial Intelligence; AI) wird primär bei neoplastischen Hauterkrankungen propagiert. Wie sie auch bei entzündlichen Hauterkrankungen zum Einsatz kommen kann, hat Prof. DDr. Alexander Navarini, Universitätsspital Basel, anhand von einigen konkreten Beispielen dargelegt. Die Anforderungen an die AI bei kutanen Neoplasien unterscheiden sich von jenen bei entzündlichen Hauterkrankungen: Während in der Dermatoonkologie die Klassifikation der Diagnose am wichtigsten ist, steht bei entzündlichen Läsionen die Quantifizierung, d.h. die Beschreibung der Ausdehnung und des Schweregrads, im Vordergrund. Genau umgekehrt verhält es sich bei kutanen Neoplasien. Darüber hinaus ging Navarini der Frage nach, ob denn die Anamnese wirklich so wichtig ist, wie wir glauben. Die Teledermatologie gewinnt zunehmend an Bedeutung: Navarini berichtete, dass sich ein Trend wie in den USA, wo die Teledermatologie in den vergangenen fünf Jahren um 50% zugenommen hat, auch bei uns – wenn auch zeitlich verzögert – abzeichnet: „Auch wir beantworten inzwischen täglich viele dermatologische Anfragen – zu vielen Neoplasien, aber auch zu vielen entzündlichen Erkrankungen“, berichtete der Chefarzt der Dermatologie am Universitätsspital Basel. Dass Teledermatologie aber auch in harsche Kritik kommen kann, lässt sich am Beispiel von gewissen Apps zur Selbstdiagnose von Hautkrebs im Frühstadium ableiten: Diese schnitten in mehreren Studie– so wie auch in jener von Chung et al. durchgeführten Studie – schlecht ab. Die Forscher untersuchten die Performance einer definierten App, indem sie die Ergebnisse zur Risikoeinstufung mit der Beurteilung durch einen Dermatologen verglichen. Die Patienten (n=125) durften die zu evaluierenden Läsionen (n=199) selbst auswählen. Die App war nicht imstande, 90 Fälle (45%) korrekt zu analysieren: Darunter waren neun Basalzellkarzinome, vier atypische Nävi und ein Lentigo-maligna-Melanom. 30 (67%) bzw. 21 Läsionen (70%), die von der App als solche mit hohem bzw. mittlerem Risiko eingestuft worden waren, kristallisierten sich bei der Beurteilung durch den Dermatologen als benigne Nävi bzw. seborrhoische Keratosen heraus. Die Interobserver-Übereinstimmung zwischen der automatisierten Risikobeurteilung und dem Dermatologen war schlecht (gewichteter Kappa-Wert: 0,02; 95%iges Konfidenzintervall (CI): –0,08 bis 0,12; p=0,74). Die Autoren ziehen den Schluss, dass weitere Untersuchungen zur diagnostischen Genauigkeit in Real-Life-Situationen erforderlich sind, um den Benutzern verlässliche Informationen zur Verfügung zu stellen zu können.7
Deep-Learning-System zur Diagnosestellung
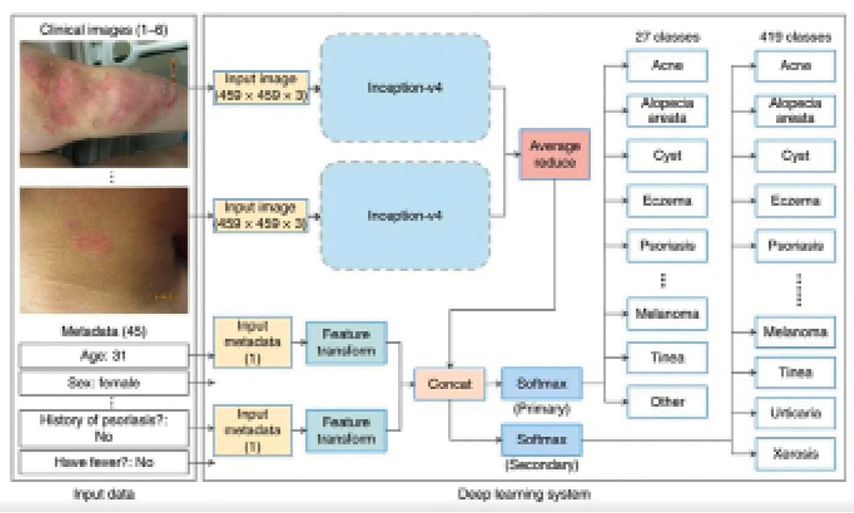
In der klinischen Praxis werden nichtneoplastische Läsionen wie entzündliche Dermatosen und Pigmentstörungen öfter beobachtet als Hautkrebs. Liu et al entwickelten ein Deep-Learning-System (DLS) zur Differenzialdiagnose (DD) von Hauterkrankungen. Dabei wurden 16114 Fälle (Fotos und klinische Daten) verwendet und 26 Diagnosen, die 80% der Dermatosen in der Primärpraxis repräsentieren, primär untersucht. Die Bilder wurden mit einer Mischung aus verschiedenen Geräten aufgenommen, die die Realität des teledermatologischen Dienstes darstellen. Wie funktioniert nun das DLS? Man zog Bilder heran und gab ab, wie hoch die Wahrscheinlichkeit für das Vorliegen der Diagnose X, Y oder Z war. Die Bilder wurden dann mit hoher Auflösung in das DLS eigespeist und das Modell entschied, wie hoch etwa die Wahrscheinlichkeit war, dass es sich z.B. um Psoriasis handelte. Bei der Diagnosestellung wurden neben den Bilddaten auch klinische Daten, Metadaten und Patientencharakteristika wie Alter, Geschlecht etc. verarbeitet. Die Funktion SOFTMAX entschied über die Klassifikation (Abb. 2).8 Wie hoch ist nun die Übereinstimmung zwischen der Diagnose durch Dermatologen und der des DLS? Drei zertifizierte Dermatologen repräsentierten den Goldstandard. Das DLS war den Dermatologen zwar nicht überlegen, aber beide waren eher schwach. Bei Festlegung auf nur eine DD lag die „Top-1-Genauigkeit“ des DLS bei 71% und die Top-1-Sensitivität bei 58%. Als jedoch dem DLS 3 DD zugestanden wurden, stieg die „Top-3-Genauigkeit“ auf 93% und die „Top-3-Sensitivität“ auf 83%, sie waren dabei mit der Beurteilung durch die Dermatologen äquivalent. Interessant war auch, dass nach über 10000 Fällen die Größe des Datensatzes keine Rolle mehr spielte und die Anamnese nicht wirklich relevant war. Das Wissen, dass in der Vorgeschichte eine Psoriasis aufgetreten ist, führt zu einer Erhöhung in der Akkuranz in der Diagnose um nur ca. 5%.8
PASI-Beurteilung mittels Photofinder
Einen weiteren Ansatz im Bereich der AI bildet der Versuch der Reproduzierbarkeit und Verbesserung der Präzision automatisierter computergestützter Messungen der Psoriasisfläche und des Schweregrad-Index im Vergleich zu geschulten Ärzten: Die Beurteilung des PASI (Psoriasis Area and Severity Index) ist grundsätzlich durch Subjektivität und geringe Konsistenz zwischen den Beurteilungen und sogar innerhalb des Ratings begrenzt. In einer vergleichenden Beobachtungsstudie an 120 Psoriasispatienten wurde der Grad der Übereinstimmung zwischen der Beurteilung durch das Gerät und der durch geschulte Ärzte berechnet. Mit einem ICC („intraclass correlation coefficient“) von 0,86 (95% CI: 0,80–0,90) war die Übereinstimmung zwischen den automatisierten, computergestützten PASI-Messungen und den Einstufungen durch die Ärzte hoch. Gleichzeitig betrug die mittlere absolute Differenz 2,5 PASI-Punkte.9 „Das ist hoch, wenn man bedenkt, dass an einem Unterschied von 2,5 PASI-Punkten die Entscheidung für oder gegen eine teure Biologikatherapie hängen kann!“, gab Navarini zu bedenken.
AI-Algorithmus zum Grading von Akne
Eine französische Forschergruppe hat einen AI-Algorithmus (AIA) für Smartphones für die Beurteilung der Schwere von Gesichtsakne mittels der GEA(„Global Evaluation Acne“)-Skala und für die Identifizierung unterschiedlicher Akneläsionen (nichtinflammatorisch vs. inflammatorisch) und von postinflammatorischer Hyperpigmentierung (PIHP) oder residualer Hyperpigmentierung entwickelt. Dabei wurden auf Smartphones knapp 6000 Bilder von 1072 Aknepatienten gesammelt. Drei geschulte Dermatologen beurteilten den Schweregrad bei jedem Patienten. Die beste Version erzielte bei entzündlichen Läsionen eine Präzision und einen Recall von 84%. Bei nicht entzündlichen Läsionen bzw. bei PIHP betrugen die Werte 61 bzw. 72%. Insgesamt belief sich das durch das AIA ausgewertete GEA-Grading in der besten Version auf 68% und war damit mit jenem der Dermatologen vergleichbar.10 „Ich könnte mir vorstellen, dass die Reproduzierbarkeit über die Zeit hinweg ansteigt, wenn man repetitive Untersuchungen durchführen würde“, merkte Navarini dazu an. Am Universitätsspital Basel ist ebenfalls eine Studie zur Beurteilung von Akne im Gange (NCT04060160): Die Patienten scannen täglich ihr Gesicht im 3D-Format im Smartphone. Durch den täglichen Scan und die Analyse durch das krankenhausinterne Informationssystem kann eine Beurteilung durch die Dermatologen über die Zeit hinweg vorgenommen und gegebenenfalls eine Intervention gesetzt werden. Die Patienten beantworten Fragebögen zur Evaluierung der PRO („patient reported outcomes“) und gleichzeitig besteht für den Arzt jederzeit die Möglichkeit, bei persistierenden Problemen direkt Kontakt mit dem Patienten – z.B. via SMS – aufzunehmen, was als „high definition follow-up“ bezeichnet wird. So werden also die Patienten kontinuierlich elektronisch begleitet, wodurch eine höhere Qualität geboten wird.
Ausblick: Vision von einer modernen Dermatologie
Werden die modernen Techniken der AI unser Vorgehen in Zukunft ändern? „Ich glaube, dass wir die Bildgebung mehr gewichten sollten. Bei uns werden die Patienten bei jedem Ambulanzbesuch mit einem Ganzkörpergerät fotografiert. Die Bilder werden bei jeder neuerlichen Vorstellung mit den früheren Aufnahmen vergleichen. Das ganze Prozedere wird durch AI – z.B. durch Messung der Flächenausdehnung, Vergleich mit anderen Patienten – unterstützt“, berichtete Navarini, der seinen Vortrag mit der bewusst provokativen Frage beendete, ob man denn zukünftig vielleicht die Diagnose bei entzündlichen Hauterkrankungen stellenweise verlassen und Patienten anhand der Morphologie, die Aufschluss über das Transkriptom gibt, behandeln wird.
Quelle:
Jahrestagung der ÖGDV (Österreichische Gesellschaft für Dermatologie und Venerologie), 3.–5. Dezember 2020, virtuell
Literatur:
1 Wolff K: J Cell Biol 1967; 35: 468-473 2 Schuler G et al.: J Exp Med 1985; 161: 526-546 3 Gross S et al.: JCI Insight. 2017; 2(8): e91438 4 Eisendle K et al., JDDG 2020: https://doi.org/10.1111/ddg.14334_g 5 Bellmann L et al.: Int J Cancer 2020; 146: 1409-20 6 Prokopi A et al.: J Immunother Cancer 2021; 9: e000832. doi:10.1136/ jitc-2020-000832 7 Chung Y et al.: JEADV 2019: https://doi.org/10.1111/jdv.15873 8 Liu Y: Nat Med 2020; 26: 900-8 9 Fink C et al.: Br J Dermatol 2018; 180: 390-396 10 Seité S et al.: Exp Dermatol 2019: https://doi.org/10.1111/exd.14022
Das könnte Sie auch interessieren:
Biologika-Therapie: Pipeline und Klinik
Biologika bieten die Option, in die hinter der atopischen Dermatitis stehenden Immunprozesse gezielt einzugreifen. Dieser Weg wurde zuerst mit dem Anti-IL-4/IL-13-Antikörper Dupilumab ...
Zentrale Aspekte bei atopischer Dermatitis
Über die medikamentöse Therapie hinaus bleiben die Berücksichtigung von Umweltfaktoren, die Sicherstellung der Adhärenz und die Anpassung der Therapie an Begleiterkrankungen oder ...
Neuer Wirkstoff bei Acne vulgaris
Acne vulgaris führt vor allem während der Pubertät zu Leidensdruck bei Betroffenen. Zur Behandlung stehen je nach Ausprägung verschiedene Therapeutika zur Verfügung, kürzlich wurde der ...