Photodynamische Therapie in der Dermatologie
Autoren:
Dr. Valentin Hacker
Dr. Katarina Silic
Priv.-Doz. Dr. Sonja Radakovic
Univ.-Klinik für Dermatologie, Medizinische Universität Wien
E-Mail: sonja.radakovic@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Innerhalb der letzten 20 Jahre konnte sich die photodynamische Therapie (PDT) in der Behandlung nicht melanozytärer Hauttumoren (NMSC) etablieren. Der Einsatz bei entzündlichen Hauterkrankungen stellt eine neuere Entwicklung dar, welche jedoch noch durch weitere randomisierte, placebokontrollierte Studien belegt werden muss.
Das Wirkprinzip der PDT basiert auf der Interaktion zwischen einem Photosensibilisator (PS) und Licht. Die bei der PDT eingesetzten Wirkstoffe – meist 5-Aminolävulinsäure (5-ALA) oder deren Ester Methyl-5-aminolevulinat (MAL) – fungieren als Prodrugs, welche abhängig von der Zellaktivität zu photoaktivierbaren Porphyrinen, vor allem ProtoporphyrinIX (PpIX), metabolisiert werden. Da dieser Schritt mit der Proliferationsrate der Zellen einhergeht, kommt es in Tumorzellen sowie virusinfizierten Zellen zu einer besonders hohen Anreicherung von PpIX. Durch nachfolgende Bestrahlung mit sichtbarem Licht (600–800nm) kommt es in weiterer Folge zu einer Akkumulierung freier Sauerstoffradikale („reactive oxygen species“, ROS), welche zu Nekrose und einer erhöhten Apoptoserate führen.1 Im Gegensatz zu vielen anderen Therapien bietet die PDT nicht nur die Möglichkeit, einzelne Läsionen oder Hautregionen zu behandeln, sondern hat auch das Pozential, die Entwicklung neuer Läsionen zu verzögern oder sogar zu verhindern. Areale, in welchen besonders hohe Mengen von PpIX kumulieren, zeigen eine charakteristische Hautfluoreszenz, welche die Detektion vormals klinisch unentdeckter Hautläsionen ermöglicht.2 Anders als bei den meisten klassischen Indikationen steht bei der Behandlung entzündlicher Hauterkrankungen nicht die Gewebsdestruktion, sondern die immunmodulierende Wirkung der PDT im Vordergrund.
Durchführung der PDT
Unabhängig vom verwendeten PS erfolgt die Durchführung der konventionellen PDT (cPDT) nach einem ähnlichen Schema. Nach Reinigung der zu behandelnden Läsionen wird der PS rund 1mm dick okklusiv unter einer Folie für 3 bis 4 Stunden auf das zu behandelnde Areal aufgetragen. Die Okklusion dient der verbesserten Aufnahme und erhöhten PpIX-Synthese im Zielgewebe und erhöht die Effektivität der PDT signifikant, geht aber gleichzeitig mit etwas stärkeren Schmerzen einher.3 Um eine vorzeitige oberflächliche Aktivierung von PpIX zu minimieren und eine stärkere Tiefenwirkung zu erzielen, wird die behandelte Stelle bis zur Bestrahlung häufig mit einem lichtundurchlässigen Verband verdeckt.2 Anschließend erfolgt die Bestrahlung mit einer Lichtquelle (LED-Lampe, Metallhalogenlampe, Laser), welche Licht der erforderlichen Wellenlänge emittiert. Bei hyperkeratotischen Veränderungen kann eine vorherige oberflächliche Abtragung der verdickten Hornschichten die Wirksamkeit der PDT erhöhen. Die besten Ergebnisse wurden im Rahmen einer Studie mit ablativem Laser, gefolgt von Microdermabrasio, Microneedling und Curettage, erzielt.4
Einen vielversprechenden Ansatz, welcher mit einer deutlich niedrigeren Schmerzintensität und dadurch erheblich besseren Tolerabilität einhergeht, stellt die Tageslicht-PDT („daylight PDT“, dPDT) dar. Diese benötigt im Gegensatz zur konventionellen PDT keine künstliche Lichtquelle, sondern wird mit Sonnenlicht durchgeführt, wodurch sich einige Unterschiede in der Durchführung ergeben. Ca. 15 Minuten vor dem Auftragen des PS wird eine Sonnencreme mit organischem UV-Filter appliziert. Nach anschließender Applikation des PS (ohne Okklusion) erfolgt innerhalb von 30 Minuten ein zweistündiger Aufenthalt im Freien, bei dem das zu behandelnde Hautareal dem Sonnenlicht ausgesetzt wird.5,6 Diese Form der PDT ist von Umwelteinflussfaktoren wie der geografischen Lage, der Außentemperatur und der applizierten Tageslichtdosis abhängig. Die Mindesttemperatur für eine Behandlung liegt bei 10°C.5 Aktuelle Anwendungsgebiete umfassen NMSC und aktinische Keratosen (AK). Zudem bietet diese Behandlungsform aufgrund der nahezu schmerzfreien Durchführbarkeit auch die Möglichkeit, größere Areale mit Feldkanzerisierung zu behandeln.6
Applikationsformen und Präparate
Über lange Zeit wurden für die ALA-PDT magistral hergestellte ALA-Präparate verwendet. Mittlerweile gibt es mehrere industriell hergestellte ALA- und MAL-Zubereitungen, welche sowohl für die cPDT als auch dPDT zugelassen sind.
Metvix® (Galderma, Paris, Frankreich) enthält 160mg/g MAL und kann sowohl bei cPDT als auch dPDT eingesetzt werden. Es ist für die Behandlung von AK, Morbus Bowen und Basaliomen in Europa zugelassen.2
Ein weiteres MAL-Präparat, welches ebenfalls 160mg/g MAL enthält, ist Luxerm® (Galderma, Paris, Frankreich). Im Gegensatz zu Metvix® ist dieses Präparat jedoch nur in Kombination mit dPDT anwendbar.
BF-200 ALA Ameluz® (Biofrontera Bioscience GmbH, Leverkusen, Deutschland) ist eine lipidhaltige Nanoemulsion mit einem Anteil von 7,8% 5-ALA, welche für die Behandlung von AK entwickelt wurde. Es weist eine erhöhte Hautpenetration sowie verbesserte Stabilität im Vergleich zu konventionellen 5-ALA-Präparaten auf.7 Das Präparat wurde bereits in der Behandlung von Basaliomen, Condylomata acuminata und vulvären intraepithelialen Neoplasien angewandt und zeigte in bisherigen Studien eine hohe Wirksamkeit und Sicherheit. Es kann sowohl im Rahmen von cPDT als auch dPDT eingesetzt werden.
Eine andere Applikationsform, um den photosensibilisierenden Wirkstoff zielgerichtet in sein Einsatzgebiet zu bringen, stellt das Präparat Alacare® (Photonamic GmbH & Co KG, Pinneberg, Deutschland) dar. Hierbei handelt es sich um ein 2x2cm großes Pflaster, welches eine standardisierte Menge von 2mg ALA pro cm2 enthält. Dieses ist für die Behandlung von AK im Gesicht und auf der Kopfhaut in Österreich und Deutschland zugelassen. Der Hauptvorteil dieser Applikationsform ist das Wegfallen der zusätzlichen Okklusion.
Ein 20%-5-ALA-Präparat, welches in Kombination mit blauem Licht für die Behandlung von AK am Capillitium und Gesicht in Amerika registriert ist, jedoch keine klinische Zulassung für Europa besitzt und deshalb nur zur Vollständigkeit erwähnt wird, ist Levulan Kerastick® (DUSA Pharmaceuticals, Wilmington, Massachusetts, USA).2
Lichtquellen
PpIX besitzt mehrere Lichtabsorptionsspitzen mit einem Maximum im blauen Spektrum bei 410nm. Die meisten in der cPDT eingesetzten Lichtquellen verwenden jedoch ein Lichtspektrum im Bereich von 600–800nm (p.m.630nm).2 Diese Strahlen bieten eine höhere Eindringtiefe von bis zu 3mm und reichen daher bis in die tieferen Hautschichten. Die eingesetzten Lichtquellen umfassen neben natürlichem Sonnenlicht für die dPDT inkohärente Xenon- und Halogenlampen sowie verschiedene Lasertypen (gepulste Farbstofflaser, Argonlaser, Diodenlaser). In letzter Zeit haben sich neben Leuchtdioden (LED) auch „Intense pulsed light“-Lampen (IPL) als Lichtquelle für die PDT etabliert. Letztere werden vorwiegend in der Behandlung von AK, Photorejuvenation und Acne vulgaris eingesetzt.
Nebenwirkungen der PDT
Die PDT wird üblicherweise sehr gut toleriert, die häufigste unerwünschte Wirkung sind Schmerzen, welche einen limitierenden Faktor darstellen und gelegentlich sogar zu einem Therapieabbruch führen können. Weiters induziert die PDT eine phototoxische Hautreaktion, die sich als Erythem, Ödem, Blasen- und Pustelbildung und in seltenen Fällen als uritikarielle Reaktion manifestiert (Abb. 1b).8 Eine durch die PDT ausgelöste lokalisierte Photosensitivität kann bis zu 48 Stunden bestehen.8 Im Allgemeinen sind die kosmetischen Ergebnisse ausgezeichnet, in Ausnahmefällen können reversible Pigmentverschiebungen im behandelten Hautareal beobachtet werden.
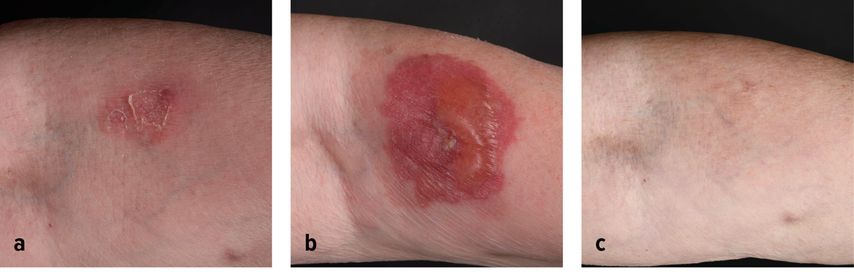
Abb. 1: Morbus Bowen am linken Unterarm vor PDT (a). Bullöse phototoxische Reaktion eine Woche nach der PDT (b). Komplette Abheilung von Morbus Bowen 6 Monate nach PDT (c)
Grundsätzlich lässt sich der im Zuge der PDT auftretende Schmerz in 2 Kategorien einteilen: neurogener Schmerz zu Beginn der Bestrahlung und inflammatorisch bedingter Schmerz nach Abschluss der PDT. Die Mechanismen der Schmerzentstehung sind nicht genau geklärt, eine gängige Theorie ist, dass ROS, welche während der PDT freigesetzt werden, Nervenenden direkt oder indirekt über inflammatorische Nebenprodukte stimulieren.1 Die unmittelbar mit Beginn der Bestrahlung auftretenden Schmerzen äußern sich in Form eines scharfen Brennens und Stechens. Die interindividuelle Wahrnehmung ist hierbei sehr hoch, 16–20% der Patienten geben während einer cPDT-Behandlung starke Schmerzen an, welche bei bis zu 44% aller Patienten eine schmerzlindernde Intervention notwendig machen.8,9 Die Größe des behandelten Areals wie auch die Lokalisation haben einen Einfluss auf die Schmerzintensität, so werden Behandlungen im Kopfbereich und den Extremitäten sowie von größeren Arealen als schmerzhafter empfunden.1,9Auch Folgebehandlungen werden von einem Großteil der Patienten als schmerzhaft wahrgenommen.10 Im Rahmen von Studien gaben Teilnehmer bei MAL-PDT-Behandlungen sowohl während als auch 24h nach der Behandlung signifikant geringere Schmerzen im Vergleich zu ALA-PDT-Behandlungen an.11,12
Schmerzmanagement
Die gängigste Maßnahme zur Unterdrückung des PDT-induzierten Schmerzes ist die Kühlung des bestrahlten Hautareals durch Besprühen mit kaltem Wasser oder Zuführen kalter Luft mittels eines Ventilators oder Luftstrahles (CRIOjet™; maximale Kühlung je nach Modell –32°C bis –60°C). Der Einsatz von Kaltluftstrahlern („cold air blower“) zeigte im Rahmen von Studien einen signifikanten, schmerzlindernden Effekt und eine erhöhte Patientenzufriedenheit.13
Die Anwendung topisch applizierter Anästhetika wie EMLA®, Lidocain-Creme oder Morphin-Gel erbrachte keine signifikante Schmerzlinderung.8 Im Gegensatz dazu konnte sowohl durch subkutane Infiltration mit Lokalanästhetika als auch durch periphere Nervenblockade eine signifikante Schmerzreduktion erzielt werden. Wenngleich diese Maßnahmen die effektivste Schmerzreduktion bewirken, sind sie gleichzeitig mit einem erheblichen potenziellen Nebenwirkungsrisiko (Hämatome, Schwellung, Dysästhesien, Parästhesien, Nervenschäden) verbunden und können im Falle der peripheren Nervenblockade auch nur an bestimmten Stellen eingesetzt werden. Aus diesem Grund sollte die Anwendung nach sorgfältiger Abwägung durchgeführt werden.8 Zur Prävention des PDT-induzierten Schmerzes werden auch häufig systemisch verabreichte nichtsteroidale Antirheumatika verwendet, obwohl deren Wirksamkeit in einer eigenen, placebokontrollierten Studie nicht belegt werden konnte (Radakovic et al., Manuskript in Vorbereitung).
Onkologische Indikationen
Aktinische Keratosen (AK, Plattenepithelkarzinom in situ, Empfehlungsgrad A)2 sind die häufigsten malignen Hautveränderungen, die in Abhängigkeit von Ausprägung, Lokalisation und Ausdehnung unterschiedlich gut auf eine PDT ansprechen. Ausgezeichnete Ergebnisse werden bei multiplen, leichten bis mittelschweren (Grad I–II nach Olsen) AK am Capillitium und im Gesicht erzielt. Drei Monate nach der Behandlung konnten vollständige Abheilungsraten von 81–92% erzielt werden.2 Hyperkeratotische Läsionen (Grad III nach Olsen), akrale Läsionen und AK an den Extremitäten beziehungsweise am Handrücken sprechen schlechter auf die PDT an. Ein großer Vorteil der Therapie von AK mit PDT ist die Möglichkeit, vergleichsweise große Areale, insbesondere am Capillitium, zu behandeln, wodurch auch subklinische Läsionen miterfasst werden. Im Vergleich zur Kryotherapie bietet die PDT eine 14% höhere Chance auf eine vollständige Abheilung nach 3 Monaten bei oberflächlichen AK im Gesicht und an der Kopfhaut.13 Auch im Zuge der dPDT wird das beste Ansprechen bei oberflächlichen Läsionen erreicht, mit zunehmender Dicke nimmt auch die Effektivität der Behandlung ab. Während Grad-I-Läsionen noch eine Abheilungsrate von 76% zeigten, kam es bei Grad-II-Läsionen lediglich bei 61% und bei Grad-III-Läsionen bei 49% zu einer vollständigen Abheilung nach 3 Monaten.14
Während die Behandlung der aktinischen Cheilitis in früheren Studien nur mäßige Ergebnisse erzielte (47% vollständige Abheilung nach 3 Monaten),15 konnten durch den Einsatz von Alacare erheblich höhere Ansprechraten erreicht werden. Im Rahmen zweier Studien unserer Arbeitsgruppe wurden vollständige Abheilungsraten von 89% beziehungsweise 84% der behandelten Läsionen 3 und 12 Monate nach der Therapie beobachtet.16,17 Ein weiterer möglicher Ansatz zur Verbesserung des Ansprechverhalten ist die Kombination mehrerer Therapien, wie beispielsweise die Kombination von MAL-PDT mit Imiquimod oder mit ablativem YAG-Laser.18,19
Eine häufig beobachtete Nebenwirkung bei der PDT der aktinischen Cheilitis stellt die Reaktivierung von Herpes simplex dar, welche bei 15–45% aller Patienten auftreten kann. Dies ist jedoch mit Virustatika gut behandelbar und sollte bei vorbekannten rezidivierenden Herpes-labialis-Beschwerden bedacht werden.16,17
Morbus Bowen (Empfehlungsgrad A)2, welcher sich oft als etwas größere Läsion im Gesicht und an den Extremitäten manifestiert, gehört zu den klassischen Indikationen der PDT. Die Ansprechrate bei MAL-PDT liegt zwischen 93 und 100% nach 3 Monaten und 68% nach 24 Monaten (Abb. 1). Dünne, gut differenzierte Läsionen zeigen hierbei ein besseres Ansprechverhalten, der Durchmesser scheint keinen Einfluss auf das Ergebnis zu haben.20–22 Um die Entstehung von Rezidiven zu verringern, wird eine ein- oder zweimalige Wiederholung der Bestrahlung in einwöchigen Abständen empfohlen. Im Vergleich zur Kryotherapie und Behandlung mit 5-Fluorouracil erzielte die PDT eine signifikant höhere Abheilungsrate, die Rezidivrate war jedoch in allen Gruppen ähnlich.23
Mit zunehmender Invasivität nimmt auch das Ansprechverhalten von invasiven Plattenepithelkarzinomen ab. In dieser Indikation hat die PDT den niedrigstmöglichen Empfehlungsgrad D.2 Während mikroinvasive Formen noch eine Ansprechrate von 58% nach 24 Monaten zeigen, liegt diese bei den invasiven Formen lediglich bei 26%. Aufgrund der Gefahr einer inkompletten Abheilung und potenziellen Metastasierung sollten diese Tumoren nicht als primäre Indikation für eine PDT angesehen werden.2,20
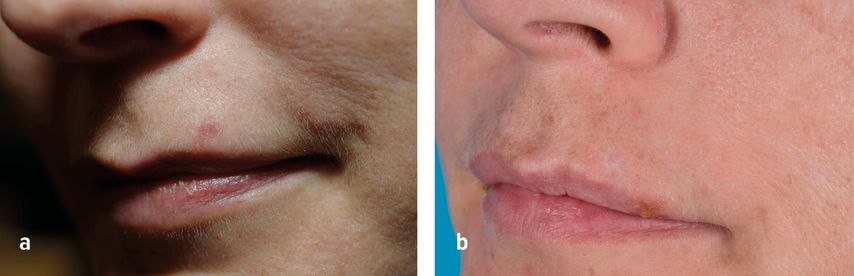
Oberflächliche Basaliome (Tumordicke <2mm, Empfehlungsgrad A)2 können sehr gut mit PDT behandelt werden, jedoch nimmt die Erfolgsrate mit zunehmender Tumordicke ab (Abb. 2). In einer aktuellen Studie konnten im Beobachtungszeitraum von 3 Jahren Abheilungsraten von 96% erzielt werden.24 Ein aktueller Cochrane-Review zeigte, dass chirurgische Interventionen die niedrigsten Rezidivraten aufweisen (0% vs. 36,4% nach 3 Jahren), allerdings bietet die PDT ein besseres kosmetisches Ergebnis. Eine gute alternative Behandlungsoption stellt Imiquimod dar, welches ähnlich gute kosmetische Ergebnisse bei geringer Rezidivrate liefert.25
Abb. 2: Oberflächliches Basaliom an der Oberlippe links vor (a) und 12 Monate nach zwei PDT-Zyklen (b)
Die PDT ist keine First-Line-Option für noduläre Basaliome, erhält allerdings dennoch einen Empfehlungsgrad A.27 Eine aktuelle Studie konnte zeigen, dass durch die Kombination von PDT mit vorheriger chirurgischer Abtragung des nodulären Tumoranteils („debulking“) Abheilungsraten von 95% über einen Beobachtungszeitraum von 3 Jahren erzielt werden können.24
PDT kann bei Patienten mit Mycosis fungoides eingesetzt werden, hat jedoch lediglich einen Empfehlungsgrad C.26 Speziell Läsionen im Frühstadium an anatomisch schwer zugänglichen Stellen wie den Händen/Füßen oder der Genitalregion können von der Behandlung profitieren. Die Behandlung erfolgt hierbei meist 1x pro Woche über mehrere Wochen. Die aktuelle Studienlage ist jedoch limitiert und Studien mit größeren Fallzahlen werden benötigt, um klare Empfehlungen aussprechen zu können.27,28
Nicht onkologische Indikationen
In den letzten Jahren konnte sich die PDT zunehmend auch in der Behandlung nicht onkologischer Indikationen etablieren. Hierzu vorliegende Ergebnisse stammen zumeist von Fallberichten oder kleineren Fallserien.
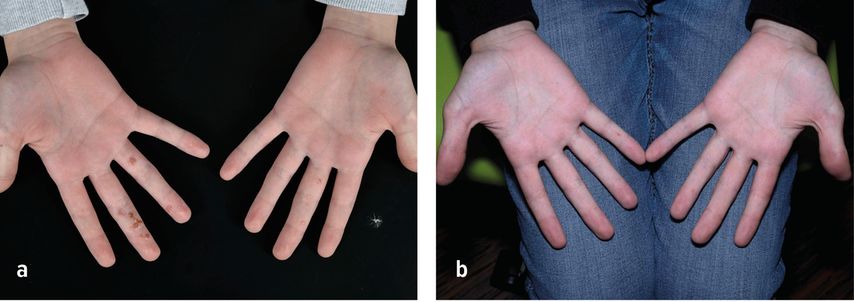
Die PDT von vulgären und genitalen Warzen besitzt einen Empfehlungsgrad B.26 Histologisch kommt es hierbei zu einer Nekrose und Apoptose von Keratinozyten mit einer Abheilungsrate von 50–100%.26,29 Auch periunguale Warzen zeigen ein sehr gutes Ansprechen (96% Erfolgsrate), superfizielles Shaving vor der PDT kann sich zudem positiv auf das Therapieansprechen auswirken (Abb. 3).30 Das Hauptproblem bei der Behandlung von Warzen sind die oftmals erheblichen Schmerzen während der Bestrahlung, welche trotz großer Behandlungsmotivation bei einem Teil der Patienten zu einem Therapieabbruch führen.
Abb. 3: Therapieresistente Warzen an der Hand eines 12-jährigen Jungen vor (a) und 3 Monate nach wiederholter PDT in Kombination mit einer keratolytischen Therapie (b)
Die Therapie genitaler Warzen gestaltet sich aufgrund ihrer hohen Rezidivneigung oftmals sehr komplex. Ein aktueller Review über die Behandlung genitaler Warzen konnte zeigen, dass ALA-PDT im Vergleich zu Laserbehandlung und topischen Therapien mit der höchsten Abheilungsrate (96%) und niedrigsten Rezidivrate (7,5%), aber auch den meisten Nebenwirkungen (zumeist starke Schmerzen) einhergeht. Die Mitbehandlung subklinischer Läsionen wird als mögliche Ursache für die niedrige Rezidivrate nach PDT angesehen. Durch die hohe Ansprechrate kann die PDT jedoch dennoch als First-Line-Therapie betrachtet werden.31
Obwohl der genaue Wirkmechanismus der PDT bei Acne vulgaris (Empfehlungsgrad B)26 nicht vollständig geklärt ist, geht man davon aus, dass die antibakterielle Wirkung der PDT gegenüber Propionibacterium acnes, antiinflammatorische Effekte und eine selektive Anreicherung von Photosensibilisatoren in den Talgdrüsen, welche zu einer Unterdrückung und Zerstörung dieser führt, für den therapeutischen Effekt verantwortlich sind.32 Speziell bei inflammatorischer Akne moderater Ausprägung lassen sich gute Effekte mit der PDT erzielen.33
Die Behandlung chronischer Psoriasis vulgaris (Empfehlungsgrad D)26 ergab enttäuschende Ergebnisse. Einerseits war das Ansprechen auf die Therapie nur mäßig und nicht vorhersagbar, andererseits war die Bestrahlung oft von starken Schmerzen begleitet, weshalb die PDT für die lokalisierte Plaque-Psoriasis nicht empfohlen werden kann.34
Granulomatöse Erkrankungen wie Necrobiosis lipoidica (NL) und Granuloma anulare (GA) sind potenzielle Indikationen für die PDT, erhalten jedoch aufgrund der spärlichen Datenlage lediglich einen Empfehlungsgrad C.26 Aufgrund der großen Variabilität der Ergebnisse und der geringen Datenlage sind größere klinische Studien notwendig, um die Effektivität der PDT bei granulomatösen Erkrankungen klar einordnen zu können.
Die PDT der kutanen Leishmaniose (Empfehlungsgrad B)26 stellt eine wirksame Therapieoption mit guten kosmetischen Ergebnissen dar.35 Der genaue Wirkmechanismus ist nicht bekannt, vermutet wird eine Zerstörung der Protozoen durch die Entstehung reaktiver Sauerstoffradikale. Entgegen dieser Annahme hatte die PDT in Studien keinen signifikanten Einfluss auf die Parasitenlast, ging jedoch mit einer signifikanten Reduktion der Läsionsgröße einher und führte in einer Studie bei 91% der Patienten zu einer vollständigen Abheilung nach 9 Monaten.36,37
Neben AK und oberflächlichen NMSC weist auch die Hautverjüngung („Photorejuvenation“) einen Empfehlungsgrad A auf. Hierbei zeigen sich eine signifikante Reduktion feiner Falten, Teleangiektasien und Lentigines solares sowie eine Verbesserung der Hauttextur.38In-vitro-Untersuchungen konnten eine gesteigerte Fibroblastenproliferation, ein erhöhtes Kollagenvolumen und eine Verringerung von degeneriertem elastotischem Material feststellen.39 Zudem konnte eine Reduktion von Ki-67 und p53 (Marker, welche für Proliferation und Karzinogenese verantwortlich sind) beobachtet werden.40 Bei der Photorejuvenation wird die PDT mit einer wesentlich geringeren PS-Konzentration und niedrigeren Lichtdosis, häufig mit IPL, durchgeführt. Sonografische Messungen der Haut vor und nach der PDT-Behandlung konnten eine Zunahme der Hautdicke sowie eine Reduktion der subepidermalen Lichtschädigung belegen, jedoch sind meist mehrere Zyklen notwendig, um einen anhaltenden Effekt zu erzielen.38
Literatur:
1 Wang B et al.: Gain with no pain? Pain management in dermatological photodynamic therapy. Br J Dermatol 2017; 177(3): 656-65 2 Morton CA et al.: European Dermatology Forum guidelines on topical photodynamic therapy 2019 Part 1: treatment delivery and established indications – actinic keratoses, Bowen’s disease and basal cell carcinomas. J Eur Acad Dermatology Venereol 2019; 33(12): 2225-38 3 Meierhofer C et al.: The impact of occlusive vs non-occlusive application of 5-aminolevulinic acid (BF-200 ALA) on the efficacy and tolerability of photodynamic therapy for actinic keratosis on the scalp and face: A prospective within-patient comparison trial. Photodermatol Photoimmunol Photomed 2021; 37(1): 56-62 4 Bay C et al.: Comparison of physical pretreatment regimens to enhance protoporphyrin IX uptake in photodynamic therapy: A randomized clinical trial. JAMA Dermatology 2017; 153(4): 270-78 5 Wiegell SR et al.: Weather conditions and daylight-mediated photodynamic therapy: protoporphyrin IX-weighted daylight doses measured in six geographical locations. Br J Dermatol 2013; 168(1): 186-91 6 Wiegell SR et al.: Daylight photodynamic therapy for actinic keratosis: An international consensus: International Society for Photodynamic Therapy in Dermatology. J Eur Acad Dermatology Venereol 2012; 26(6): 673-79 7 Dirschka T et al.: Photodynamic therapy with BF-200 ALA for the treatment of actinic keratosis: results of a multicentre, randomized, observer-blind phase III study in comparison with a registered methyl-5-aminolaevulinate cream and placebo. Br J Dermatol 2012; 166(1): 137-46 8 Ibbotson SH et al.: Adverse effects of topical photodynamic therapy: a consensus review and approach to management. Br J Dermatol 2019; 180(4): 715-29 9 Miller IM et al.: Factors related to pain during routine photodynamic therapy: a descriptive study of 301 patients. J Eur Acad Dermatology Venereol 2011; 25(11): 1275-81 10 Lindeburg KEK et al.: Pain and photodynamic therapy. Dermatology 2007; 215(3): 206-08 11 Wiegell SR et al.: Pain associated with photodynamic therapy using 5-aminolevulinic acid or 5-aminolevulinic acid methylester on tape-stripped normal skin. Arch Dermatol 2003; 139(9): 1173-77 12 Wiegell SR, Wulf HC: Photodynamic therapy of acne vulgaris using 5-aminolevulinic acid versus methyl aminolevulinate. J Am Acad Dermatol 13 Patel G et al.: Efficacy of photodynamic therapy vs other interventions in randomized clinical trials for the treatment of actinic keratoses a systematic review and meta-Analysis. JAMA Dermatology 2014; 150(12): 1281-88 14 Wiegell SR et al.: Daylight-mediated photodynamic therapy of moderate to thick actinic keratoses of the face and scalp: a randomized multicentre study. Br J Dermatol 2012; 166(6): 1327-32 15 Berking C et al.: The efficacy of photodynamic therapy in actinic cheilitis of the lower lip: a prospective study of 15 patients. Dermatologic Surg 2007; 33(7): 825-30 16 Radakovic S et al.: 5-Aminolevulinic acid patch (Alacare) photodynamic therapy for actinic cheilitis: data from a prospective 12-month follow-up study on 21 patients. J Eur Acad Dermatology Venereol 2020; 34(9): 2011-15 17 Radakovic S, Tanew A: 5-aminolaevulinic acid patch-photodynamic therapy in the treatment of actinic cheilitis. Photodermatol Photoimmunol Photomed 2017; 33(6): 306-10 18 Sotiriou E et al.: Sequential use of photodynamic therapy and imiquimod 5% cream for the treatment of actinic cheilitis: a 12-month follow-up study. Br J Dermatol 2011; 165(4): 888-92 19 Choi SH et al.: Efficacy of ablative fractional laser-assisted photodynamic therapy for the treatment of actinic cheilitis: 12-month follow-up results of a prospective, randomized, comparative trial. Br J Dermatol 2015; 173(1): 184-91 20 Calzavara-Pinton PG et al.: Methylaminolaevulinate-based photodynamic therapy of Bowen’s disease and squamous cell carcinoma. Br J Dermatol 2008; 159(1): 137-44 21 Lehmann P: Methyl aminolaevulinate-photodynamic therapy: a review of clinical trials in the treatment of actinic keratoses and nonmelanoma skin cancer. Br J Dermatol 2007; 156(5): 793-801 22 Cavicchini S et al.: Long-term follow-up of metil aminolevulinate (MAL)-PDT in difficult-to-treat cutaneous Bowen’s disease. Int J Dermatol 2011; 50(8): 1002-05 23 Zhong S et al.: Efficacy of photodynamic therapy for the treatment of Bowen’s disease: an updated systematic review and meta-analysis of randomized controlled trials. Photodiagnosis Photodyn Ther 2020; 32: 102037 24 Gómez C et al.: Methyl aminolevulinate photodynamic therapy after partial debulking in the treatment of superficial and nodular basal cell carcinoma: 3-years follow-up. Photodiagnosis Photodyn Ther 2021; 33: 102176 25 Thomson J et al.: Interventions for basal cell carcinoma of the skin. Cochrane Database Syst Rev 2020; 2020(12) 26 Morton CA et al.: European Dermatology Forum guidelines on topical photodynamic therapy 2019 Part 2: emerging indications – field cancerization, photorejuvenation and inflammatory/infective dermatoses. J Eur Acad Dermatology Venereol 2020; 34(1): 17-29 27 Pileri A et al.: Photodynamic therapy: an option in mycosis fungoides. Photodiagnosis Photodyn Ther 2017; 20: 107-10 28 Jang MS et al.: Erratum: Folliculotropic mycosis fungoides in 20 Korean cases: clinical and histopathologic features and response to ultraviolet a-1 and/or photodynamic therapy. Ann Dermatol 2018; 30(2): 192-201 29 Wang H et al.: 5-Aminolaevulinic acid-based photodynamic therapy induces both necrosis and apoptosis of keratinocytes in plantar warts. J Cosmet Laser Ther 2020; 22(3): 165-70 30 Wu L et al.: Efficacy of the combination of superficial shaving with photodynamic therapy for recalcitrant periungual warts. Photodiagnosis Photodyn Ther 2019; 27: 340-44 31 Kechichian E et al.: The place of 5-aminolaevulinic acid-photodynamic therapy in the treatment landscape of urethral warts: a systematic review. Photodiagnosis Photodyn Ther 2021; 33: 102204 32 Tang X et al.: Efficacy of photodynamic therapy for the treatment of inflammatory acne vulgaris: a systematic review and meta-analysis. J Cosmet Dermatol 2020; 19(1): 10-21 33 Wojewoda K et al.: Optimizing treatment of acne with photodynamic therapy (PDT) to achieve long-term remission and reduce side effects. A prospective randomized controlled trial. J Photochem Photobiol B Biol 2021; 223: 112299 34 Schleyer V et al.: Disappointing results and low tolerability of photodynamic therapy with topical 5-aminolaevulinic acid in psoriasis. A randomized, double-blind phase I/II study. J Eur Acad Dermatol Venereol 2006; 20(7): 823-8 35 Heras-Mosteiro J et al.: Interventions for Old World cutaneous leishmaniasis. Cochrane Database Syst Rev 2017; 11(11): CD005067 36 Cabral FV et al.: Towards effective cutaneous leishmaniasis treatment with light-based technologies. A systematic review and meta-analysis of preclinical studies. J Photochem Photobiol B 2021; 221: 112236 37 Khan K et al.: Fractionated illumination improves the treatment outcomes of photodynamic therapy for high grade cutaneous leishmaniasis. Photodiagnosis Photodyn Ther 2020; 29: 101622 38 Karrer S et al.: Photodynamische Therapie zur Hautverjüngung: Übersicht und publizierte Datenlage – Ergebnisse einer Konsensus-Konferenz des Arbeitskreises Ästhetische Photodynamische Therapie. JDDG - J Ger Soc Dermatology. 2013; 11(2): 137-48 39 Jang YH et al.: Prolonged activation of ERK contributes to the photorejuvenation effect in photodynamic therapy in human dermal fibroblasts. J Invest Dermatol. 2013; 133(9): 2265-75 40 Bagazgoitia L et al.: Photodynamic therapy reduces the histological features of actinic damage and the expression of early oncogenic markers. Br J Dermatol 2011; 165(1): 144-51
Das könnte Sie auch interessieren:
Biologika-Therapie: Pipeline und Klinik
Biologika bieten die Option, in die hinter der atopischen Dermatitis stehenden Immunprozesse gezielt einzugreifen. Dieser Weg wurde zuerst mit dem Anti-IL-4/IL-13-Antikörper Dupilumab ...
Zentrale Aspekte bei atopischer Dermatitis
Über die medikamentöse Therapie hinaus bleiben die Berücksichtigung von Umweltfaktoren, die Sicherstellung der Adhärenz und die Anpassung der Therapie an Begleiterkrankungen oder ...
Neuer Wirkstoff bei Acne vulgaris
Acne vulgaris führt vor allem während der Pubertät zu Leidensdruck bei Betroffenen. Zur Behandlung stehen je nach Ausprägung verschiedene Therapeutika zur Verfügung, kürzlich wurde der ...