Ipilimumab und Nivolumab bei metastasiertem Merkelzellkarzinom
Autor:innen:
Sarah Franzmair
Dr. Siegfried Seirl
Abteilung für Haut- und Geschlechtskrankheiten
Klinikum Wels-Grieskirchen
E-Mail: dermatologie@klinikum-wegr.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Merkelzellkarzinom ist ein seltenes, aber aggressives Malignom, dessen Behandlung eine große Herausforderung darstellt. Bei dem vorliegenden Patienten mit inoperablem Tumorstadium wurde nach Versagen der initialen Systemtherapie eine Kombination aus Ipilimumab und Nivolumab eingesetzt. Die damit verbundenen Nebenwirkungen erfordern allerdings ein sorgfältiges Management.
Keypoints
-
Das Merkelzellkarzinom (MCC) ist ein aggressives Malignom, das schnell wächst und häufig metastasiert.
-
Neben der chirurgischen Behandlung wird je nach Stadium eine Radiatio oder eine Immuntherapie durchgeführt.
-
Bei fortgeschrittenen Tumorstadien bietet eine
-
Zweitlinientherapie mit Ipilimumab und Nivolumab vielversprechende Ergebnisse.
-
Das hohe Nebenwirkungsprofil dieser Kombinationstherapie bedarf sorgfältiger Überwachung und ggf. medizinischer Intervention.
Ein 65-jähriger Patient stellte sich aufgrund eines schnell wachsenden Tumors am Unterschenkel links vor. Histologisch ergab sich die Diagnose eines Merkelzellkarzinoms. Das Merkelzellkarzinom (MCC) ist ein seltenes, aber sehr aggressives Malignom der Haut. Bei dem 65-jährigen Patienten ohne nennenswerte Vorerkrankungen zeigte sich, wie bei ca. 30% aller MCC-Patienten, bereits bei Diagnosestellung eine lokoregionäre Metastasierung im Sinne eines pathologischen Lymphknotenpakets inguinal links und somit ein Tumorstadium IIIB.
Chirurgische Resektion
Primär wurde eine komplette Exzision des Primärtumors am Unterschenkel links sowie der Lymphknotenmetastasen inguinal links angestrebt. Am Unterschenkel gelang nach zwei operativen Eingriffen schließlich eine R0-Resektion (Abb.1). Inguinal erfolgte eine Lymphknotendissektion, hier konnte lediglich eine R2-Resektion erzielt werden (Abb. 2).
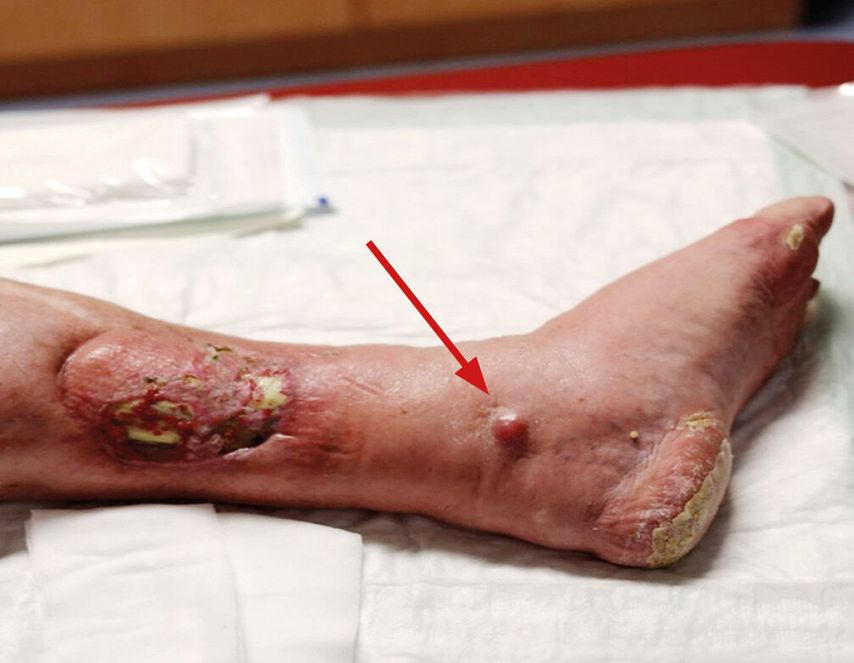
Abb. 1: Unterschenkel links nach Resektion des Primärtumors mit kutaner Metastase (Pfeil)
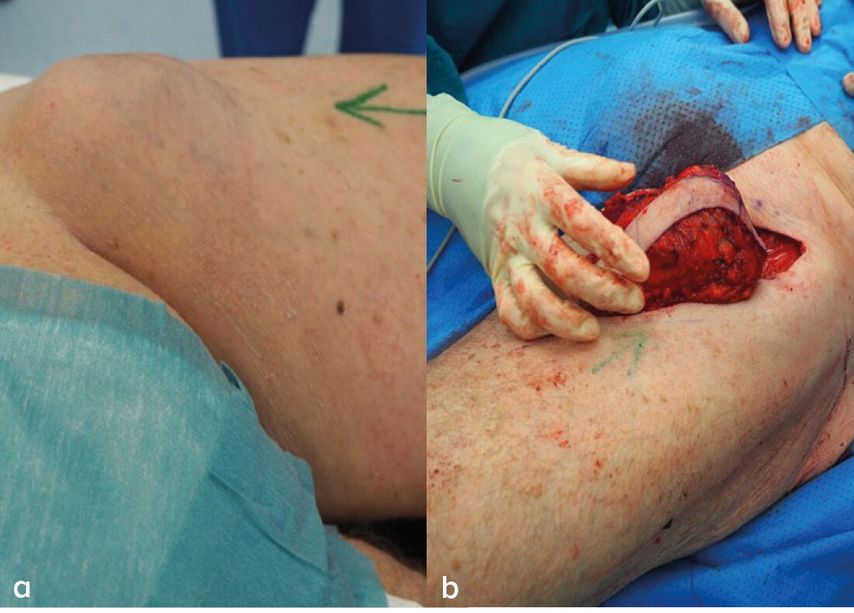
Abb. 2: (a) Lymphknotenpaket inguinal, (b) intraoperatives Bild nach LK-Dissektion
Systemtherapie nach Resektion
Aufgrund des inoperablen Tumorstadiums IIIB war eine Systemtherapie indiziert. Das Merkelzellkarzinom ist ein strahlensensibles Malignom und eine Radiatio stellt prinzipiell eine der möglichen Therapieoptionen dar. Da es jedoch bereits kurz nach der Operation am distalen linken Unterschenkel zu einer kutanen Metastase gekommen war, wurde leitliniengerecht eine Immuntherapie mit dem PD-L1-Inhibitor Avelumab eingeleitet.1
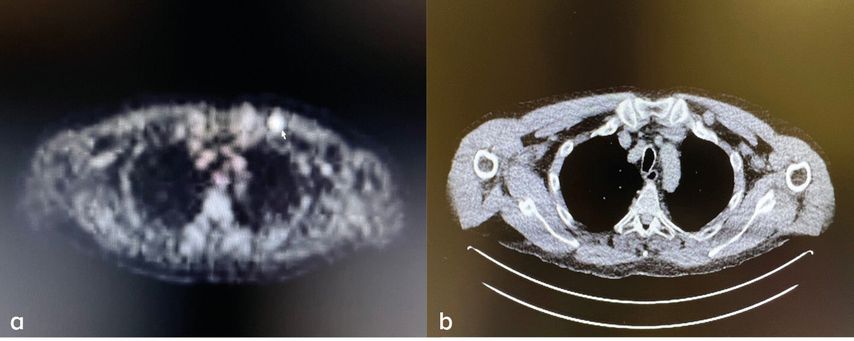
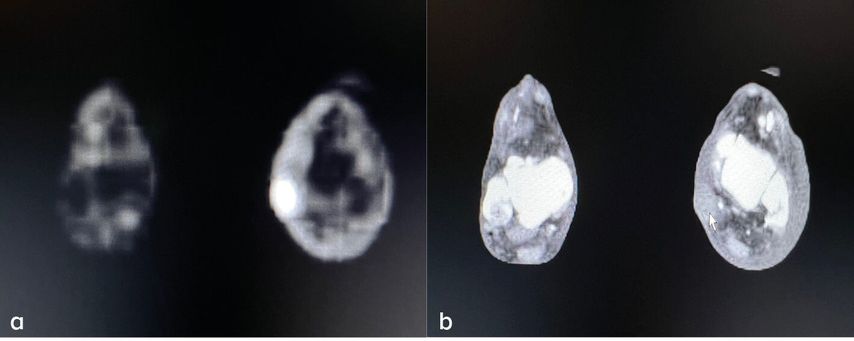
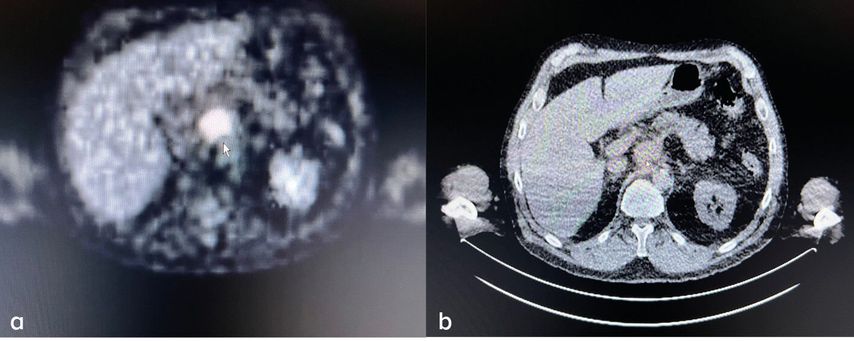
Es wurden acht Dosen Avelumab (300mg alle 3 Wochen) verabreicht, bevor die Therapie wegen einer histologisch gesicherten Befundprogredienz beendet werden musste. In der Staging-Untersuchung zeigten sich ein pathologischer Lymphknoten pektoral links (Abb. 3), neue kutane und subkutane Metastasen am linken Unterschenkel (Abb. 4), ein suspekter Lymphknoten im Bereich des Truncus coeliacus (Abb. 5) sowie eine Raumforderung im Colon transversum.
Zweitlinientherapie
Dadurch bedingt wurde eine Zweitlinientherapie mit dem CTLA-4-Inhibitor Ipilimumab (3mg/kgKG) und dem PD-1-Inhibitor Nivolumab (1mg/kgKG) eingeleitet. In der Literatur finden sich teils sehr positive Fallberichte zu diesem Vorgehen, andere vielversprechende Therapieoptionen sind allerdings rar.2–4
Nach drei Gaben Ipilimumab/Nivolumab musste der Patient aufgrund einer hyperglykämischen Entgleisung stationär aufgenommen werden – die Diagnose eines Checkpoint-Inhibitor-assoziierten Diabetes mellitus wurde gestellt. Zusätzlich entwickelte der Patient eine Kolitis Grad 2 sowie eine Lipasämie unter dieser Immunkombinationstherapie.
In einem erneuten Staging zeigte sich jedoch ein vollständiges Ansprechen ohne Darstellbarkeit der gesicherten fern- oder lokoregionären Metastasierung.
Immuntherapie-assoziierte Nebenwirkungen
Immuntherapie-bedingte Nebenwirkungen sind substanzübergreifend häufig, bei der Kombination von Ipilimumab und Nivolumab kann es in bis zu 95% der Fälle zu einer Form von therapiebedingten Nebenwirkungen kommen. Wird Nivolumab als Monopräparat verwendet, zeigen 78% der Patienten zumindest eine Form der Nebenwirkungen. 54% der Patienten berichten von schweren oder sehr schweren Nebenwirkungen (Grad 3 oder 4), die in einigen Fällen zu einer Behandlungspause, vorzeitigem Behandlungsabbruch oder in seltenen Fällen zum Tod geführt haben.5
Die Behandlung der Nebenwirkungen erfolgt meistens mit Methylprednisolon in gewichtsadaptierter Dosis von bis zu 2mg/kgKG. Immunsuppressiva stellen eine weitere Therapieoption dar; bei der Glukokortikoid-refraktären Kolitis kann der TNF-alpha-Blocker Infliximab (5mg/kgKG) angewendet werden.
Der vorgestellte Patient zeigte in diesem Fall unter Prednisolontherapie rasche Beschwerdefreiheit. Der neu aufgetretene Diabetes konnte nach primärer Etablierung einer Insulintherapie in Kombination mit diätischen Maßnahmen erfolgreich behandelt werden.
Erhaltungstherapie
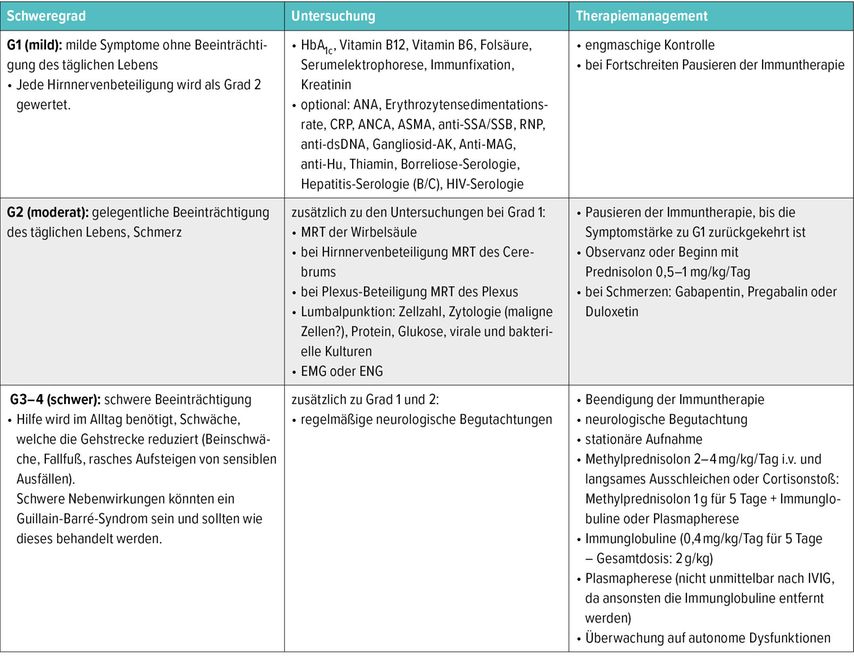
Es fehlen aktuell noch Daten zur Erhaltungstherapie beim Merkelzellkarzinom. In diesem Fall wurde nach Abklingen der Immuntherapie-assoziierten Nebenwirkungen eine Erhaltungstherapie mit Nivolumab (240mg alle 3 Wochen) eingeleitet. Nach zwei Gaben zeigte sich aber eine rasch progrediente, Immuntherapie-assoziierte sensible axonale Polyneuropathie. Auch hier erhielt der Patient 2mg/kgKG Prednisolon in ausschleichender Dosierung sowie Pregabalin gefolgt von Gabapentin; zusätzlich wurden intravenös Immunglobuline 2g/kgKG verabreicht. Eine alternative Therapieoption stellt die Plasmapherese dar.6,7 Eine Übersicht über die Stadieneinteilung und das Management der Immuntherapie-assoziierten Polyneuropathie bietet Tabelle 1.6
Tab. 1: Immuntherapie-assoziierte Polyneuropathie: Stadieneinteilung und Management nach ASCO-Guidelines (modifiziert nach Schneider BJ et al. 2021)6
Weiterer Verlauf
In den nachfolgenden Staging-Untersuchungen mittels PET-CT fand sich bis dato kein Hinweis auf ein hypermetaboles Rezidiv. Somit ist der an einem multilokulär metastasierten Merkelzellkarzinom erkrankte Patient über ein Jahr nach Immunkombinationstherapie weiterhin rezidivfrei.
Fazit
Die Kombinationstherapie mit Ipilimumab und Nivolumab hat sich als sehr effektiv bei der Behandlung vieler fortgeschrittener Tumorerkrankungen erwiesen, aber sie ist auch mit einem deutlich erhöhten Risiko für Immuntherapie-assoziierte Nebenwirkungen verbunden, die häufig (80–90% aller Patienten) und bei bis zu 50% der Patienten auch schwerwiegend sein können. Daher sind eine sorgfältige Überwachung und ein gutes Management der Nebenwirkungen entscheidend, um eine adäquate Patientenbetreuung zu ermöglichen.
Literatur:
1 Becker JC et al.: S2k-Leitlinie Merkelzellkarzinom – Update. Journal German Society of Derm 2022 2 Glutsch V et al.: Activity of ipilimumab plus nivolumab in avelumab-refractory merkel cell carcinoma. Cancer Immunol Immunother 2021; 70(7): 2087-93 3 Shalhout SZ et al.: A retrospective study of Ipilimumab plus Nivolumab in Anti-PD-L1/PD-1 refractory merkel cell carcinoma. J Immunother 2022; 45(7): 299-302 4 Kim S et al.: Combined nivolumab and ipilimumab with or without stereotactic body radiation therapy for advanced merkel cell carcinoma: a randomised, open label, phase 2 trial. Lancet 2022; 400(10357): 1008-19 5 Hassel JC et al.: Combined immune checkpoint blockade (Anti-PD-1/anti-CTLA-4): Evaluation and management of adverse drug reactions. Cancer Treat Rev 2017; 57: 36-49 6 Schneider BJ et al.: Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: ASCO Guideline update. J Clin Oncol 2021; 39(36): 4073-126 7 Kahler KC et al.: Side effect management during immune checkpoint blockade using CTLA-4 and PD-1 antibodies for metastatic melanoma - an update. J Dtsch Dermatol Ges 2020; 18(6): 582-609
Das könnte Sie auch interessieren:
Komorbiditäten bei atopischer Dermatitis
Atopische Dermatitis (AD) ist häufig mit atopischen und nicht atopischen Komorbiditäten assoziiert. Das Auftreten von Begleiterkrankungen bzw. das Risiko dafür kann in vielerlei Hinsicht ...
Biologika-Therapie: Pipeline und Klinik
Biologika bieten die Option, in die hinter der atopischen Dermatitis stehenden Immunprozesse gezielt einzugreifen. Dieser Weg wurde zuerst mit dem Anti-IL-4/IL-13-Antikörper Dupilumab ...
Zentrale Aspekte bei atopischer Dermatitis
Über die medikamentöse Therapie hinaus bleiben die Berücksichtigung von Umweltfaktoren, die Sicherstellung der Adhärenz und die Anpassung der Therapie an Begleiterkrankungen oder ...