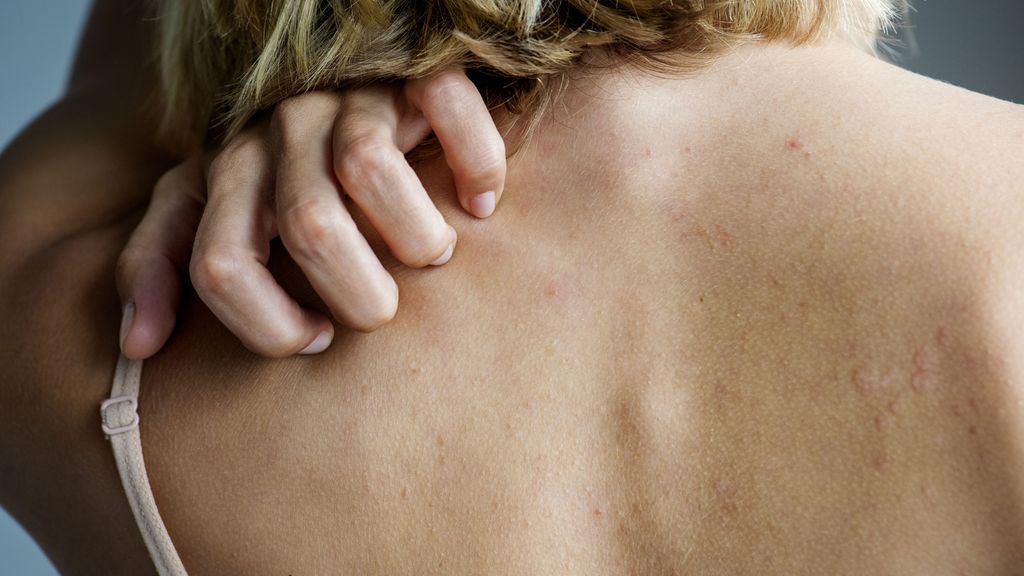
<p class="article-intro">Sowohl Ichthyosen als auch die atopische Dermatitis sind durch eine defekte Hautbarriere charakterisiert. Das Stratum corneum mit den zwei Kompartimenten, den Korneozyten und der lipidreichen Extrazellulärmatrix, stellt dabei die wichtigste Barriere der Haut dar. Ichthyosen werden durch Mutationen in Genen, die entweder am Aufbau der Korneozyten oder im Lipidmetabolismus eine wichtige Rolle spielen, verursacht.</p>
<hr />
<p class="article-content"><h2>Ichthyosis vulgaris</h2> <p>Die Ichthyosis vulgaris ist unter den Ichthyosen die häufigste Form und wird durch Funktionsverlust(„loss of function“)-Mutationen im Filaggrin-Gen hervorgerufen. Auch bei atopischer Dermatitis (AD) finden sich in ca. 25 % der Fälle Mutationen im Filaggrin-Gen. Filaggrin hat eine Schlüsselrolle in der epidermalen Differenzierung und bei der Aufrechterhaltung der Hautbarriere. Es wird aus dem Vorläufer-Phosphoprotein Profilaggrin gebildet, aggregiert im Stratum granulosum die Keratinfilamente und zerfällt schließlich im Stratum corneum in osmotisch aktive Aminosäuren, die durch Wasserbindung für die natürliche Hautfeuchte („natural moisturizing factor“) verantwortlich sind. Mutationen führen demnach zu einer extrazellulären Permeabilitätsstörung, die mit einem erhöhten transepidermalen Wasserverlust einhergeht.<sup>1</sup> Wichtig in diesem Kontext ist auch zu erwähnen, dass Filaggrin-Mutationsträger ein deutlich erhöhtes Risiko für die Entwicklung von allergischen Erkrankungen aufweisen, wie von Irvine et al<sup>2</sup> gezeigt werden konnte.</p> <p><img src="/custom/img/files/files_data_Zeitungen_2015_Jatros_Derma_1501_Weblinks_Seite16.jpg" alt="" width="305" height="283" /></p> <h2>Seltene Ichthyose-Formen</h2> <p>Die autosomal rezessiven angeborenen Ichthyosen (ARCI) stellen eine heterogene Gruppe von schweren nichtsyndromalen Ichthyosen dar. Bislang sind Mutationen in 9 verschiedenen Genen als Ursache für ARCI beschrieben, wobei Veränderungen im Gen für Transglutaminase 1 (TGM1) am häufigsten gefunden werden (Abb. 1). Der resultierende Mangel an Transglutaminase 1 führt zu einer defekten Quervernetzung der „cornified envelope proteins“. Bei den betroffenen Kindern findet sich eine charakteristische grobe, bräunliche Schuppung am Körper, einschließlich des Gesichts. Ein Schnellnachweis gelingt mittels des SDS(Sodiumdodecylsulfat)-Tests: Im Gegensatz zu Gesunden lassen sich die „cornified envelopes“ nicht oder nur stark zerstört nachweisen.<br /> Die seltene autosomal dominant vererbte epidermolytische Ichthyose beruht auf Mutationen in den Genen KRT1 und KRT10. Histologisch ist sie durch eine epidermolytische Hyperkeratose, elektronenmikroskopisch durch Sekretionsdefekte der „lamellar bodies“ und abnormale extrazelluläre Lipidmembranen gekennzeichnet. Eine der schwersten Formen ist die Harlequin-Ichthyose, die auf Mutationen im Lipidtransporter ABCA12 zurückzuführen ist. Die betroffenen Babys überleben meist nur wenige Tage nach der Geburt.</p> <h2>Atopische Dermatitis</h2> <p>„Im Rahmen der Patientenschulung werden AD-Patienten darüber aufgeklärt, dass in ihrer Haut die körpereigenen Fette vermindert sind und es daher wichtig ist, diese durch geeignete Externa wieder zuzuführen, um die Hautbarrierefunktion zu verbessern“, erläuterte Dr. Robert Gruber, Universitätsklinik für Dermatologie und Venerologie, Medizinische Universität Innsbruck, in seinen einleitenden Worten zu AD. Bei AD liegt eine reduzierte extrazelluläre Lipidmatrix vor, die auf eine unterschiedliche Expression von Genen, die in den kutanen Lipidmetabolismus involviert sind, zurückzuführen ist. Die damit einhergehende verminderte Ratio zwischen Lipiden und Proteinen korreliert mit der Barrierestörung. Die heutzutage anerkannte Erklärung zur Pathogenese der AD ist das „Outside-inside-back to outside“-Modell: Das Vorliegen eines primären Barrieredefekts führt zur Aktivierung des Immunsystems mit Entzündung der Haut, was wiederum die Barriereschädigung vorantreibt. Eine Unterbrechung dieses Teufelskreises kann einerseits durch physiologische Barrierelipid-Cremen, andererseits durch Immunsupprimierung mittels Kortison oder Calcineurininhibitoren erfolgen.</p> <p><img src="/custom/img/files/files_data_Zeitungen_2015_Jatros_Derma_1501_Weblinks_Seite17.jpg" alt="" width="918" height="374" /></p> <p>Die bei AD-Patienten bestehende Barrieredefizienz hat auch Auswirkungen auf die bakterielle Hautflora: In einer Analyse zum dermalen Mikrobiom von pädiatrischen AD-Patienten konnten Kong et al<sup>3</sup> feststellen, dass sich die bakterielle Kolonisation in beträchtlichem Ausmaß von jener der gesunden Kontrollen unterscheidet: Bei AD-Patienten war der Anteil von Staphylokokken-Spezies, insbesondere von S. aureus, während der Krankheitsschübe signifikant höher als zu Baseline und nach therapeutischer Intervention (Abb. 2). Darüber hinaus korreliert der Schweregrad bei AD mit der Menge an sezerniertem S.-aureus-α-Hämolysin. Interessanterweise konnten Studien bei AD eine verminderte Produktion von körpereigenen antimikrobiellen Peptiden (AMPs) zeigen, was Hautinfektionen begünstigt und die erhöhte Rate an bakteriellen Superinfektionen in diesem Patientenkollektiv erklärt.<sup>4</sup> Abschließend sollte noch erwähnt werden, dass sowohl bei der Ichthyosis vulgaris als auch bei der AD eine verminderte Expression von „tight junction proteins“ gefunden wurde, was wiederum mit Barrieredefekten bei diesen Hauterkrankungen assoziiert war.<sup>1, 4</sup></p></p>
<p class="article-quelle">Quelle:
Vortrag „Defekte der Hautbarriere:
atopische Dermatitis und Ichthyosen“ im Rahmen des Themenblocks „Hautbarrierefunktionsstörungen und Allergie(n)“ am 24. Oktober im Rahmen des
5. Kinder-Haut-Tages, 24.–25. Oktober 2014, Wien
</p>
<p class="article-footer">
<a class="literatur" data-toggle="collapse" href="#collapseLiteratur" aria-expanded="false" aria-controls="collapseLiteratur" >Literatur</a>
<div class="collapse" id="collapseLiteratur">
<p><strong>1</strong> Gruber R et al: Am J Pathol 2011; 178: 2252-2263 <br /><strong>2</strong> Irvine AD et al: N Engl J Med 2011; 365: 1315-1327 <br /><strong>3</strong> Kong HH et al: Genome Research 2012; 22: 850-859<br /> <strong>4</strong> Nakatsuji T, Gallo RL: J Invest Dermatol 2012; 132: 887-895</p>
</div>
</p>