Atopische Dermatitis im Fokus zielgerichteter Therapien
Bericht: Mag. Dr. Anita Schreiberhuber
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die atopische Dermatitis (AD) bildete ein zentrales Thema im Rahmen der ÖGDV-Jahrestagung 2021 und wurde sowohl von pathogenetischer als auch therapeutischer Seite näher beleuchtet. Als „hot topic“ wurde über die JAK(Januskinase)-Inhibitoren referiert, die bereits für definierte dermatologische Indikationen zugelassen sind und für weitere im Rahmen von klinischen Studien untersucht werden.
JAK-STAT-Pathway
Univ.-Prof. Dr. Franz Trautinger, Universitätsklinikum St. Pölten, hat als „hot topic“ über den Stellenwert der JAK-Inhibitoren referiert. JAK-Inhibitoren sind bereits seit circa einem Jahrzehnt in nicht dermatologischen Indikationen bei Erkrankungen der Hämatopoese zugelassen. Nun finden sie auch Einzug in die Dermatologie und kommen bei bestimmten Indikationen wie der AD oder der Psoriasisarthritis (PsA) bereits zur Anwendung.
Die Hauptfunktion der JAK wurde erstmals 1994 beschrieben: Es handelt sich dabei um eine Gruppe von Tyrosinkinasen, die unter anderem für die Signaltransduktion von Interferonen (IFN) in den Zellkern essenziell sind: IFN binden an spezifische Transmembranrezeptoren, die intrazellulär an JAK gekoppelt sind. Die JAK übermittelt dann via weitere Proteine das Signal an den Zellkern, wo die Transkription erfolgt.1 Aber nicht nur IFN, auch eine Reihe von Zytokinen spielt im JAK-STAT-Pathway eine Rolle. Wenn diese an ihre Rezeptoren binden, kommt es zur JAK- und in weiterer Folge zur STAT-Phosphorylierung. Die phosphorylierten STAT-Proteine migrieren in den Zellkern und veranlassen dort eine Gegenregulation.2
Therapeutische Nutzung der JAK-Inhibition
Gegenwärtig sind vier JAK-Proteine – JAK1–3 sowie TYK2 – identifiziert.3 „Wenn diese Proteine dysfunktional sind, resultieren Autoinflammation oder Immundefizienz oder eine Hyperproliferation der Hämatopoese“, erklärte Trautinger, um dann zur therapeutischen Nutzung der JAK-Inhibition überzuleiten. Das therapeutische Ziel besteht in der Modifikation der JAK-Proteine. In der Dermatologie sind aktuell Baricitinib und Upadacitinib für AD und Tofacitinib und Upadacitinib für PsA zugelassen. Diese und andere JAK-Inhibitoren werden bei weiteren dermatologischen Erkrankungen im Rahmen von klinischen Studien untersucht.
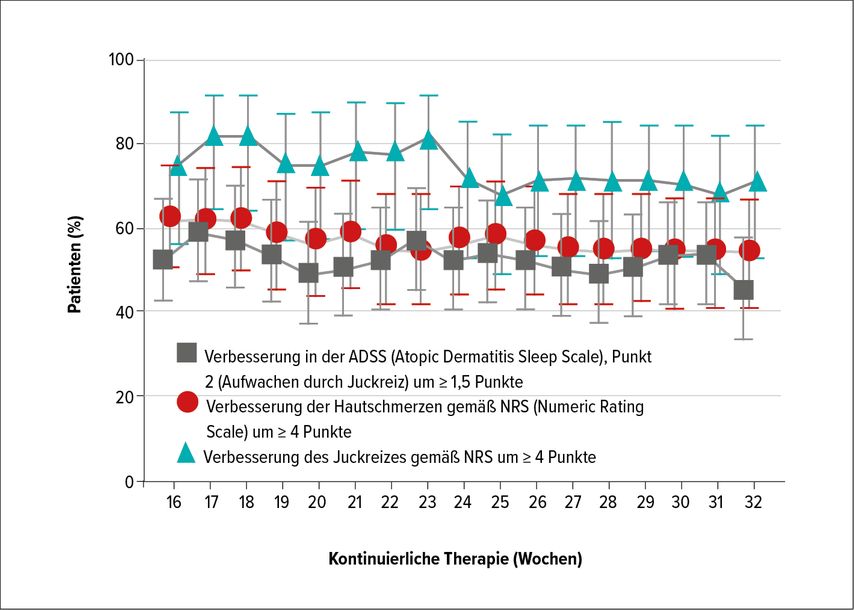
Für Baricitinib liegen bereits Langzeitdaten von 68 Wochen aus BREEZE-AD3, der offenen Verlängerungsstudie der beiden Zulassungsstudien BREEZE-AD1 und -AD2, vor. Daraus geht hervor, dass bei Patienten, die einen vIGA(validated Investigator Global Assessment for Atopic Dermatitis)-Score von 0 oder 1 bzw. einen EASI(Eczema Area and Severity Index)75 erzielt haben, die Werte über die Zeit hinweg aufrechterhalten werden konnten. Ebenso wurden die PRO („patient reported outcomes“) hinsichtlich der AD-assoziierten Symptome Nachtschlaf, Juckreiz und Hautschmerzen evaluiert. Auch hier spiegelt sich wider, dass die Wirksamkeit von Baricitinib für die Patienten in relevantem Ausmaß aufrechtblieb (Abb. 1).4 Als Klasseneffekte der JAK-Inhibitoren führte Trautinger u.a. Hypercholesterinämie, CK-Anstiege und geringgradige Änderungen im Blutbild an, die jedoch in den Zulassungsstudien keine klinische Intervention erforderten.
Abb. 1: PRO („patient-reported outcomes“) über 32 Wochen kontinuierlicher Therapie in BREEZE-AD3 (nach Silverberg JI, 2021)4
Atopische Dermatitis im Zeitalter der Präzisionsmedizin
Barriere und Mikrobiom
Univ.-Prof. Dr. Matthias Schmuth, Medizinische Universität (MU) Innsbruck, erörterte die Rolle der Haut als Barrierefunktion und ging der Frage nach, ob sich durch die Einführung von Biologika auch Vorteile für die Hautbarriere ergeben. „In Bezug darauf wäre es wünschenswert, dass die antientzündliche Therapie gleichzeitig die Barrierefunktion schützt.“
Für den Anti-IL-4/IL-13-Antikörper (AK) Dupilumab liegen bereits Daten vor, wonach die Substanz zu einer Verringerung der epidermalen Hyperplasie führt und die Expression von Filaggrin, ein für die Keratinisierung essenzielles Protein, erhöht.5 Hamilton et al. haben Transkriptomanalysen aus Hautbiopsien von Patienten unter Dupilumab durchgeführt und konnten dabei nachweisen, dass die IL-4/IL-13-Blockade zu einer Verbesserung der molekularen Hautsignatur von AD-Patienten führt. So wurde u.a. eine signifikante Reduktion der mRNA-Expression von Hyperplasie-assoziierten Genen festgestellt (p<0,05).5
Gemäß rezenten Studienergebnissen ist die primäre Prävention einer Barrieredysfunktion mit alleiniger Basistherapie nicht effektiv. „Ich denke, man sollte auch andere Mechanismen miteinbeziehen einschließlich der Rolle des Mikrobioms als therapeutische Einflussmöglichkeit auf die Barrierefunktion“, so Schmuth. Dabei gilt Filaggrin als großer Hoffnungsträger für therapeutische Interventionen: Paternoster et al. haben eine genomweite Metaanalyse von AD-Patienten durchgeführt und die Ergebnisse anhand eines Manhattan-Plots dargestellt. Dabei wurde u.a. auf Chromosom 1 und den damit assoziierten Genen ein deutliches Signal in Hinsicht auf die Barrierefunktion identifiziert.7 „Es ist allerdings relativ schwierig, Modelle für das Screening von Substanzen zu etablieren, und zudem ist derzeit noch unklar, welcher Mechanismus von Filaggrin moduliert werden soll“, merkte Schmuth dazu an.
Niehues et al. haben im Differenzierungsprozess der Keratinozyten die antimikrobielle Eigenschaften aufweisenden LCE(Late Cornified Envelope)-Proteine beschrieben.8 In der Folge wurde auch bestätigt, dass Bruchstücke der epidermalen Differenzierungsproteine eine eigene antimikrobielle Funktion – je nach Protein ein etwas anderes Spektrum – innehaben. Schmuth verglich die Bruchstücke mit „Landminen für die Mitglieder des Mikrobioms“ und erklärte: „Bei der Desquamation erfolgt ein Abbau dieser Differenzierungsproteine, sie erwerben ihre antimikrobielle Aktivität und stehen entweder in einer Balance mit dem Mikrobiom oder beeinträchtigen es.“ In Experimenten konnte gezeigt werden, dass eine Barrierestörung zu einer Erhöhung antimikrobieller Peptide führt und umgekehrt experimenteller Stress die antimikrobielle Barriere beeinträchtigt, sodass insgesamt als erwiesen gilt, dass eine enge Verbindung zwischen Hautbarriere und Mikrobiom besteht und eine therapeutische Interaktion möglich ist.10,11
Disease Profiling und Targeting
Die AD ist eine klinisch heterogene Erkrankung und lässt sich nach unterschiedlichen Aspekten unterteilen. Eine der Unterteilungen ist die extrinsische vs. die intrinsische Form. Die extrinsische AD zeichnet sich durch erhöhte Serum-IgE-Spiegel, atopische Veranlagung (Komorbiditäten) und häufige Mutationen von Filaggrin aus und geht mit einer Inzidenz von 80% einher. Demgegenüber weisen die oft weiblichen Patienten mit intrinsischer AD häufig normale Serum-IgE-Spiegel und eine normale Barrierefunktion auf und die Erkrankung tritt teilweise als Late-Onset-AD auf.12 Die unterschiedlichen AD-Phäno- und Endotypen sind durch eine Prädominanz bestimmter Immunzellen charakterisiert.13
Wie können wir nun diese Erkenntnisse in die Therapie einfließen lassen? „Abgesehen von der topischen Basistherapie, die darauf abzielt, die Barrierefunktion zu verbessern, gibt es verschiedene Zielstrukturen als Ansatzpunkt“, erläuterte OÄ Dr.Christine Bangert, MU Wien. Ein wesentliches Ziel bei der AD ist es, den Juckreiz-Kratz-Zirkel zu unterbrechen. Nemolizumab, ein subkutan zu applizierender Antikörper, setzt am IL-31-Rezeptor in den sensorischen Nervenendigungen an und führte in einer Phase-III-Studie vs. Placebo zu einer signifikanten Reduktion des Juckreizes, der als primärer Endpunkt definiert war. Diese betrug in einer Phase-III-Studie bei AD gemäß der VAS (Visual Analog Scale) in Woche 4 gegenüber Baseline 42,8% (p<0,001).14
„Die Hauptangriffsebene ist die erworbene Immunität, wobei die Hauptzielstruktur die T-Zellen sind. Die zielgerichteten Therapien haben den Fokus darauf gerichtet, die Einwanderung der T-Zellen durch Blockade von CCR(Chemokine Receptor)-4 oder die Zielzytokine der T-Zellen zu blockieren. Viele für Psoriasis zugelassene Antikörper haben bei AD keine Wirksamkeit gezeigt. So bleiben nur noch die monoklonalen AK Dupilumab und Tralokinumab, die Th2-assoziierte Zytokine blockieren, sowie die JAK-Inhibitoren Baricitinib und Upadacitinib, die bei der Signaltransduktion der Th2-assoziierten Zytokine eine große Rolle spielen“, berichtete Bangert. Alle vier Substanzen sind für erwachsene AD-Patienten indiziert; Dupilumab ist als bisher einzige Substanz bereits für Kinder ab ≥ 6Jahren, Upadacitinib für Jugendliche ab ≥12 Jahren zugelassen.15
„Wie müssen im Umgang mit diesen neuen Substanzen noch viel lernen – nicht alle Patienten sprechen darauf an und wir beobachten auch Schübe und Wirkverluste unter Therapie. Wir können über die Neuerungen der vergangenen Jahre froh sein und das Ziel einer individualisierten Therapie ist ein Stück näher gerückt, Biomarker für die Stratifizierung wären aber auf jeden Fall hilfreich“, so das Fazit und der Ausblick von Bangert.
Quelle:
Jahrestagung der ÖGDV, 25.–27. November 2021, virtuell
Literatur:
1 Darnell JE et al.: Science 1994; 264: 1415-2 2 Solimani F et al.: Front Immunol 2019; 10: 2847 3 OMIM® Catalogue: https://www.omim.org/ 4 Silverberg JI et al.: JAMA Dermatology 2021; 157: 691-99 5 Guttman-Yassky E et al.: J Allergy Clin Immunol 2019; 143: 155-72 6 Hamilton JD et al.: J Allergy Vlin Immunol 2014; 134: 1293-300 7 Paternoster L et al.: Nat Genet 2011; 44: 187-92 8 Niehues H et al.: J Invest Dermatol 2017; 137: 2380-88 9 Latendorf T et al.: Sci Rep 2019; 9(1): 3331 10 Ahrens K et al.: J Invest Dermatol 2011; 131: 443-52 11 Aberg KM et al.: J Clin Invest 2007; 117: 3339-49 12 Tokura Y: J Dermatol Science 2010; 58: 1-7 13 Czarnowicki T et al.: J Allergy Clin Immunol 2019; 143: 2095-07 14 Kabashima K et al.: N Engl J Med 2020; 383: 141-150 15 https://www.ema.europa.eu/en
Das könnte Sie auch interessieren:
Exzision nur bei Melanomverdacht – nicht prophylaktisch?
Wenn sich dysplastische Nävi nicht einfach klassifizieren lassen, kann dies nicht nur bei Betroffenen Besorgnis auslösen, sondern ebenso bei Ärztinnen und Ärzten. In einer Pro-Contra- ...
Update atopische Dermatitis
Die Forschung zur atopischen Dermatitis läuft weiterhin auf Hochtouren. So wurde im vergangenen Jahr wieder eine Vielzahl an Studien zu verschiedenen Aspekten der chronisch-entzündlichen ...
Skin of Color im Praxisalltag
Viele klassische Blickdiagnosen in der Dermatologie präsentieren sich bei unterschiedlichen Hautfarben mit teils variablem Erscheinungsbild, eine Herausforderung für den Kliniker. Die ...