Abklärung und Therapie bei arteriolopathischen Ulzera
Autoren:
Dr. Julia Deinsberger
AP.-Prof. PD Dr. Dr. Benedikt Weber
Universitätsklinik für Dermatologie und Venerologie, AKH Wien
Korrespondierende Autorin:
Dr. Julia Deinsberger
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Ulcus hypertonicum Martorell und Kalziphylaxie: Bei arteriolopathischen Ulzera sind die Diagnostik und Behandlung oft herausfordernd. Wir berichten, wie sich die beiden Entitäten klinisch bzw. histologisch darstellen und welche therapeutischen Strategien sie jeweils erfordern.
Keypoints
-
Das chronische Ulcus cruris zeigt eine klare Assoziation mit fortgeschrittenem Alter.
-
Arteriolopathische Ulzera entstehen durch den Verschluss der die Haut versorgenden Arteriolen.
-
Das Ulcus hypertonicum Martorell ist charakteristisch am dorsolateralen Aspekt des Unterschenkels oder über der Achillessehne (oft beidseitig) lokalisiert. Therapeutisch stellt die chirurgische Nekrosektomie den Goldstandard dar.
-
Ulzerationen bei Kalziphylaxie präsentieren sich oft sternförmig mit Satellitenläsionen in der Wundumgebung. Statt chirurgischer Eingriffe stehen hier Infusionen mit Natrium-Thiosulfat im Vordergrund.
Hintergrund
Das chronische Ulcus cruris zählt zu den weltweit häufigsten Gesundheitsproblemen.1 Es besteht eine klare Assoziation mit fortgeschrittenem Alter.2,3 Daher stellen in einer alternden Gesellschaft chronische Beinulzerationen ein zunehmend relevantes Gesundheitsproblem dar, welches mit einer substanziellen Morbidität und Mortalität für die betroffenen Patienten und einer zunehmenden finanziellen Belastung für das öffentliche Gesundheitssystem einhergeht.1,2
Häufigkeit und Formen
Die Prävalenz des chronischen Ulcus cruris liegt in der Gesamtpopulation schätzungsweise zwischen 0,18 und 2% und in der Gruppe der über 65-Jährigen bei bis zu 5%.4 Etwa 75% aller Ulcera crurum liegt eine vaskuläre Pathogenese zugrunde, wobei hier die chronisch-venöse Insuffizienz (CVI) mit 45–60% die häufigste Ursache darstellt, gefolgt von der peripheren arteriellen Verschlusskrankheit (pAVK).5–7
Eine kleinere, jedoch durch die signifkante Morbidität der betroffenen Patienten wichtige Gruppe, stellen arteriolopathische Ulzera dar, die durch den Verschluss der die Haut versorgenden Arteriolen charakterisiert sind. Hierbei lassen sich im Allgemeinen zwei Formen unterscheiden: die urämische kalzifizierende Arteriolopathie (Kalziphylaxie) und die nicht urämische kalzifizierende Arteriolopathie. Zur letzteren Form werden neben dem Ulcus hypertonicum Martorell auch die selten beschriebenen nicht urämischen Formen der kalzifizierenden Arteriolopathie an den proximalen Extremitäten bzw. am Stammbereich gezählt. Eine Kalziphylaxie mit normaler Funktion der Niere und Nebenschilddrüse wurde in der Literatur auch als „eutrophication“ bezeichnet.8
Die Angaben zur Häufigkeit divergieren, wobei einige Autoren davon ausgehen, dass arteriolopathische Ulzera unterdiagnostiziert sind. Die Häufigkeit dieser Entität wird auf etwa 1% aller Ulcera cruri und sogar auf bis zu 15% der in spezialisierten Wundzentren behandelten Ulzerationen geschätzt.9,10 Valide epidemiologische Daten liegen hierzu allerdings bislang nicht vor. Die Differenzialdiagnose der beiden Entitäten kann in Einzelfällen eine Herausforderung darstellen, da die klinische Präsentation sowie auch das histologische Bild einige Parallelen aufweisen.8
Pathogenese und -physiologie
Das Ulcus hypertonicum Martorell wurde erstmals von Fernando Martorell im Jahr 1945 beschrieben.11,12 Es besteht eine klare Assoziation mit langfristig bestehender arterieller Hypertonie.9,10,13 Es wird vermutet, dass die erhöhte intraarterioläre Scherspannung zu einer Mediahypertrophie und einem langsam progressiven fibrohyalinotischen Umbau der arteriolären Gefäßwand führt, was in einer progressiven Stenose des Lumens und einer Degeneration der glatten Muskelzellen sowie einer Verkalkung der Gefäßwand resultiert.10,14,15
Die Kalziphylaxie wird in eine urämische und eine nicht urämische Form unterteilt. Die kalzifizierende urämische Arteriolopathie tritt in Assoziation mit einer terminalen Niereninsuffizienz auf und betrifft bis zu 4% dieser Patientengruppe. Die nicht urämische Form betrifft Patienten in früheren Stadien der chronischen Niereninsuffizienz oder, sehr selten, Patienten mit normaler Nierenfunktion.16–21 Die geläufigste Hypothese besagt, dass ein sekundärer Hyperparathyreoidismus das Kalzium-Phosphat-Produkt erhöht und somit extraskelettale Kalzifikationen induziert, welche vor allem in Blutgefäßwänden und im Fettgewebe auftreten.14,17, 22 In weiterer Folge kann sich eine septale Pannikulitis sowie eine Nekrose des subkutanen Fettgewebes entwickeln.23,24 Diese Theorie wurde allerdings von einigen Autoren infrage gestellt, da Kalziphylaxie auch bei Patienten ohne Hyperparathyreoidismus und mit normaler Nierenfunktion festgestellt wurde.25,26 Eine weitere Theorie zur Pathogenese schreibt Fetuin A, einem potenten Hemmstoff ektoper Kalzifikation, eine tragende Rolle zu.27 Stichhaltige Daten hierzu fehlen allerdings bisher.
Den beiden Erkrankungen liegt vermutlich eine gemeinsame pathopyhsiologische Endstrecke zugrunde. Die progrediente stenosierende Sklerose der Arteriolen führt zu einer gesteigerten mikrovaskulären Resistenz und einer verminderten Elastizität der arteriolären Gefäßwand, was einen reduzierten kutanen Perfusionsdruck zur Folge hat.28 Die resultierenden kutanen Nekrosen bergen ein signifikantes Risiko für eine Superinfektion, was potenziell fatale septische Komplikationen nach sich ziehen kann.9,10,13,16,29–31 Der Pathomechanismus beider Erkrankungen ist jedoch nicht vollständig geklärt.
Klinisches Bild
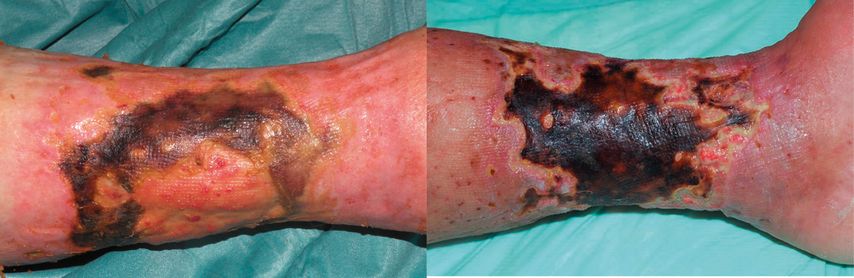
Sowohl Kalziphylaxie als auch das Ulcus hypertonicum Martorell sind durch eine ausgeprägte Schmerzsymptomatik und kutane Nekrosen gekennzeichnet. Letztere sind das Ergebnis der Arteriolosklerose und der daraus resultierenden Stenose und verminderten Durchblutung.9,10,13,19,29,30,32 Zu Beginn zeigt sich jeweils eine schmerzhafte livide Hautveränderung, charakterisiert durch die bizarren, erythematös-lividen Strukturen einer Livedo racemosa, die sich rasch zu tiefen Ulzerationen mit einer nekrotischen Basis und einem lividen Randsaum entwickelt.8
Abb. 1:Klinisches Bild: (links) 73-jährige Patientin mit Ulcus hypertonicum Martorell; (rechts) 67-jährige Patientin mit Kalziphylaxie
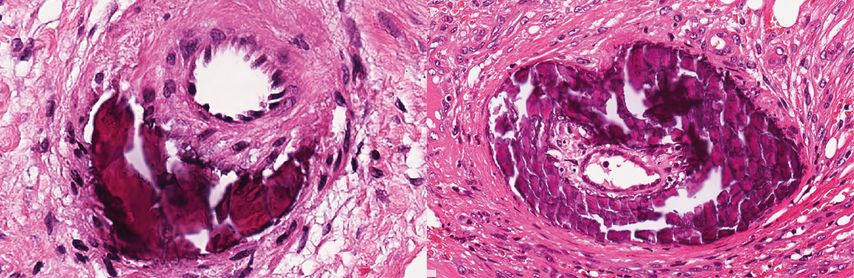
Abb. 2: Histopathologie: Hämatoxylin- und Eosin-gefärbte Gewebeschnitte von Hautbiopsien; (links) Arteriole bei Ulcus hypertonicum Martorell, (rechts) Arteriole bei Kalziphylaxie
Ulcus hypertonicum Martorell
Bezüglich des Ulcus hypertonicum Martorell inkludieren klinische Kriterien neben einer langfristig bestehenden arteriellen Hypertonie die Abwesenheit von relevanten makrovaskulären Erkrankungen (CVI, pAVK) sowie eine zum bestehenden Ulkus disproportionale Schmerzsympomatik.11,12,33 Das Ulkus zeigt meist eine charakteristische Lokalisation am dorsolateralen Aspekt des Unterschenkels oder über der Achillessehne und tritt in etwa 50% der Fälle beidseitig auf.10,34 Ebenso oft besteht ein Diabetes mellitus Typ 2 als Komorbidität.10,35 Obwohl vormals eine weibliche Prädominanz beschrieben wurde, zeigen rezentere Studien, dass Männer und Frauen gleichermaßen betroffen sind.35
Kalziphylaxie
Sie ist, wie bereits beschrieben, zumeist mit einer fortgeschrittenen Niereninsuffizienz assoziiert. Zu den Risikofaktoren für das Auftreten einer Kalziphylaxie zählen das weibliche Geschlecht, Adipositas, Diabetes mellitus und eine seit ≥2 Jahren bestehende dialysepflichtige Niereninsuffizienz.20,36,37 Die Ulzerationen präsentieren sich oft sternförmig und sind häufig durch Satellitenläsionen in der Wundumgebung gekennzeichnet.38–40 Patienten haben häufig multiple Ulzerationen, die an unterschiedlichen Körperregionen beidseitig auftreten.20 Meist sind die unteren Extremitäten, vor allem die Unterschenkel, betroffen. Häufig sind auch Läsionen am Stamm, insbesondere am Abdomen, zu finden.41 Grundsätzlich treten Ulzera bevorzugt an Lokalisationen auf, an denen vermehrt subkutanes Fettgewebe zu finden ist.17 Die Einnahme von Vitamin-K-Inhibitoren ist mit einer höheren Rate ektoper Kalzifikation assoziiert und führt bei beiden Erkrankungen zur Aggravation der Wundsituation.8,42,43
Histologie
Die definitive Diagnose Ulcus hypertonicum Martorell wird mittels Biopsie gestellt. Diese sollte vom Ulkusrand entnommen werden und sowohl gesunde Haut als auch Anteile des Ulkus und des Wundgrunds umfassen. Dazu eignet sich eine Spindelbiopsie (Länge:Breite >3:1), die sich bis in das tiefe Subkutangewebe bzw. bis zur Muskelfaszie erstreckt. Das entnommene Gewebe wird anschließend der Länge nach eingebettet.5,8,10 Bezüglich der Kalziphylaxie ist die bioptische Gewebeentnahme aufgrund möglicher Aggravierung der Wundsituation und nachfolgender Infektionen umstritten und im Falle von akral gelegenen Läsionen kontraindiziert.20,44
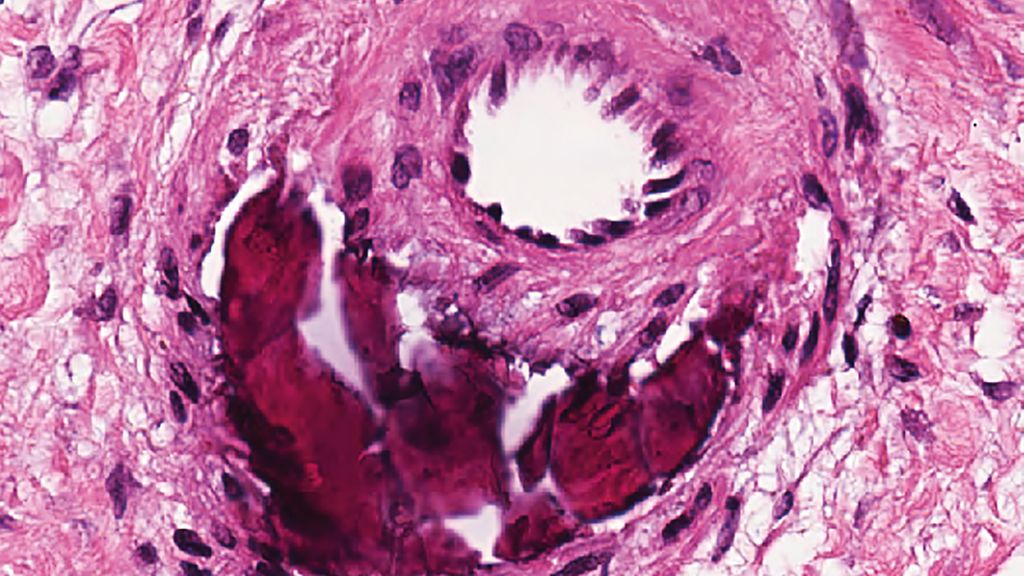
Das histologische Bild beider Erkrankungen ist durch eine kalzifizierende Arteriolopathie mit einer Verkalkung der kleinen und mittelgroßen Arteriolen der tiefen Dermis und oberen Hypodermis charakterisiert.8,14,45 Zudem kann in den meisten Fällen eine extravaskuläre Kalzifikation der tiefen Dermis und des subkutanen Bindegewebes beobachtet werden. Hierfür sind oft spezifische Färbungen zur Darstellung von mineralisiertem Gewebe, etwa Von Kossa oder Alizarinrot S, erforderlich.45 Darüber hinaus zeigen sich perivaskuläre Infiltrate neutrophiler Granulozyten als Zeichen der ablaufenden Entzündungsreaktion.4,8,9
Beim Ulcus hypertonicum Martorell sowie in einigen Fällen von Kalziphylaxie zeigt sich zudem eine Hyalinose der Media der arteriolären Gefäßwand.35 Diese stellt sich als subendotheliale Akkumulation von amorphen, eosinophilen, glasig erscheinenden Ablagerungen dar.35,46 Die Hyalinose wird häufig von einem Verlust glatter Muskelzellen begleitet, wobei die Endothelzellschicht meist intakt bleibt.35,47 Bisher gibt es nur eingeschränkte Daten zur molekularen Zusammensetzung der hyalinen Ablagerungen. Rezente Untersuchungen mittels Raman-Spektroskopie legen nahe, dass es sich primär um Kollagen und Phospholipide, in erster Linie Phosphatidylcholin, handelt.47
Therapie
Indiziert ist eine multimodale therapeutische Strategie. Anfangs steht eine Linderung der Schmerzsymptomatik im Vordergrund. Auf ein optimales Wundmanagement sollte geachtet werden, um potenzielle (Super-)Infektionen zu vermeiden.38 Im Falle einer Therapie mit Vitamin-K-Antagonisten sollte ehestmöglich ein Therapiewechsel angestrebt werden.41
Ulcus hypertonicum Martorell
Hierbei stellen die chirurgische Nekrosektomie, gegebenenfalls mit zwischenzeitlicher Anlage eines VAC-Systems, und die anschließende Spalthautdeckung den Goldstandard dar. Dabei zeigt sich eine Remissionsrate von bis zu 90%.10 Zudem sollte eine Optimierung der antihypertensiven Therapie erfolgen.48
Kalziphylaxie
Ein chirurgisches Vorgehen im Sinne eines Débridements ist bei der Kalziphylaxie im Grunde kontraindiziert, kann aber in Einzelfällen erfolgreich sein und zu einem besseren Outcome beitragen.41,49 Therapeutisch stehen hier Infusionen mit Natrium-Thiosulfat im Vordergrund, wodurch der Lokalbefund signifikant verbessert werden kann.41,50 Natrium-Thiosulfat fungiert als Antidot zu Kalzium, indem es lösliche Kalzium-Thiosulfat-Komplexe bildet und somit das Kalziumlevel im Blut reduziert.51–53 Aufgrund der meist fortgeschrittenen chronischen Grunderkrankung haben Patienten mit Kalziphylaxie tendenziell ein schlechtes Outcome mit einer hohen Letalität von etwa 40% innerhalb eines Jahres nach Auftreten der ersten Läsionen.41
Literatur:
1 Duschek N, Trautinger F: Z Gerontol Geriatr 2019; 52(4): 377-90 2 Richmond, NA et al.: Dermatol Ther 2013; 26(3): 187-96 3 Hellström A et al.: BMC Geriatr 2016; 16: 25 4 Spentzouris G, Labropoulos N: Semin Intervent Radiol 2009; 26(4): 286-95 5 Alavi A et al.: Adv Skin Wound Care 2012; 25(12): 563-72 6 Mekkes JR et al.: Br J Dermatol 2003; 148(3): 388-401 7 Martinengo L et al.: Ann Epidemiol 2019; 29: 8-15 8 Hafner J: Dermatology 2016; 232(5): 523-33 9 Dagregorio G, Guillet G: J Eur Acad Dermatol Venereol 2006; 20(2): 166-9 10 Hafner J et al.: Arch Dermatol 2010; 146(9): 961-8 11 Martorell F: Med Klin 1957; 52(45): 1945-6 12 Martorell F: J Cardiovasc Surg (Torino) 1978; 19(6): 599-600 13 Henderson CA et al.: Clin Exp Dermatol 1995; 20(2): 107-14 14 Colboc H et al.: JAMA Dermatol 2019; 155(7): 789-96 15 Hines EA et al.: Proc Staff Meet Mayo Clin 1946; 21(18): 337-46 16 Olaoye OA, Koratala A: Oxf Med Case Reports 2017; 10: omx055 17 Weenig RH et al.: J Am Acad Dermatol 2007; 56(4): 569-79 18 Yerram P, Chaudhary K: Ochsner J 2014; 14(3): 380-5 19 Dauden E, Onate MJ: Dermatol Clin 2008; 26(4): 557-68, ix 20 Nigwekar SU, Thadhani R et al.: N Engl J Med 2018; 378(18): 1704-14 21 Angelis M et al.: Surgery 1997; 122(6): 1083-90 22 Hafner J et al.: J Am Acad Dermatol 1995; 33(6): 954-62 23 Rezaie W et al.: Indian J Nephrol 2009; 19(3): 115-8 24 Nigwekar SU et al.: Am J Kidney Dis 2015; 66(1): 133-46 25 Nigwekar SU et al.: Clin J Am Soc Nephrol 2008; 3(4): 1139-43 26 Fuchs F et al.: J Dtsch Dermatol Ges 2020; 18(12): 1498-1500 27 Jahnen-Dechent W et al.: Circulation Research 2011; 108(12): 1494-1509 28 Duncan HJ, Faris IB: J Vasc Surg 1985; 2(4): 581-4 29 Lima Pinto AP et al.: Case Rep Dermatol 2015; 7(2): 199-206 30 Giot JP et al.: Am J Pathol 2013; 182(3): 806-18 31 Riemer CA et al.: Br J Dermatol 2017; 177(6): 1510-18 32 Ghosh T et al.: Int J Dermatol 2017; 56(8): 856-61 33 Vuerstaek JD et al.: J Eur Acad Dermatol Venereol 2010; 24(8): 867-74 34 Weber B et al.: J Eur Acad Dermatol Venereol 2021; 35(1): e40-2 35 Deinsberger J et al.: Acta Derm Venereol 2021; 101(5): adv00449 36 Mazhar AR et al.: Kidney Int 2001; 60(1): 324-32 37 Hayden MR et al.: Cardiovasc diabetol 2005; 4: 4-4 38 Jeong HS, Dominguez AR: Am J Med Sci 2016; 351(2): 217-27 39 Meyer V et al.: J Dtsch Dermatol Ges 2011: 9(12): 1035-51 40 Schnier BR et al.: Am J Cardiol 1966; 17(4): 560-5 41 Gaisne R et al.: BMC Nephrology 2020; 21(1): 63 42 Shanahan CM et al.: Circ Res 2011; 109(6): 697-711 43 Nigwekar SU et al.: J Am Soc Nephrol 2017; 28(6): 1717-22 44 Baby D et al.: J Family Med Prim Care 2019; 8(9): 2763-7 45 Deinsberger J et al.: Eur J Dermatol 2021; 31(6): 705-11 46 Gamble CN: Am J Pathol 1986; 122(3): 410-20 47 Deinsberger J et al.: J Eur Acad Dermatol Venereol 2021; 35(11): 2308-16 48 Meyer V et al.: J Dtsch Dermatol Ges 2011; 9(12): 1035-52 49 Sowers KM, Hayden MR: Oxid Med Cell Longev 2010; 3(2): 109-21 50 Nigwekar SU et al.: Clin J Am Soc Nephrol 2013: 8(7): 1162-70 51 Hayden MR et al.: Int Urol Nephrol 2008; 40(2): 443-51 52 Pasch A et al.: Kidney Int 2008; 74(11): 1444-53 53 Raymond CB, Wazny LZ: Am J Health Syst Pharm 2008; 65(15): 1419-29
Das könnte Sie auch interessieren:
Top 5 News zu Pruritus 2025
Prof. Dr. med. Simon Müller, Basel, präsentierte in seinem Vortrag im Rahmen der Veranstaltung «Haus der Dermatologie 2025», die am 4. Dezember 2025 in Luzern stattfand, seine ...
Aktuelles zu Hidradenitis suppurativa, Akne und Rosazea
Chronisch-entzündliche Hauterkrankungen wie Hidradenitis suppurativa (HS), Akne und Rosazea gehen häufig mit einer erheb-lichen Einschränkung der Lebensqualität einher. Fortschritte in ...
Digitalisierung in der Dermatopathologie
PD Dr. med. Helmut Beltraminelli, Ente Ospedaliero Cantonale Locarno, beleuchtete im Rahmen der Veranstaltung «Haus der Dermatologie 2025», die am 4. Dezember 2025 in Luzern stattfand, ...