AML am hämatologischen Zentrum des Universitätsklinikums St. Pölten
Autor:innen:
Dr. Katharina Halm
Assistenzärztin
1. Medizinische Abteilung
Universitätsklinikum St. Pölten
E-Mail: katharina.halm@stpoelten.lknoe.at
Dr. Gerhard Krajnik
Oberarzt
1. Medizinische Abteilung
Universitätsklinikum St. Pölten
Mit 376 Neuerkrankungen in Österreich im Jahr 20201 gilt die akute myeloische Leukämie als seltene Erkrankung, die vermehrt im Alter auftritt und unbehandelt tödlich endet. Immer häufiger werden Patient:innen spezialisierten Zentren mit hoher Patient:innenfrequenz zugewiesen, um einen optimalen Therapieablauf zu gewährleisten. Imfolgenden Artikel berichten wir über die Vergangenheit und Gegenwart des niederösterreichischen Leukämiezentrums am Universitätsklinikum St.Pölten und geben einen Einblick in die aktuellen Entwicklungen rund um Diagnose und Therapie der akuten myeloischen Leukämie.
Keypoints
-
Seit 2014 wurden im Universitätsklinikum St. Pölten bei jährlich steigenden Patient:innenzahlen insgesamt 220 Patient:innen mit akuter myeloischer Leukämie behandelt.
-
Die Behandlung der AML wird durch die Identifizierung neuer Targets und Substanzen immer effektiver und vielfältiger, jedoch auch komplexer.
-
Zukünftig soll mittels Etablierung eines niederösterreichweiten Hämatologie-Boards eine optimale Versorgung von AML-Patient:innen, auch außerhalb von spezialisierten Zentren, gewährleistet werden.
Die akute myeloische Leukämie imUniversitätsklinikum St.Pölten
Anstieg der Patient:innenzahl
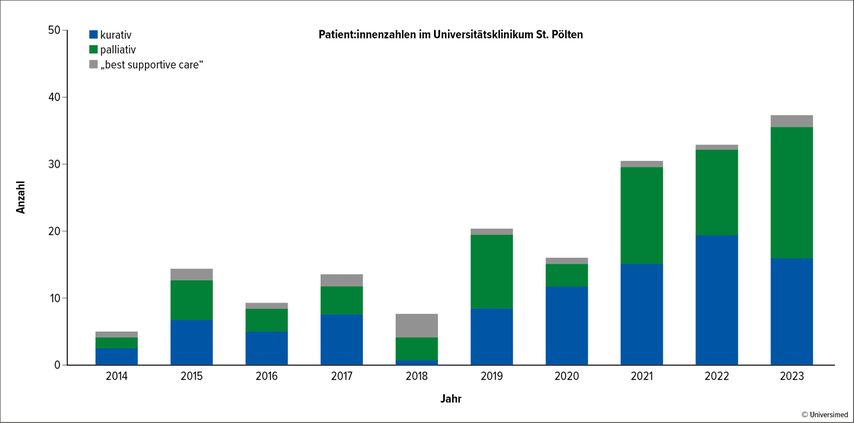
Seit der erstmals im Universitätsklinikum (UK) St.Pölten durchgeführten intensiven Chemotherapie im Jahr 2014 kam es zu einem deutlichen Anstieg der Anzahl an behandelten Patient:innen mit akuter myeloischer Leukämie (AML; Abb. 1). Dies ist in erster Linie einerseits der global steigenden Inzidenz der Erkrankung2 und andererseits der zunehmenden Anerkennung der hämatologischen Abteilung als Zentrum für die Behandlung hämatologischer Erkrankungen zuzuschreiben.
Abb. 1:Patient:innen mit neu diagnostizierter akuter myeloischer Leukämie, die im Universitätsklinikum St. Pölten behandelt wurden, unterteilt nach initialer Therapieintention
Insgesamt wurden bis Ende 2023 220 Patient:innen mit neu diagnostizierter AML im UK St. Pölten behandelt. Dabei erhielten 51% der Patient:innen eine intensive Chemotherapie (3+7, 3+7+Midostaurin, 3+7+Gemtuzumab Ozogamicin). Nichtintensive Therapien mit Azacitidin in Kombination mit Venetoclax oder Ivosidenib wurden 42% der Patient:innen verabreicht. Bei 7% der Patient:innen erfolgte die Behandlung ausschließlich nach dem Prinzip „best supportive care“.
Die 5-Jahres-Überlebensrate beträgt dabei in unserem Patient:innenpool, unabhängig von Alter und Risikogruppe (nach Klassifikation des European LeukemiaNet, ELN), 36,8% bei primär intensiver Therapie und 13,7% bei nichtintensiver Therapie. Die häufigste Todesursache ist dabei in beiden Gruppen eine Progression der Grunderkrankung gefolgt von schwerwiegenden Infektionen.
Etwas mehr als die Hälfte unserer Patient:innen wurde in initial kurativer Therapieintention einer intensiven Chemotherapie zugeführt. Nach erfolgreich durchgeführter Induktionstherapie konnte im Beobachtungszeitraum bei 60% der Patient:innen eine komplette Remission erzielt werden, weitere 6% wiesen in der ersten Remissionsdiagnostik eine für das weitere Therapieprozedere nicht signifikante Resterkrankung auf. Von den übrigen 34%, die initial eine relevante Blastzellpersistenz im Knochenmark aufwiesen, erreichte wiederum mehr als die Hälfte nach Reinduktionstherapie eine komplette Remission. Aus einem guten initialen Therapieansprechen resultierte auch in unserer Patient:innenpopulation ein statistisch signifikanter Vorteil im Gesamtüberleben.
Stammzelltransplantation
Im Falle einer indizierten allogenen Stammzelltransplantation, die Patient:innen mit intermediärem und ungünstigem Risikoprofil nach den ELN-Richtlinien 2022 empfohlen wird, erfolgte eine Zuweisung an die Knochenmarkstransplantationsambulanz des AKH Wien. Bis Juli 2023 konnten 41 der im UK St. Pölten behandelten Patient:innen einer allogenen Stammzelltransplantation zugeführt werden. In diesem Falle fanden im Anschluss auch die weitere Betreuung und Nachsorge im AKH Wien statt.
Nichtintensive Therapie
In unserem Patient:innenpool hatten 85% der Patient:innen, die aufgrund fortgeschrittenen Alters, relevanter Komorbiditäten oder bei unzureichendem Performance-Status keine Hochdosis-Therapie erhalten konnten, noch immer die Option einer nichtintensiven Therapie.
Im April 2020 wurde im UK St. Pölten der erste reguläre Patient außerhalb einer klinischen Studie mit der Kombinationstherapie aus Azacitidin und Venetoclax behandelt. Eine Mono-Therapie mit Azacitidin in der genannten Indikation wird mittlerweile nur noch in Ausnahmefällen durchgeführt. Seit Kurzem werden auch erste Patient:innen mit der seit Mai 2023 zugelassenen Kombination aus Azacitidin und Ivosidenib behandelt.
Während die Behandlung mit intensiver Chemotherapie zur Gänze im Universitätsklinikum erfolgt, werden insbesondere nichtintensive Therapien je nach Möglichkeit einer ortsnahen Anbindung und nicht zuletzt abhängig vom Patient:innenwunsch nach den ersten Zyklen in heimatnahen Spitälern mit onkologischer Abteilung fortgesetzt.
Erweiterung der Kapazitäten
Das zunehmende Patient:innenaufkommen, in kurativer sowie palliativer Intention, führt zu einem vermehrten Bedarf sowohl an räumlichen als auch personellen Kapazitäten. Der erste Schritt in diese Richtung, nämlich der Umzug der Abteilung in ein neu errichtetes Gebäude mit größeren Ambulanzräumlichkeiten und höherer Bettenkapazität, wird bereits im Frühjahr 2024 gesetzt.
Des Weiteren wird derzeit an der Etablierung eines eigenen niederösterreichweiten Hämatologie-Boards gearbeitet, das die bestmögliche Therapie für alle niederösterreichischen Patient:innen auch abseits eines hämatologischen Zentrums gewährleisten soll.
Aktuelle Entwicklungen in Diagnostik und Therapie der AML
Molekulargenetische Untersuchungen
Die akute myeloische Leukämie ist eine sehr heterogene Erkrankung. Zum Zeitpunkt der Diagnosestellung werden zytogenetische und molekulare Veränderungen untersucht, anhand deren Vorkommen schließlich eine Einteilung in unterschiedliche Prognosegruppen möglich wird. Am häufigsten findet man Mutationen in FLT3, NPM1 und DNMT3A.
Im Rahmen der AML-Therapie kann manchmal nach anfänglichem Therapieansprechen im nachfolgenden Rezidiv eine Veränderung der molekularen Eigenschaften der leukämischen Zellen auftreten (klonale Evolution). Umso wichtiger ist es, regelmäßig molekulargenetische Untersuchungen durchzuführen, um veränderte Zellen frühzeitig zu charakterisieren und eine gegebenenfalls notwendige Therapieanpassung durchführen zu können.
Veränderungen der AML-Klassifikation
Im Jahr 2022 kam es zu relevanten Veränderungen in der Klassifikation der AML, mit deren Hilfe die Erkrankung anhand zytomorphologischer, zytogenetischer und molekulargenetischer Eigenschaften unterteilt wird: Neben der adaptierten Klassifikation der World Health Organization (WHO) wurde im gleichen Jahr auch die International Consensus Classification (ICC) zur AML publiziert. Besonders die molekularen Parameter fließen nun noch dominanter in die Klassifikationen ein.
Auch die ELN-Richtlinien haben im Jahr 2022 neben der aktualisierten genetischen Risikostratifizierung außerdem Adaptierungen der Ansprechkriterien und Behandlungsempfehlungen präsentiert.
Induktionstherapie
Wenn wir von der gängigen Induktionstherapie im kurativen Ansatz sprechen, ist der wichtigste Bestandteil der Behandlung nach wie vor eine Kombination aus Daunorubicin und Cytarabin (3+7), die erstmals im Jahr 1973 von der amerikanischen Gruppe um James Holland publiziert wurde und bis heute Bestand hat.
Mittlerweile stehen durch die Entdeckung neuer Targets jedoch neue zielgerichtete Therapieoptionen wie zum Beispiel bcl2- oder Tyrosinkinase-Hemmer zur Verfügung, die in Kombination mit der zuvor genannten Standardtherapie verabreicht werden können. Als Beispiel profitieren Patient:innen mit einer FLT3-Mutation vom Tyrosinkinase-Hemmer Midostaurin in Kombination mit der Induktions- bzw. Konsolidierungstherapie und später auch in der Erhaltungsphase.
Andere FLT3-Inhibitoren der zweiten und dritten Generation (Quizartinib, Gilteritinib, Crenolanib) befinden sich derzeit noch in der Phase der klinischen Erprobung und könnten in Kombination mit der intensiven Chemotherapie zu einem noch längeren Gesamtüberleben beitragen. Bei Patient:innen mit CD33-Expression kann durch eine Kombination von 3+7 mit dem Antikörper-Wirkstoff-Konjugat Gemtuzumab Ozogamicin das krankheitsfreie Überleben verlängert werden. Von dieser Therapie profitiert vor allem die Gruppe mit einer günstigen Prognose.
Bei sekundärer AML steht die liposomale Formulierung von Daunorubicin/Cytarabin (CPX-351) zur Verfügung. Diese zeigte in einer Studie bei älteren Patient:innen (über 65 Jahre) ein verlängertes Gesamtüberleben im Vergleich zu 3+7. Nicht zuletzt durch diese rezenten Entwicklungen bewegen wir uns mittlerweile weg von der „One size fits all“-Therapie hin zu individualisierten Möglichkeiten, unsere Patient:innen zu behandeln.
Der Gruppe der unfitten bzw. nicht transplantablen Patient:innen stehen mittlerweile weniger intensive, gut verträgliche Therapien zur Verfügung. Auch fitte Patient:innen mit schlechter Prognose (z.B. p53-mutiert) können aufgrund der besseren Verträglichkeit und der in etwa gleichen Ansprechraten in der Induktionsphase in einem besseren Zustand einer lebensverlängernden allogenen Stammzelltransplantation nach nichtintensiver Therapie zugeführt werden.
Hier stellt die Behandlung mit Azacitidin und Venetoclax den Standard für die meisten Patient:innen dar. Diese Kombination zeigt in der VIALE-A-Studie eine deutliche Verlängerung des Gesamtüberlebens und Remissionsraten von bis zu 60%, abhängig von der beobachteten Untergruppe.3 Aus dieser Studie werden mittlerweile nach entsprechend langer Nachbeobachtungszeit (40 Monate) immer wieder neue Daten publiziert. So hat zuletzt die Forschungsgruppe um Hartmut Döhner berichtet, dass eine Einteilung nach der ELN-Risikostratifizierung keinen prädiktiven Einfluss auf das Outcome der Studienpatient:innen zeigte.4
Mittels einer modifizierten Risikostratifizierung unter Berücksichtigung des Mutationsstatus von vier Genen (FLT3-ITD,KRAS, NRAS und TP53) wurden drei Prognosegruppen („higher benefit“, „intermediate benefit“, „lower benefit“) für die Behandlung mit Azacitidin/Venetoclax definiert.4
Seit letztem Jahr steht auch eine zweite Kombinationstherapie, nämlich jene aus Azacitidin und Ivosidenib, für Patient:innen mit Isocitrat-Dehydrogenase-1(IDH-1)-Mutation zur Verfügung. Diese verspricht in der AGILE-Studie eine deutlich höhere Überlebensrate im Vergleich zur Monotherapie mit Azacitidin und eine möglicherweise bessere Verträglichkeit als die Kombination mit Venetoclax.5
Blick in die Zukunft
Zukünftige Targets und Substanzen für die Therapie der akuten myeloischen Leukämie werden derzeit intensiv erforscht. In klinischen Studien laufen unter anderem Untersuchungen mit Magrolimab (in Kombination mit Azacitidin/Venetoclax), einem monoklonalen Antikörper gegen CD47, oder Menin-Inhibitoren wie Revumenib (bei Patient:innen mit KMT2A-Rearrangement oder NPM1-Mutation). Von welcher Relevanz diese und weitere neuartige Substanzen in den zukünftigen Therapiestandards sein werden, wird sich in den kommenden Jahren zeigen.
Fazit
Zusammenfassend lässt sich sagen, dass die Behandlung der AML immer effektiver und individualisierter stattfindet. Von entscheidender Bedeutung ist hier aufgrund der zunehmenden Wertigkeit der Molekularbiologie bei der Therapieplanung eine optimale Kooperation mit den entsprechenden Laborinstituten. Wie bei allen hämatologischen Erkrankungen ist auch bei Patient:innen mit AML die richtige Einschätzung des physiologischen Zustands der Patient:innen essenziell. Hier zählt nicht das chronologische, sondern das biologische Alter und dessen objektive Bestimmung mit validierten Scores.
Literatur:
1 Statistik Austria: Österreichisches Krebsregister (Stand 17.1.2023) und Todesursachenstatistik 2 Ahmed A et al.: EPR22-104: a comparison of the burden of leukemia amongst various regions of the world, 1990-2019. J Natl Compr Canc Netw 2022; 20(3.5): EPR22-104-EPR22-104 3 DiNardo CD et al.: Azacitidine and venetoclax in previously untreated acute myeloid leukemia. N Engl J Med 2020; 383(7): 617-29 4 Döhner H et al.: ELN Risk Stratification is not predictive of outcomes for treatment-naïve patients with acute myeloid leukemia treated with venetoclax and azacitidine. Blood 2022; 140(Suppl. 1): 1441-4 5 Montesinos P et al.: Ivosidenib and azacitidine in IDH1-mutated acute myeloid leukemia. N Engl J Med 2022; 386: 1519-31
Das könnte Sie auch interessieren:
Primäre Hyperoxalurie Typ 1 – seltene Erkrankung mit lebenslanger Intervention
Von allen drei Typen stellt die primäre Hyperoxalurie Typ 1 (PH1) die häufigste und gleichzeitig aggressivste Form dar. Sie zeichnet sich durch Steinbildung in Niere und harnableitenden ...
Sectioindikationen im Wandel der Zeit
Wie viele Sectioindikationen kennen Sie? Nehmen Sie sich einen kurzen Augenblick Zeit und gehen Sie die Ihnen geläufigen Indikationen im Kopf durch. Kommen Sie auf zehn verschiedene ...
Osteoporotische Wirbelkörperfrakturen: konservativ oder chirurgisch?
Wirbelkörperfrakturen verursachen erhebliche Schmerzen und führen so häufig primär zur Immobilität. Die Behandlung von traumatischen Wirbelkörperfrakturen bei jüngeren Patienten ...