Optimierung der personalisierten Therapie
An der virtuellen Jahrestagung der European Hematology Association (EHA) gab es eine Fülle spannender Daten zur akuten myeloischen Leukämie (AML), die im Folgenden zusammengefasst sind.
FLT3-mutierte AML
Mit der Zulassung von Midostaurin und Gliteritinib durch die FDA in den USA darf Midostaurin in Kombination mit «7+3» als «standard of care» in der Induktion, Konsolidation und Maintenance von Patienten mit neu diagnostizierter FLT3-mutierter AML betrachtet werden, ebenso wie die Gliteritinib-Monotherapie in der Behandlung von Patienten mit einer FLT3-mutierten rezidivierten/refraktären (R/R) AML. Ähnliches darf von der Maintenance mit dem off-label verfügbaren Sorafenib nach allogener Stammzelltransplantation gesagt werden.
Crenolanib
Crenolanib ist ein Typ-I-Tyrosinkinase-Inhibitor mit hoher Spezifität für FLT3 (aber auch für PDGFRA und KIT-Kinase-Mutanten) und kann in voller Dosierung (100mg, 3/d p.o.) ohne vermehrte Nebenwirkungen in der Induktions- und Konsolidationstherapie der FLT3-mutierten AML zusammen mit Cytarabin/Daunorubicin oder auch Cytarabin/Idarubicin und auch als alleinige Erhaltungstherapie verabreicht werden.1
Ziel der Studien von Messahel B et al.2 war die Bestimmung der klinischen Wirksamkeit, vor allem auch der Langzeitergebnisse einer Crenolanib-basierten initialen Chemotherapie von Patienten mit neu diagnostizierter FLT3-mutierter AML. Eingeschlossen wurden 27 Patienten mit einer neu diagnostizierten FLT3-mutierten AML im Alter von 18–60 Jahren, die in dieser Phase-II-Studie neben einer «7+3»-Induktionstherapie (Cytarabin 100mg/m2 d1–7 plus Daunorubicin 90mg/m2 [n=16] oder Idarubicin 12mg/m2 [n=11] d1–3) Crenolanib, 100mg 3/d p.o. 24–48h nach Beginn der Induktionstherapie bis 72h vor dem nächsten Chemotherapiezyklus erhielten.
In der Konsolidationstherapie (bis zu 4 Zyklen «high-dose cytarabine» (HiDAC): 3g/m2 <60 Jahre und 1g/m2 =60 Jahre) über 12 Stunden, d1, 3, und 5) wurde mit der Crenolanib-Therapie 24h nach der letzten Cytarabin-Gabe begonnen. Entsprechend geeignete Patienten erhielten eine Stammzelltransplantation. Eine Erhaltungstherapie mit Crenolanib (100mg 3/d p.o., bis zu 12 Zyklen) wurde nach der HiDAC-Konsolidation bzw. 30–90d nach der Stammzelltransplantation begonnen.
Bis einschliesslich Februar 2020 haben alle Patienten die Studientherapie gemäss Protokoll abgeschlossen (1 Patient erhielt auf eigenen Wunsch die Crenolanib-Erhaltungstherapie über 25 Monate). 85% (23/27) der Patienten kamen in komplette Remission (CR), alle schon nach dem 1. Induktionszyklus. Bisher haben 3 Patienten rezidiviert, alle im 1. Jahr der Behandlung, und bei Patienten, die zumindest 1 Zyklus der Crenolanib-Erhaltungstherapie erhielten, ereigneten sich keine Rezidive.
Nach einer medianen Beobachtungszeit von 43,2 Monaten leben noch 21/27 Patienten (Rate des «overall survival», OS: 76,8%). 7/23 Patienten in CR erhielten eine HiDAC-Konsolidierungstherapie mit Crenolanib, aber keine allogene Stammzelltransplantation. Diese 7 Patienten waren «intermediate risk» (ELN-Richtlinien), 4/7 Patienten hatten FLT3-ITD-, DNMT3A- und NPM1-Mutationen und 7/7 hatten eine hohe Allellast. 6/7 Patienten sind weiterhin in einer Langzeitremission.
Obwohl die Zahlen klein sind, wurde ein ähnliches OS in Patienten, die sich einer Stammzelltransplantation unterzogen, wie in jenen ohne Stammzelltransplantation beobachtet.
Diese Daten weisen auf ein sehr hohe klinische Wirksamkeit einer Standard-Induktions- und Konsolidationstherapie in Kombination mit dem FLT3-Inhibitor Crenolanib in der Behandlung von Patienten mit einer neu diagnostizierten FLT3-mutierten AML hin: Das mediane «event-free survival» (EFS) und die kumulative Rezidivinzidenz (CIR) wurden noch nicht erreicht, kein Rezidiv ereignete sich bei einem Patienten nach Abschluss der Crenolanib-Erhaltungstherapie.
Eine multizentrische, randomisierte Phase-III-Studie (NCT03258931), die die Wirksamkeit von Crenolanib vs. Midostaurin in der Kombination mit einer Standard-Chemotherapie in der Behandlung von Patienten mit einer neu diagnostizierten FLT3-mutierten AML untersucht, rekrutiert derzeit.
Obwohl die Daten dieser multizentrischen Phase-III-Studie natürlich abgewartet werden müssen, sind die Daten der jetzt vorliegenden Phase-II-Studie so gut, dass mit einem Paradigmenwechsel in der Behandlung der FLT3-mutierten AML schon bald zu rechnen ist.
Gliteritinib
Einen ähnlichen Erfolg konnte die Gruppe um Perl AE et al. in einer Follow-up-Analyse einer Phase-III-Studie zeigen, die eine Gliteritinib-Monotherapie versus Salvage-Chemotherapie in der Behandlung von relapsierten/refraktären FLT-mutierten AML-Patienten untersucht.3 Das mediane OS betrug 9,3 Monate versus 5,6 Monate, die 12-Monats-OS-Rate 37% versus 19%, die 18-Monats-OS-Rate 27% versus 15%, die 24-Monats-OS-Rate 20% versus 14%.
IDH1/IDH2-mutierte AML
DiNardo C et al.4 zeigten vielversprechende Daten einer Phase-II-Studie in der Therapie einer neu diagnostizierten AML, für die eine intensive Chemotherapie nicht infrage kam. In der Studie wurde der Einsatz des IDH2-Inhibitors Enasedenib (100mg p.o.) plus Azacytidin (75mg/m2 Tag 1–7, s.c.) versus Azacytidin allein untersucht, mit folgenden Ergebnissen: Gesamtansprechen (ORR): 71% versus 47%; komplette Remission (CR): 53% versus 12%; EFS: 17,2 Monate versus 10,8 Monate (HR: 0,50). Das OS betrug in beiden Gruppen jedoch jeweils 22 Monate, was unter Umständen durch eine hohe Rate (25%) des «Cross-overs» nach Stopp von Azacytidin zu einer Therapie mit Enasidenib erklärt werden könnte.
Ähnlich vielversprechende, wenn auch noch präliminäre Daten konnte DiNardo auch für den IDH1-Inhibitor Ivosidenib präsentieren.5
Ein grosser Vorteil der Therapie mit IDH1/IDH2-Inhibitoren ist, dass die Behandlung mit Biomarkern (2-Hydroxy-Glutarat; VAF IDH1-mut/IDH2-mut) kontrolliert und nachverfolgt werden kann.
AML: Inhibition der «smoothened receptor»(SMO)-stimulierten Hyperproliferation
Heuser M et al.6 zeigten, dass Glasdegib, ein «Hedgehog protein»-Inhibitor, in Kombination mit «low dose» Cytarabin (AraC) in der Behandlung von Patienten mit einer «AML/«high risk» MDS, für die eine Induktionschemotherapie nicht infrage kam, der Behandlung mit «low dose» AraC alleine deutlich überlegen ist (medianes OS: 8,3 Monate versus 4,3 Monate; 1-Jahres-OS-Rate: 39,5% versus 9,5%; 2-Jahres-OS-Rate: 18,0% versus 2,4%; CR: 16/88 versus 1/44. Zu beachten sind jedoch die Nebenwirkungen wie Dysgeusie, Muskelspasmen und Alopezie, wobei jedoch nur ein Patient die Therapie wegen Dysgeusie abbrach.
AML: Inhibition der DNA-Hypermethylierung
Zeidan A et al.7 präsentierten Daten einer Phase-III-Studie, in der die Therapie mit Guadecitabin, einem hypomethylierendem Agens der zweiten Generation versus Azacytidin(75mg/m2, d1–7, 28d-Zyklus) und Decitabin (20mg/m2, d1–5, 28d-Zyklus) untersucht werden sollte. Obwohl die Patienten mit einer Azacytidin- bzw. einer Decitabin-Therapie gegeneinander nicht randomisiert worden waren, waren die Patientencharakteristika doch gut ausbalanciert: Azacytidin und Decitabin unterschieden sich nicht bzgl. OS, CR oder der Nebenwirkungen.
AML: Anti-Anti-Apoptose
Zeidner J et al.8 zeigten erste Daten einer Phase-I-Studie, in der der CDK-9-Inhibitor (und damit Inhibitor des MCL-1-Apoptoseregulatorproteins) Alvocidib (20mg/m2 d1–3, Bolus, gefolgt von 30mg/m2 über 4h i.v.; Dosiseskalation 30mg/m2 i.v. Bolus -> 60mg/m2 über 3h i.v.) Patienten mit neu diagnostizierter AML vor Beginn eines klassischen «7 +3» Schemas (ab d5) verabreicht wurde. Neben Diarrhö (43,8%) und Hypokaliämie (31,3%) war die Hauptnebenwirkung ein Tumorlysesyndrom (31,3%). Die Resultate aber waren sehr erfreulich: CR: 89% («favourable»), 71% («intermediate»), 60% («adverse»), 8/9 der Patienten in CR waren MRD-negativ. Die 1-Jahres-OS-Rate betrug 70,7%, Rezidive traten bei 32% der Patienten auf; 41% der Patienten konnten transplantiert werden.
In einem der «Late Breaking Abstracts» präsentierte DiNardo Daten einer Phase-III-Studie, die die Überlegenheit einer Kombinationstherapie von Venetoclax (400mg/d p.o., 3d «ramp up»; 28d-Zyklus) und Azacytidin (75mg/m2 s.c./i.v., d1–7, 28d-Zyklus) gegenüber Azacytidin alleine in der Behandlung von Patienten mit einer neu diagnostizierten AML, die für eine Induktionschemotherapie nicht infrage kamen, deutlich belegen konnten.9 Das mediane OS betrug 14,7 Monate versus 9,6 Monate (HR 0,66) (Abb. 1), die CR/CRi 66% versus 28%; die mediane Zeit bis zur CR/CRi war 1,3 Monate versus 2,8 Monate; die Dauer der CR/CRi war 17,5 Monate versus 13,4 Monate. Eine febrile Neutropenie trat in der Venetoclax-Gruppe deutlich häufiger auf (42% versus 29%; sAE: 30% versus 10%), ebenso gastrointestinale Nebenwirkungen wie Diarrhö, Obstipation, Übelkeit und Erbrechen. Zu einem Tumorlysesyndrom kam es in der Venetoclax-Gruppe nur selten (1%).
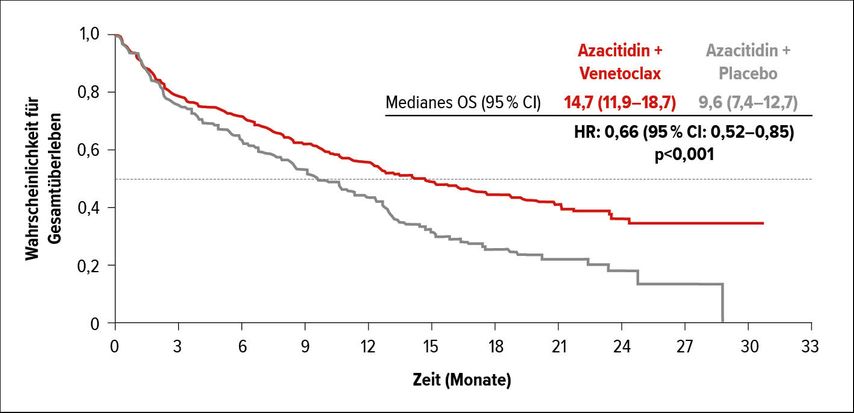
Abb. 1: Gesamtüberleben in der VIALE-A-Studie (nach DiNardo C et al.: EHA 2020, Abstr. #LB2601)
Ravandi F et al.10 berichteten über den Erfolg einer peroralen Therapie mit einem oralen hypomethylierenden Agens, CC-486, in der Erhaltungstherapie älterer Patienten mit einer AML in Erstremission nach erfolgreicher Induktionschemotherapie. CC-486 ist ein orales hypomethylierendes Agens, das ausgedehnte Dosierungsschemata erlaubt (>7d/Zyklus). In der internationalen, randomisierten, placebokontrollierten Phase-III-Studie QUAZAR AML-001 (NCT01757535) führte eine Erhaltungstherapie mit CC-486 bei älteren Patienten (≥55 Jahre) mit einer AML in 1. Remission nach Induktionschemotherapie zu einem signifikant längeren OS und «relapse-free survival» (RFS) im Vergleich zu Placebo.11
Insgesamt erhielten 469/472 der eingeschlossenen Patienten (99,4%) ≥1 Dosis des Studienmedikaments; deren Daten waren daher verfügbar für die Sicherheits- und Verträglichkeitsanalysen (CC-486 n=236; Placebo n=233). Das mediane
Alter der Gesamtstudiengruppe war 68 Jahre (55–86), mit ähnlicher Altersverteilung im CC-486- und im Placebo-Arm: 55–64 Jahre: 28% versus 29%, 65–74 Jahre: 61% versus 61% und ≥75 Jahre: 12% versus 10%. In der Altersgruppe ≥75 Jahre war das mediane OS im CC-486-Arm 24,8 Monate versus 9,9 Monate im Placebo-Arm (HR: 0,48; 95% CI: 0,25–0,94; p=0,0281). Das mediane RFS betrug 10,2 Monate versus 2,3 Monate (HR: 0,40; 95% CI: 0,20–0,79; p=0,0061). Im CC-486- und im Placebo-Arm und in den verschiedenen Altersgruppen waren die Nebenwirkungsraten ähnlich denen in der Gesamtpopulation. Das seltenere Auftreten einer Thrombozytopenie in der Altersgruppe ≥75 Jahre hingegen ist auffällig und bedarf weiterer Untersuchungen.
CC-486, die orale Form von 5-Azacytidin, 300mg p.o., d1–14/28, verlängert als gut verträgliche Erhaltungstherapie bei Patienten mit einer «intermediate» und «poor risk» AML in CR1 nicht nur das mediane RFS, sondern auch das mediane OS, ohne Verlust an Lebensqualität (HRQoL EQ-5D «index score» wie Placebo11 in allen Subgruppen, selbst in der Altersgruppe ≥75 Jahre). Überraschend sind diese Resultate vor allem auch deswegen, weil die Therapie mit einer oralen Form von 5-Azacytidin erreicht werden kann, die für die Behandlung des MDS wohl nie infrage kommen wird (Bioverfügbarkeit: 8–20%).
Bemerkenswert ist auch der Erfolg einer Dosiseskalation (21d/28d CC-486 vs. Placebo) im Falle eines Rezidivs der AML: CR/CRi: 23%/11%, OS: 22,8 Monate/14,6 Monate, 1-Jahres-OS-Rate: 80,4%/59,5%.12
AML: Antworten auf alte Fragen
Röllig C et al.13 konnten zeigen, dass die Dosierung von Daunorubicin (90mg versus 60mg, d3–5) in der Behandlung von Patienten mit einer neu diagnostizierten AML nach dem «7+3»-Schema keinerlei Unterschied macht bzgl. EFS, RFS, OS, CR/CRi oder 28d-Mortalität.
Als virtuellen Besucher dieses EHA-Kongresses hat mich der Abstract von Duchmann M besonders gefreut.14 Er kommt darin aufgrund seiner Daten zu dem Schluss, dass die sorgfältige Analyse der Morphologie bzw. der Dysplasien in der Diagnose einer AML auch in Zeiten der Genomics zusätzliche, für die Prognose der Erkrankung wichtige Informationen liefern kann. Dies unterstreicht für mich einen ganz wesentlichen Aspekt unseres Berufes: Medizin ist nicht nur eine Wissenschaft, sondern auch eine Kunst. Und es macht mir deutlich, warum ich lieber an diesen Kongress nach Frankfurt gefahren wäre, als ihn nur virtuell zu besuchen: Gerne hätte ich mit Herrn Duchmann über seine Arbeit gesprochen!
Autor:
PD Dr. med. Boris Schleiffenbaum
Hämatologie
Klinik im Park, Zürich
AndreasKlinik Cham, Hirslanden
E-Mail: boriseugen.schleiffenbaum@hirslanden.ch
Literatur:
1 Walter RB et al.: Addition of crenolanib to standard induction and consolidation therapies improved long-term outcomes in newly diagnosed FLT3-mutant AML patients ≤60 years old. EHA 2018, Abstr. #PF227 2 Messahel B et al.: Younger patients with newly diagnosed FLT3-mutant AML treated with crenolanib plus chemotherapy achieve durable remissions. EHA 2020, Abstr. #EP541 3 Perl AE et al.: Long-term survivors and safety beyond 1 year of gilteritinib therapy in patients with FLT3-mutated relapsed or refractory acute myeloid leukemia: follow-up of the admiral phase 3 trial. EHA 2020, Abstr. #EP543 4 DiNardo C et al.: Enasidenib plus azacitidine significantly improves complete remission and overall response rates versus azacitidine monotherapy in mutant-IDH2 newly diagnosed acute myeloid leukemia (ND-AML).EHA 2020, Abstr. #S139 5 DiNardo C et al.: Phase Ib/II study of the IDH1-mutant inhibitor ivosidenib with the BCL2 inhibitor venetoclax +/- azacitidine in IDH1-mutated hematologic malignancies). EHA 2020, Abstr. #S143 6 Heuser M et al.: Glasdegib (glas) plus low-dose cytarabine (LDAC) in AML or MDS: bright AML 1003 final report and 4-year overall survival (OS) follow-up. EHA 2020, Abstr. #EP545 7 Zeidan A et al.: Comparative results of azacitidine and decitabine from a large prospective phase 3 study in treatment naïve acute myeloid leukemia (TN-AML) not eligible for intensive chemotherapy. EHA 2020, #S142 8 Zeidner J et al.: ZELLA-101: phase 1 study of alvocidib followed by 7+3 induction in newly diagnosed AML. EHA 2020, Abstr. #EP551 9 DiNardo C et al.: A randomized, double-blind, placebo-controlled study of venetoclax with azacitidine vs azacitidine in treatment-naïve patients with acute myeloid leukemia ineligible for intensive therapy-VIALE-A. EHA 2020, Abstr. #LB2610 10 Ravandi F et al.: CC-486 maintainance therapy is save and well tolerated in patients aged ≥ 75 years with acute myeloid leukemia (AML) in first remission following induction chemotherapy: results from QUASAR AML-001). EHA 2020, Abstr. #EP550 11 Wei AH et al.: The Quazar AML-001 Maintenance Trial: Results of a phase III international, randomized, double-bind, placebo-controlled study of CC-486 in patients with acute myeloid leukemia (AML) in first remission. EHA 2020, Abstr. #LBA3 12 Döhner H et al.: Escalated dosing schedules of CC-486 are effective and well tolerated for patients experiencing first acute myeloid leukemia (AML) relapse: results from the phase III QUAZAR AML-001 maintenance trial. EHA 2020, Abstr. #EP561 13 Röllig C et al.: Remission and survival after 90mg versus 60 mg daunorubicin in 7+3 standard induction for newly diagnosed acute myeloid leukemia: results from the randomized controlled sal-daunodouble trial. EHA 2020, Abstr. # EP536 14 Duchmann M et al.: Is assessment of bone marrow dysplasia still relevant in acute myeloid leukemias in the genomics era? A report from the Acute Leukemia French Association. EHA 2020, Abstr. #EP552
Das könnte Sie auch interessieren:
Trifft der deutsche Ärztemangel die Schweiz?
Deutschland stehe vor einem gravierenden Ärztemangel, warnt der dortige Gesundheitsminister Karl Lauterbach. Es fehlen 50 000 Ärzt:innen. Rund 8000 sind in der Schweiz.
Kostenbremse-Initiative: Gegner:innen machen mobil
Ein überparteiliches Nein-Komitee warnt seit Montag vor der Kostenbremse-Initiative und einer Zweiklassenmedizin in der Schweiz. Befürworter:innen wollen «Akteuren Grenzen setzen».
«Hoffnung auf bessere Patientencharakterisierung und gezielte Therapie»
Forscher aus Boston haben gezeigt, dass Mutationen im TET2-Gen (es hemmt die Aktivierung myeloider Zellen und fungiert deshalb als Tumorsuppressorgen für myeloide Neoplasien) das Risiko ...