Highlights vom EHA-Kongress zum diffusen großzelligen B-Zell-Lymphom
3. Medizinische Abteilung<br> Hanusch-Krankenhaus der Wiener Gebietskrankenkasse, Wien E-Mail: michael.panny@wgkk.at
Nach einer Reihe von negativen Phase-III-Studien in der Erstlinientherapie des diffusen großzelligen B-Zell-Lymphoms (DLBCL) in den letzten Jahren wurden am diesjährigen virtuellen EHA-Kongress keine neuen randomisierten Erstliniendaten vorgestellt. Im relapsierten Setting wurden vielversprechende Daten präsentiert.
Bispezifische Antikörper auf dem Vormarsch
Bereits der CD19/CD3-bispezifische Antikörper Blinatumumab zeigte beim rezidivierten/refraktären (r/r) DLBCL Aktivität; vielversprechende Aktivitäts- und Tolerabilitätsdaten von CD3/CD2-Antikörpern wie beispielsweise Mosunetuzumab wurden u.a. auf den letzten beiden ASH-Meetings präsentiert. Der bispezifische Antikörper Glofitamab zeichnet sich durch eine 2:1-Formulierung mit zwei Bindungsstellen für CD20 und einer Bindungsstelle für CD3 aus – In-vitro-Daten zeigten eine höhere Effektivität im Vergleich zu bispezifischen CD3/CD20-Antikörpern mit 1:1-Formulierung. Daten aus der noch laufenden Phase-I-Dosiseskalationsstudie bei r/r Non-Hodgkin-Lymphomen (NHL) wurden präsentiert: Insgesamt 156 Patienten wurden behandelt, davon der Großteil mit aggressiven NHL (83%). 113 von 156 Patienten erhielten eine Dosis >10mg, im Median war das Kollektiv mit drei Therapien vortherapiert. Die Rate an Komplettremissionen (CR) lag bei Patienten mit aggressiver Histologie und einer Dosis >10mg (n=84) bei 34%, die Gesamtansprechrate (ORR) bei 49%. Um die Zytokin-Release-Rate niedrig zu halten, wurde 7 Tage vor der Verabreichung der CD20-Antikörper Obinutuzumab infundiert. Neben Hämatotoxizität (Grad-3/4-Neutropenie in 25,6% und Grad-3/4-Anämie in 8%) waren Pyrexie (30%) und Zytokin-Release-Syndrom (CRS: 56%; ≥ Grad 3 in 3,2%) die hauptsächlichen Toxizitäten – die Therapie mit Glofitamab erscheint gut tolerabel mit managebaren Nebenwirkungen. Die Remissionen scheinen bei noch niedrigen Fallzahlen (n=33) und kurzer Nachbeobachtungszeit (medianes Follow-up: 10 Monate) anhaltend, mit 24 derzeit anhaltenden kompletten Remissionen (10 >12 Monate, 14 <12 Monate)
CD19-Antikörper in Kombination mit Lenalidomid vielversprechend
Ein 2-Jahres-Follow-up der bereits am ASH-Kongress präsentierten einarmigen Phase-II-Studie L-MIND bei 81 nicht transplantationsfähigen rezidivierten/relapsierten Patientinnen mit DLBCL wurde vorgestellt. Der CD19-Antikörper Tafasitamab in Kombination mit Lenalidomid zeigte eine CR-Rate von 41,3% bei einer medianen Remissionsdauer von 21,7 Monaten, das mediane Gesamtüberleben lag bei 31,6 Monaten. Die Verabreichung erfolgte in der Kombination über 12 Zyklen, bei Ansprechen wurde die Antikörpertherapie fortgeführt. Die Kombinationstherapie wurde sehr gut vertragen, neben Hämatotoxizität (Neutropenie ≥ Grad 3 in 49%, febrile Neutropenie 12,3%) zeigten sich schwere unerwünschte Ereignisse nur in 2%. Einschränkend sei erwähnt, dass primär refraktäre Patienten nicht in die Studie inkludiert wurden. Um die (synergistische) Aktivität von Tafasitamab und Lenalidomid zu evaluieren, erfolgte der ungewöhnliche Vergleich mit Real-World-Daten von 490 retrospektiv erhobenen und mittels 9 Baseline-Charakteristika gematchten Patientinnen mit Lenalidomid-Monotherapie – die sogenannte RE-MIND-Studie wurde von Pier Luigi Zinzani präsentiert. 76 gematchte Patienten wurden ausgewertet – die „Best ORR“-Rate zeigte sich in der L-Mind-Kohorte mit 67,1% signifikant höher als in der gematchten Kohorte mit Lenalidonid-Monotherapie (best ORR: 34,2%), die Rate an kompletten Remissionen lag in der Kombinationstherapie mit 39,5% ebenso deutlich über der CR-Rate unter der Lenalidomid-Monotherapie (CR-Rate: 13,2%) – dies führt zu einem signifikanten Vorteil im progressionsfreien Überleben (PFS: 12,1 vs. 4,0 Monate) und Gesamtüberleben (OS: nicht erreicht vs. 9,4 Monate) (Abb. 1) in der L-MIND-Kohorte.
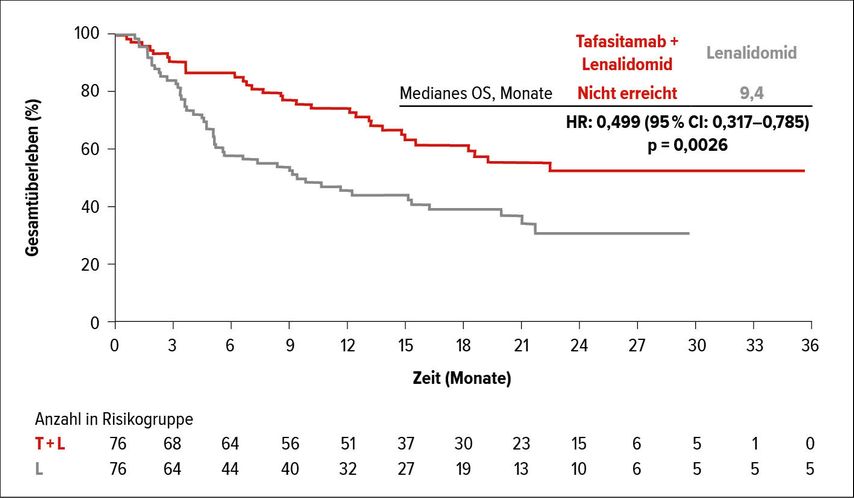
Abb. 1
Weiterentwicklung der CAR-T-Zell-Therapie
Zur Weiterentwicklung der Chimärer-Antigen-Rezeptor(CAR)-T-Zell-Therapie sei exemplarisch die ALEXANDER-Studie genannt. Zwei potenzielle Mechanismen für ein Versagen der CAR-T-Zell-Therapie sind der Verlust von CD19 und die PD-L1-Hochregulierung der Tumorzelle. Um diese Mechanismen zu umgehen, wurde ein bicistronischer CAR mit den Zielpunkten CD19 und CD22 konstruiert und in Kombination mit dem PD-1-Inhibitor Pembrolizumab (in unterschiedlichen Schemata) verabreicht. Bisher wurden 23 Patienten mit dem bicistronischen CAR in Kombination mit Pembrolizumab behandelt. Als Haupttoxizität zeigte sich eine Hämatotoxizität, ansonsten erscheint die Therapie gut tolerabel, insbesondere zeigten sich bisher kaum schwere Neurotoxizität (5%) und kein schweres CRS. In der empfohlenen Phase-II-Dosis konnte bei 5 von 8 Patientinnen eine komplette Remission erzielt werden. Bei einem medianen Follow-up von 3 Monaten erscheinen die Remissionen anhaltend: 10 von 11 Patientinnen sind in anhaltender Remission. Die ORR-Rate lag bei 64% bei einer CR-Rate von 55%.
Neben Neuentwicklungen im CAR-T-Zell-Bereich wurden neuerlich Real-World-Daten der bereits zugelassenen CD19-CAR-T-Zell-Therapie präsentiert, diesmal aus Großbritannien. Bei 253 Patientinnen mit r/r Erkrankung wurde zentral die Indikation zur CAR-T-Zell-Therapie gestellt, bei 235 erfolgte eine Apherese, 183 wurden reinfundiert (133 Axi-Cel, 50 Tisagen). Die mediane Zeit bis zur Reinfusion lag bei 57 Tagen, 84% der Patientinnen erhielten eine Bridging-Therapie. Nach einem medianen Follow-up von 10 Monaten zeigten 97 Patientinnen einen Progress der Grunderkrankung – das Plateau bei 35–40% der reinfundierten Patientinnen konnte bestätigt werden. Von den 97 Patientinnen mit Progress sind nach einer medianen Beobachtungszeit von 137 Tagen nur 39 am Leben. Diese Real-World-Daten bestätigen neuerlich die Effektivität der CAR-T-Zell-Therapie, allerdings zeigt sich wiederum das bekannte Optimierungspotenzial in Logistik, Bridging-Therapie und der Therapie nach dem CAR-T-Relaps.
Zusammenfassung
Auch nach dem EHA 2020 bleibt R/CHOP (like) die Standard-Erstlinientherapie, vielversprechende Ergebnisse von Antikörper- bzw. Antikörperkombinationstherapien und Weiterentwicklungen in der CAR-T-Zell-Therapie bei relapsierten/refraktären Patienten geben Hoffnung. In welcher Sequenz und in welcher Kombination oben genannte Therapieoptionen in Zukunft eingesetzt werden können, bleibt abzuwarten.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
«Können für das Management von Bedeutung sein»
Modic Changes beschreiben Veränderungen in der Wirbelsäulen-MRT, die auf den Radiologen Dr. Michael Modic zurückgehen. Welchen Stellenwert die Veränderungen haben und wann sie ...
Nur eine von vielen Begleiterscheinungen
Warum er MRT-Veränderungen bei unspezifischen Rückenschmerzen wenig Bedeutung beimisst, erklärt Prof. Dr. med. Andreas Seekamp aus Kiel.
Modic Changes bei Rückenschmerzen
Obwohl die Erstbeschreibung fast 40 Jahre her ist, ist immer noch nicht klar, wodurch die MRT-Veränderungen entstehen und welchen Stellenwert sie für Diagnostik und Therapie haben.