Entwicklung von innovativen und optimierten Therapieregimen
Auch der ESMO World Congress on Gastrointestinal Cancer fand in diesem Jahr als virtuelle Veranstaltung im heimatlichen Wohnzimmer statt. Wenn es auch an dem persönlichen wissenschaftlichen Austausch fehlte, so wurden doch spannende Studienergebnisse zur Optimierung der Behandlung gastrointestinaler Tumoren vorgestellt.
Neue Kombinationstherapie mit liposomalem Irinotecan beim Pankreaskarzinom
Nichtliposomales Irinotecan ist eine Komponente des FOLFOXIRI-Regimes,
allerdings verfügt es über einen komplexen und schnellen Metabolismus, eine nur kurze Halbwertszeit und eine dosislimitierende Toxizität. Liposomales Irinotecan könnte einen Vorteil gegenüber der nichtliposomalen Formulierung bringen. In einer Phase-I/II-Studie wurde daher die Kombination von liposomalem Irinotecan mit 5-FU/LV und Oxaliplatin (NALIRIFOX) in der Behandlung von therapienaiven Patienten mit lokal fortgeschrittenem oder metastasiertem duktalem Adenokarzinom des Pankreas (PDAC) untersucht.1 31 Patienten wurden in 4 Kohorten mit unterschiedlichen Dosierungen behandelt. Nach einer Erweiterung der Phase-Ib-Studie um 25 Patienten hatten insgesamt 32 Patienten das 50/60-Regime mit 50mg/m2 liposomalem Irinotecan, 2400mg/m2 5-FU, 400mg/m2 LV und 60mg/m2 Oxaliplatin erhalten. Die Patienten waren im Median 58 Jahre alt und 72% der Patienten waren jünger als 65 Jahre. Die Mehrheit der Patienten (87,5%) wurde im Tumorstadium IV diagnostiziert. Bezüglich der Sicherheit führten Nebenwirkungen bei 81,3% der Patienten zu Dosisanpassungen und 25% der Patienten brachen die Behandlung aufgrund von Nebenwirkungen ab. Bei 53,1% der Patienten wurden klinisch relevante Nebenwirkungen beobachtet, die bei 9,4% der Patienten letal waren. Die häufigsten Nebenwirkungen Grad ≥3 waren Neutropenie (31,3%), febrile Neutropenie (12,5%) und eine verringerte Neutrophilenzahl (9,4%). Ein Ansprechen wurde bei 34,4% der Patienten beobachtet, 3,1% der Patienten zeigten eine komplette Remission. Bei weiteren 46,9% der Patienten wurde eine stabile Erkrankung erreicht. Im Median betrug die Dauer des Ansprechens 9,4 Monate. Das mediane progressionsfreie Überleben (PFS) lag bei 9,2 Monaten (95% CI: 7,69–11,96), das mediane Gesamtüberleben (OS) bei 12,6 Monaten (95% CI: 8,74–18,69). In der Phase-III-Studie NAPOLI-3 wird NALIRIFOX nun gegen Gemcitabin plus nab-Paclitaxel geprüft.
Prävalenz von pathologischen Keimbahnvarianten
Laut früheren Studien sind etwa 3,8–20,7% der Patienten mit Adenokarzinom des Pankreas Träger von pathogenen Keimbahnvarianten (PV). Die Familiengeschichte, das Krankheitsstadium oder das Alter bei der Diagnose ist nicht immer ein Prädiktor für das Vorhandensein von PV. Um die Prävalenz von Tumor-bedingenden Keimbahnvarianten bei einem unselektierten europäischen Kollektiv sowie die prognostische und prädiktive Signifikanz der PV zu untersuchen, wurden Daten von 549 Patienten mit Pankreaskarzinomdiagnose zwischen Februar 2003 und Januar 2020 ausgewertet.2 Im Ergebnis wurden bei 4% der Patienten PV innerhalb der Pankreaskarzinom-assoziierten Gene sowie bei 7,7% der Patienten in homologen rekombinanten Reparatur(HRR)-Genen identifiziert. Bei 43,3% der Patienten mit PV lag eine Tumor-Familienhistorie vor, ebenso bei 28,0% der Patienten ohne PV. In Bezug auf die Prognose wurde, mit einer medianen Nachbeobachtungszeit von 47,3 Monaten, insgesamt ein OS von median 14,5 Monaten erreicht. Mit PV war das Risiko, zu versterben, gegenüber Nichtträgern einer PV um 35% reduziert (HR:0,65; 95% CI: 0,47–0,89; p=0,007). In einer multivariaten Analyse blieb nur ein Trend, aber keine Signifikanz bezüglich des Prognosevorteils bei Anwesenheit von PV bestehen. Die Interaktion zwischen Platinaussetzung und HRR-PV war nicht signifikant. Das OS war vergleichbar zwischen Patienten, die im gesamten Krankheitsverlauf keine Platintherapie erhalten hatten, unabhängig vom HRR-PV-Status (HR:0,86; 95% CI: 0,48–1,55). Bei Trägern einer PV in Pankreaskarzinomgenen wurde ein Trend zu einem verlängerten OS gegenüber Nichtträgern bei Gabe einer Platin-basierten Therapie beobachtet (HR:0,52; 95% CI: 0,25–1,06).
Erstlinienbehandlung mit Nivolumab ist Sorafenib beim Leberzellkarzinom überlegen
Für Patienten mit fortgeschrittenem Leberzellkarzinom (HCC), die für eine Operation oder eine lokale Therapie nicht infrage kommen, gibt es nur wenige effektive Erstlinienoptionen. In der Phase-III-Studie CheckMate 459 wurden die klinische Effektivität und die Sicherheit von Nivolumab versus Sorafenib für diese Patientenklientel untersucht. Beim WCGC wurden Langzeitdaten präsentiert.3
In der CheckMate-459-Studie erhielten 743 Patienten randomisiert Nivolumab (240mg, q2w) oder Sorafenib (400mg bid). In der primären Analyse betrug das OS 16,4 Monate für Nivolumab versus 14,7 Monate für Sorafenib (HR: 0,85; 95% CI:0,72–1,02; p=0,075). Mit einer minimalen Nachbeobachtungszeit von 33,6 Monaten bestätigte sich der numerische, klinisch relevante Vorteil von Nivolumab mit 16,4 versus 14,8 Monaten medianem OS (HR:0,85; 95% CI: 0,72–1,00; p=0,052). Die OS-Raten nach 12, 24 und 33 Monaten betrugen für Nivolumab versus Sorafenib 60% vs. 55%, 37% versus 33% und 29% versus 21% (Abb. 1). Unter Nivolumab zeigte sich ein konsistentes OS mit median 16,1 bzw. 16,7 Monaten, unabhängig von einer PD-L1-Expression ≥1% oder <1%. Im Sorafenib-Arm betrug das mediane OS nur 8,6 Monate bei Patienten mit PD-L1-Expression ≥1 und 15,2 Monate bei einer PD-L1-Expression <1%. Auch in Subgruppenuntersuchungen bezüglich der viralen Ätiologie wurden mit Nivolumab konsistente OS-Ergebnisse für HCV- (median 17,5 Monate), HBV-Patienten (median 16,1 Monate) und nicht infizierte Patienten beobachtet. Im Sorafenib-Arm lag das mediane OS dieser Subgruppen bei 12,7, 10,4 und 17,4 Monaten.
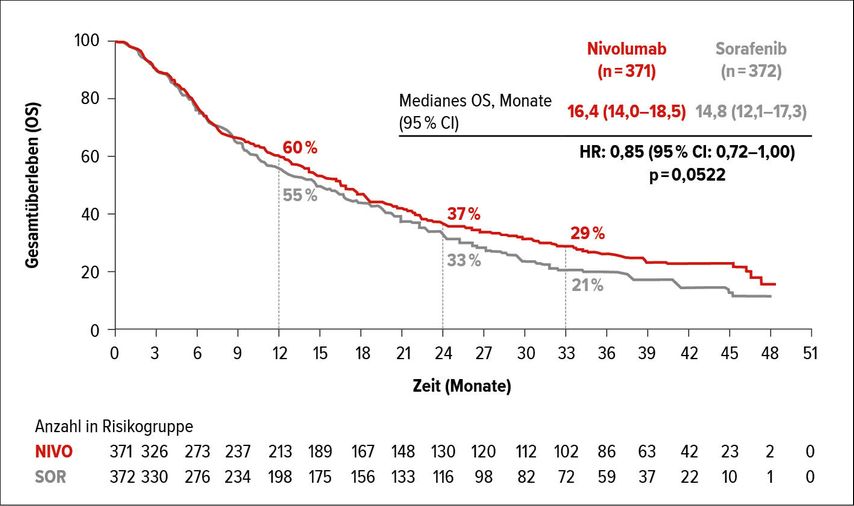
Abb. 1: Gesamtüberleben (OS) von HCC-Patienten unter der Behandlung mit Nivolumab versus Sorafenib (Sangro B et al.)3
Die Leberfunktion wurde im Studienverlauf unter Nivolumab besser erhalten verglichen mit Sorafenib. Zudem wurden unter Nivolumab weniger Nebenwirkungen beobachtet. Therapie-assoziierte Nebenwirkungen von Grad 3–4 traten bei 22% der Patienten unter Nivolumab versus 50% unter Sorafenib auf. 8% versus 11% der Patienten brachen die Therapie aufgrund von Nebenwirkungen ab.
Eine nachfolgende Therapie erhielten 39% der Patienten im Nivolumab-Arm versus 47% der Patienten im Sorafenib-Arm. Patienten des Sorafenib-Arms erhielten zudem häufiger eine nachfolgende Immuntherapie (Nivolumab: 2% vs. Sor: 21%) oder eine investigative Therapie (3% vs. 11%).
Ältere Patienten profitieren von Atezolizumab plus Bevacizumab
In der randomisierten Phase-III-Studie IMbrave150 wurde eine Verlängerung des Gesamtüberlebens mit Atezolizumab plus Bevacizumab in der Erstlinientherapie bei Patienten mit nicht resektablem Leberzellkarzinom gegenüber Sorafenib gezeigt. Das Risiko, zu versterben, wurde um 42% (HR:0,58; 95% CI: 0,42–0,79) und das Risiko für einen Progress um 41% (HR:0,59; 95% CI: 0,47–0,76) reduziert. Zudem kam es zu einer klinisch relevanten Verzögerung der Verschlechterung der Lebensqualität. In einer beim WCGC präsentierten Auswertung wurde der Fokus auf den Therapieerfolg bei älteren Patienten (≥65 Jahre) gelegt.4
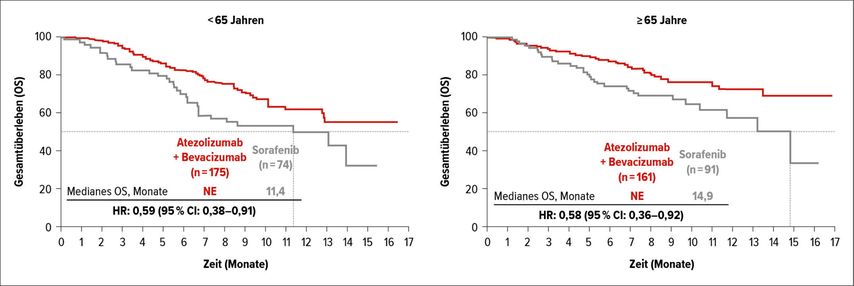
Es wurden 161 ältere Patienten mit Atezolizumab plus Bevacizumab und 91 mit Sorafenib behandelt. Bezüglich der Effektivität wurde kein Unterschied zwischen den unterschiedlichen Altersgruppen gesehen: Unter der Therapie mit Atezolizumab plus Bevacizumab war das mediane OS in beiden Altersgruppen noch nicht erreicht und betrug unter Sorafenib 11,4 Monate (<65 Jahren) bzw. 14,9 Monate (≥65 Jahre) (Abb. 2). Die Risikoreduktion im experimentellen Arm lag bei 41% (HR:0,59; 95% CI: 0,38–0,91) für die <65-Jährigen und bei 42% (HR:0,58; 95% CI: 0,36–0,92) für die ≥65-Jährigen. Das PFS lag bei median 6,7 (<65 Jahren) bzw. 7,7 Monaten (≥65 Jahre) unter Atezolizumab plus Bevacizumab versus 2,9 bzw. 4,8 Monate unter Sorafenib. Das Risiko für einen Progress wurde um 50% (<65 Jahren; HR:0,50; 95% CI: 0,36–0,71) und 37% (≥65 Jahre; HR:0,63; 95% CI: 0,45–0,89) reduziert. Ein Ansprechen zeigten 29% bzw. 26% der Patienten unter Atezolizumab plus Bevacizumab und 10% bzw. 13% der Patienten unter Sorafenib. Das Sicherheitsprofil war bei älteren und jüngeren Patienten generell konsistent. Atezolizumab plus Bevacizumab sollte daher auch bei älteren Patienten mit nichtresektablem HCC, die noch keine vorherige systemische Therapie erhalten haben, in Erwägung gezogen werden.
Abb. 2: Gesamtüberleben (OS) von HCC-Patienten unter der Behandlung mit Atezolizumab/Bevacizumab versus Sorafenib nach Altersgruppen (nach Li D etal.)4
Zusammenhang zwischen CEA-Spiegeln und Therapieerfolg beim Kolorektalkarzinom
Encorafenib plus Cetuximab verbesserten das Gesamtüberleben von vorbehandelten Patienten mit BRAFV600E-mutiertem, metastasiertem Kolorektalkarzinom (CRC) mit oder ohne Binimetinib im Vergleich zur Irinotecan-basierten Therapie. Da die Höhe der CEA- und CA19-9-Spiegel zu Studienbeginn in der Regel mit der Prognose korreliert, wurden die Daten der BEACON-CRC-Studie in Bezug auf den Zusammenhang zwischen CEA und dem Therapieerfolg untersucht.5
In der dreiarmigen Phase-III-Studie BEACON CRC erhielten Patienten randomisiert Encorafenib, Binimetinib und Cetuximab oder Encorafenib plus Cetuximab oder als Kontrolltherapie Irinotecan plus Cetuximab oder FOLFIRI plus Cetuximab. Etwa 77% der Patienten mit BRAFV600E-mutiertem CRC hatten bei Studieneinschluss erhöhte CEA-Spiegel. In allen Studienarmen waren niedrigere CEA-Spiegel mit einem verlängerten OS assoziiert. Nur im Kontrollarm konnte eine Assoziation zwischen einem höheren CEA-Spiegel bei Therapiebeginn und einem Tumorprogress als bestem Ansprechen festgestellt werden. In den experimentellen Armen wurde häufiger ein Rückgang erhöhter CEA-Spiegel gesehen als im Kontrollarm (52–60% vs. 1–6%). Der CEA-Rückgang war mit einem verlängerten OS assoziiert. Im experimentellen Arm wurden regelmäßig auch frühe transiente CEA-Rückgänge gesehen, wenn Patienten eine Progression als bestes Ansprechen zeigten. Daraus könnte geschlossen werden, dass sich bei einer Subgruppe von Patienten schnell Resistenzmechanismen entwickeln.
Bericht:
Dr. Ine Schmale
Quelle:
ESMO World Congress on Gastrointestinal Cancer 2020 – Virtual: 1.–4. Juli 2020
Literatur:
1 Zev A et al.: First-line liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin in patients with pancreatic ductal adenocarcinoma: long-term follow-up results from a phase 1/2 study. WCGC 2020, Abstr. #LBA-1 2 Fountzilas E et al.: Prevalence and prognostic role of inherited germline pathogenic variants in cancer predisposing genes in unselected patients with pancreatic cancer. WCGC 2020, Abstr. #SO-2 3 Sangro B et al.: CheckMate 459: long-term survival outcomes with nivolumab versus sorafenib as first-line treatment in patients with advanced hepatocellular carcinoma. WCGC 2020, Abstr. #LBA-3 4 Li D et al.: Atezolizumab + bevacizumab vs sorafenib for unresectable hepatocellular carcinoma (HCC): results from older adults enrolled in IMbrave150. WCGC 2020, Abstr. #O-8 5 Grothey A et al.: Encorafenib plus cetuximab with or without binimetinib for BRAF V600E metastatic colorectal cancer: relationship between carcinoembryonic antigen and clinical outcomes from BEACON CRC. WCGC 2020, Abstr. #LBA-7
Das könnte Sie auch interessieren:
Trifft der deutsche Ärztemangel die Schweiz?
Deutschland stehe vor einem gravierenden Ärztemangel, warnt der dortige Gesundheitsminister Karl Lauterbach. Es fehlen 50 000 Ärzt:innen. Rund 8000 sind in der Schweiz.
Kostenbremse-Initiative: Gegner:innen machen mobil
Ein überparteiliches Nein-Komitee warnt seit Montag vor der Kostenbremse-Initiative und einer Zweiklassenmedizin in der Schweiz. Befürworter:innen wollen «Akteuren Grenzen setzen».
«Hoffnung auf bessere Patientencharakterisierung und gezielte Therapie»
Forscher aus Boston haben gezeigt, dass Mutationen im TET2-Gen (es hemmt die Aktivierung myeloider Zellen und fungiert deshalb als Tumorsuppressorgen für myeloide Neoplasien) das Risiko ...