Virtuelles Meeting internationaler Lungentumorspezialisten
Nach der erfolgreichen Premiere im vergangenen Jahr war für den Mai dieses Jahres eine zweite Ausgabe des „International Lung Cancer Summit“ (ILCS) in Genf geplant. Aus aktuellem Anlass wurde das Meeting schließlich virtuell durchgeführt. Beibehalten wurde das Programm mit einem Mix aus Referaten verschiedener hochkarätiger Experten, bei denen je nach Thema auch der Bezug zu Covid-19 nicht fehlte.
Dr. Stephen Liu, Washington DC/USA, sprach in seinem Referat über das kleinzellige Lungenkarzinom (SCLC). Es macht etwa 13% der neudiagnostizierten Lungenkarzinomfälle aus, ist stark mit Tabakkonsum assoziiert und weist eine schlechte Prognose auf.1 Als Standarderstlinientherapie des ausgedehnten SCLC gilt seit vielen Jahren die Kombination aus Cisplatin/Carboplatin und Etoposid.2 Das mediane Gesamtüberleben (OS) der Patienten ist mit 8 bis 12 Monaten jedoch nach wie vor kurz.3, 4 In den vergangenen Jahren wurden daher unzählige Versuche unternommen, die Therapie zu verbessern. Jedoch verlängerte keine der untersuchten Optionen das Überleben.
Hoffnungsträger Immuntherapie
Das SCLC gehört zu den Tumorentitäten mit einer hohen Mutationslast.5 Wie Melanome und nichtkleinzellige Lungenkarzinome, die ebenfalls eine hohe Anzahl an somatischen Mutationen aufweisen, sollte das SCLC daher gut auf eine Immuntherapie ansprechen. Zudem zeigte diese Form der Behandlung auch bei anderen tabakassoziierten Tumoren eine gute Wirkung. In der Studie CheckMate-032 wurde eine nichtrandomisierte Kohorte bereits vorbehandelter SCLC-Patienten (>1 Vortherapie) mit Nivolumab (+/–Ipilimumab) behandelt.6,7 Nach 12 und 24 Monaten zeigten sich sowohl unter der Monotherapie als auch der Kombination hohe OS-Raten. Als Drittlinientherapie eingesetzt, führte sowohl eine Monotherapie mit Nivolumab als auch eine mit Pembrolizumab zu einem anhaltenden Ansprechen.8,9 Beide Substanzen erhielten daraufhin auch die entsprechende FDA-Zulassung. Allerdings liegt der Anteil an Patienten mit einem SCLC, welche die dritte Therapielinie erreichen, lediglich bei 22%.3 Daher wurde nach weiteren Möglichkeiten zur Verbesserung der Behandlung gesucht. Nivolumab als Zweitlinientherapie sowie Nivolumab plus Ipilimumab als Erhaltungstherapie nach Ansprechen auf eine Erstlinienchemotherapie führten nicht zum gewünschten Erfolg.10, 11
Erfolg in der ersten Linie
Den Durchbruch in der ersten Linie schaffte schließlich die Kombination aus Atezolizumab und Chemotherapie (Carboplatin + Etoposid), untersucht in der Studie IMpower133.12 Hier zeigten sich gegenüber der alleinigen Chemotherapie ein signifikant verlängertes progressionsfreies Überleben (PFS) und OS. Nach einem medianen Follow-up von 22,9 Monaten betrug die 18-Monats-OS-Rate unter Atezolizumab/Carboplatin/Etoposid 34% gegenüber 21% im Vergleichsarm.13 Ebenfalls ein signifikant längeres OS zeigte in der CASPIAN-Studie die Erstlinientherapie mit Durvalumab plus Etoposid und Carbo- oder Cisplatin im Vergleich zur alleinigen Chemotherapie (Abb. 1).14Die 18-Monats-OS-Rate betrug hier 34% (vs. 25% im Vergleichsarm). Die Zugabe der Antikörper hat dabei in beiden Studien zu keiner Zunahme an Toxizitäten im Vergleich zur Chemotherapie geführt. Mittlerweile gilt die Chemoimmuntherapie mit Atezolizumab bzw. Durvalumab als neue Standarderstlinientherapie bei Patienten mit einem fortgeschrittenen SCLC. Trotz alledem gibt es weiterhin Raum für Verbesserungen. Dazu werden jedoch Biomarker benötigt, mit deren Hilfe sich diejenigen Patienten identifizieren lassen, die am meisten von einer Chemoimmuntherapie profitieren könnten. Bisherige Untersuchungen haben sich jedoch (noch) als erfolglos erwiesen.
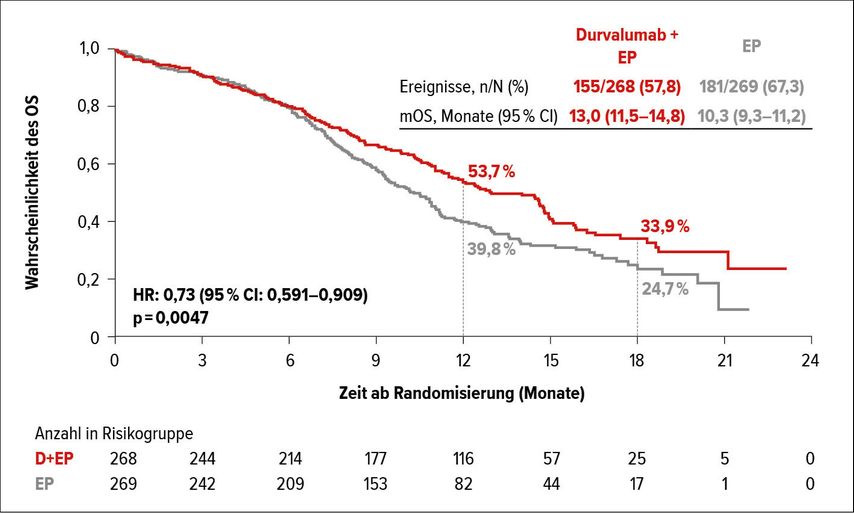
Abb. 1: Verlängertes Gesamtüberleben (OS) von SCLC-Patienten durch Erstlinientherapie mit Kombination aus Durvalumab und Etoposid (EP). Modifiziert nach Paz-Ares et al., 2019; WCLC-Meeting
Weitere mögliche Optionen
Dr. Liu präsentierte zudem einige Daten zu weiteren möglichen Therapieoptionen beim SCLC. Eine davon stellt Lurbinectedin dar. Als Zweitlinientherapie eingesetzt hat der Transkriptionshemmer marinen Ursprungs in einer einarmigen Phase-II-Studie zu einer Ansprechrate von 35,2% geführt.15 Auch platinresistente Patienten sprachen an (Ansprechrate 22%). Eine Phase-III-Studie (ATLANTIS) vergleicht nun die Zweitlinientherapie mit Lurbinectedin/Doxorubicin mit einer Chemotherapie (Topotecan oder Cyclophosphamid, Doxorubicin und Vincristin).16
Personalisierung der Therapiedauer
Dr. Joshua Bauml, Philadelphia/USA, sprach in seinem Referat zur personalisierten Immuntherapie unter anderem darüber, wie lange bei Patienten mit nichtkleinzelligen Lungenkarzinomen (NSCLC) die Behandlung fortgeführt werden soll. In Studien wie z.B. KEYNOTE 189, KEYNOTE 407 und KEYNOTE 024 wurde die Gabe von Pembrolizumab nach zwei Jahren gestoppt. Der Nutzen und auch die Risiken einer längeren Behandlung sind bisher nicht klar. Gerade in Zeiten von Covid-19 kann es sich aber als relevant erweisen, wie oft ein Patient für seine Therapie ins Spital kommen muss. Damit ist das Risiko für die Patienten nicht mehr nur durch die eingesetzte Therapie definiert.
Die einzige prospektive Studie, die bisher versucht hat, direkt die Frage der Therapiedauer zu beantworten, ist CheckMate-153.17 Die meisten der bisher zu Nivolumab verfügbaren Daten basieren auf seinem Einsatz bis zur Progression oder bis zum Abbruch der Therapie aufgrund von Toxizitäten. In CheckMate-153 wurden Patienten mit einem fortgeschrittenen/metastasierten NSCLC und mindestens einer Vortherapie nach einer einjährigen Behandlung mit Nivolumab (3mg/kg i.v. alle 2 Wochen) entweder zur Fortsetzung der Behandlung oder zu ihrem Stopp randomisiert. Eine Wiederaufnahme der Behandlung war erlaubt, falls die Erkrankung voranschritt.
Wie es sich zeigte, wiesen Patienten mit weitergeführter Nivolumab-Behandlung ein signifikant längeres PFS auf als Patienten, bei denen nach einem Jahr gestoppt wurde (HR: 0,42; 95% CI: 0,25–0,71; Abb.2). Dabei spielte es keine Rolle, ob die Patienten ein komplettes oder partielles Ansprechen oder eine stabile Erkrankung aufwiesen. Es muss allerdings berücksichtigt werden, dass die Wirksamkeit zu den sekundären Endpunkten von CheckMate-153 gehörte. Hinsichtlich des Gesamtüberlebens zeigte sich im Arm mit der kontinuierlichen Behandlung ein Trend zu einem besseren Abschneiden (HR: 0,63; 95% CI: 0,33–1,20). Die Rate an therapieassoziierten Nebenwirkungen war unter kontinuierlicher Behandlung leicht erhöht. Die Untersuchung zeigte zudem, dass eine erneute Therapie mit Nivolumab nur bei einem kleinen Teil der Patienten mit Krankheitsprogression nach dem Stoppen der Behandlung wieder zu einem Ansprechen führte.
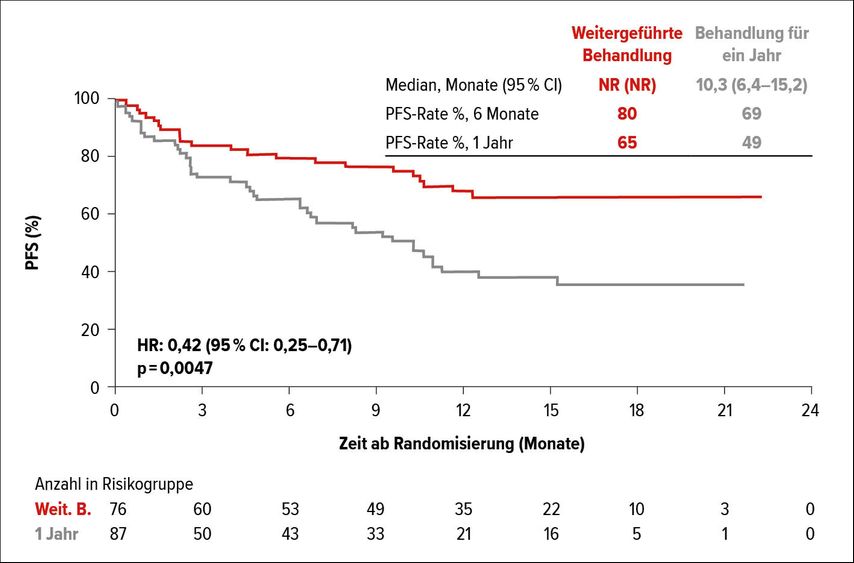
Abb. 2: Verlängertes PFS bei NSCLC-Patienten mit weitergeführter Nivolumab-Behandlung in der CheckMate-153-Studie. Modifiziert nach Spigel et al. 2017; ESMO-Meeting
Es scheint damit, dass gewisse Patienten von einer zweijährigen Immuntherapie profitieren, während diese für andere keine Vorteile bringt. Möglicherweise sind in dieser Hinsicht aber Unterschiede in der Biologie des Tumors – die bisher noch nicht bekannt sind – von größerer Relevanz als die reine Dauer der Therapie. Um den veränderten Anforderungen in Zeiten von Covid-19 gerecht zu werden, ließen sich nach einer zweijährigen Immuntherapie mehrere Optionen in Betracht ziehen: die Therapie ganz zu stoppen oder die Behandlungsintervalle zu vergrößern.
Radiotherapie während der Corona-Pandemie
Dr. André Durham, Genf, widmete sich der Frage, wie hinsichtlich der Durchführung einer Radiotherapie bei Lungentumoren während der Corona-Pandemie vorgegangen werden soll. Die Anleitung dazu liefern die vor Kurzem publizierten praktischen Empfehlungen der ESTRO-ASTRO, die sechs häufig anzutreffende klinische Situationen sowie zwei Pandemie-Szenarien (Risikoreduktion zu Beginn der Pandemie und Ressourcenknappheit in späterer Phase) berücksichtigen.18 Für die frühe Pandemiephase sprechen sich die Empfehlungen gegen eine Verschiebung der Radiotherapie in der Palliativsituation sowie bei Patienten mit einem NSCLC im Stadium III und bei Patienten mit LS („limited stage“) SCLC aus. Sie befürworten jedoch die Verschiebung der postoperativen Radiotherapie beim NSCLC (PORT NSCLC) sowie das Verschieben einer prophylaktischen Ganzhirnbestrahlung bei SCLC-Patienten (PCI SCLC). Bei Patienten, die vor dem Beginn einer Radiotherapie Covid-19 positiv getestet werden, sehen die Empfehlungen vor, den Beginn der Behandlung so lange zu verschieben, bis die Patienten asymptomatisch sind oder das Testresultat negativ ist. Wird während einer laufenden Radiotherapie eine Covid-19-Erkrankung diagnostiziert, so wird im Falle einer PORT NSCLC, einer PCI SCLC sowie in der Palliativsituation eine Unterbrechung der Radiotherapie empfohlen. Werden in einer späteren Phase der Pandemie allenfalls die Ressourcen knapp, so liefern die Empfehlungen auch Angaben zur maximalen Hypofraktionierung in den verschiedenen klinischen Situationen sowie zur Priorisierung der Patienten gegenüber allen anderen Tumorpatienten.
Bericht:
Dr. Therese Schwender
Literatur:
1 Govindan R et al.: Changing epidemiology of small-cell lung cancer in the united states over the last 30 years: analysis of the surveillance, epidemiologic, and end results database. J Clin Oncol 2006; 24(28): 4539-44 2 Früh M et al.: Small-cell lung cancer (SCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24(Supplement 6): vi99-105 3 Steffens CC et al.: Treatment and outcome of 432 patients with extensive-stage small cell lung cancer in first, second and third line – Results from the prospective German TLK cohort study. Lung Cancer 2019; 130: 216-25 4 Cramer-van der Welle CM et al.: Real-world treatment patterns and outcomes of patients with extensive disease small cell lung cancer. Eur J Cancer Care 2020;00:e13250 5 Alexandrov LB et al.: Signatures of mutational processes in human cancer. Nature 2013; 500: 415-21 6 Antonia SJ et al.: Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer (CheckMate 032): a multicentre, open-label, phase 1/2 trial. Lancet Oncol 2016; 17(7): 883-95 7 Hellmann MD et al.: Nivolumab ± ipilimumab in advanced small-cell lung cancer: First report of a randomized expansion cohort from CheckMate 032. J Clin Oncol 2017; 35(15 suppl): 8503
8 Ready N et al.: Third-line nivolumab monotherapy in recurrent SCLC: CheckMate 032. J Thorac Oncol 2018; 14(2): 237-44 9 Chung HC et al.: Pembrolizumab after two or more lines of previous therapy in patients with recurrent or metastatic SCLC: Results from the KEYNOTE-028 and KEYNOTE-158 studies. J Thorac Oncol 2020; 15(4): 618-27 10Reck M et al.: Efficacy and safety of nivolumab monotherapy versus chemotherapy in recurrent small cell lung cancer:Results from CheckMate 331. ESMO Meeting 2018; LBA5 11 Owonikoko TK et al.: Nivolumab plus Ipilimumab, nivo, or placebo as maintenance therapy in patients with extensive disease small cell lung cancer after first-line platinum-based chemotherapy: Results from the double-blind, randomized phase III CheckMate 451 study. ELCC Meeting 2019; LBA1_PR 12 Horn L et al.: First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379(23): 2220-29 13 Reck M et al.: IMpower133: updated overall survival analysis of first-line atezolizumab + carboplatin + etoposide in extensive-stage SCLC. Ann Oncol 2019; 30(suppl_5): v710-17 14 Paz-Ares L et al.: Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): A randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394(10212): 1929-39 15 Trigo J et al.: Lurbinectedin as second-line treatment for patients with small-cell lung cancer: a single-arm, open-label, phase 2 basket trial. Lancet Oncol 2020; 21(5): 645-54 16 Farago AF et al.: ATLANTIS: Aphase III study of lurbinectedin/doxorubicin versus topotecan or cyclophosphamide/doxorubicin/vincristine in patients with small-cell lung cancer who have failed one prior platinum-containing line. Future Oncol 2019; 15(3): 231-9 17 Spigel DR et al.: CheckMate153: randomized results of continuous vs 1-year fixed-duration nivolumab in patients with advanced non-small cell lung cancer. Ann Oncol 2017; 28(Suppl 5): Abstract 1297O 18 Guckenberger M et al.: Practice recommendations for lung cancer radiotherapy During the COVID-19 pandemic: An ESTRO-ASTRO consensus statement. Radiother Oncol 2020; 146 223-9
Das könnte Sie auch interessieren:
Candida auris: die dunkle Bedrohung?
Neu auftretende Krankheitserreger stellen eine Bedrohung für unsere Gesellschaft dar, die vor dem Hintergrund von Klimaveränderungen, zunehmender weltweiter Mobilität und anderen ...
Update Reisemedizin
Was gibt es Neues zur Malariachemoprophylaxe, wie lauten die Empfehlungen für eine Impfung gegen Dengue und wie schützt man sich bei Reisen in Risikoländern richtig gegen Polio? Wir ...
Bruxismus: harmloses Phänomen oder Ursache für schmerzhafte Verspannungen?
«Krisenmodus» war das Wort des Jahres 2023. Ein Begriff, der sich in erster Linie auf das Weltgeschehen bezog, aber auch auf politische Entscheidungen im eigenen Land und für viele auch ...