_FatCamera.jpg)
Die Highlights vom SABCS 2019 zu Immuntherapie und Radioonkologie
Klinik für Radioonkologie<br>Medizinische Universität Wien<br>E-Mail: daniela.kauer-dorner@meduniwien.ac.at
Beim vergangenen San Antonio Breast Cancer Symposium (SABCS) wurden wieder weitere Daten zur Immuntherapie, vor allem beim tripelnegativen Mammakarzinom (TNBC), vorgestellt und diskutiert, die zumindest teilweise in naher Zukunft als praxisrelevant zu werten sind. Auch die Strahlentherapie präsentierte durchaus klinisch relevante Daten, die ich in diesem Artikel vorstellen möchte.
GeparX-Studie – Denosumab zeigt keinen zusätzlichen Effekt auf die pCR-Rate
Bei dieser multizentrischen, prospektiven und offenen Phase-II-Studie wurde anhand eines 2x2-faktoriellen Studiendesigns bei 780 Hochrisikopatientinnen einerseits die Wirkung von Denosumab (Anti-RANKL-Antikörper) zu einer neoadjuvanten, anthrazyklin-/taxanhaltigen Chemotherapie auf die Rate an pathologisch kompletten Remissionen (pCR; ypT0 ypN0), andererseits die unterschiedlichen Dosierungsschemata der neoadjuvanten Chemotherapie (q1w vs. d1, d8 q3w) untersucht. Es zeigt sich, dass die Hinzunahme von Denosumab zu einer anthrazyklin-/taxanbasierten Chemotherapie die pCR-Rate in der Neoadjuvanz nicht steigern konnte (41,0% mit Denosumab vs. 42,8% ohne Denosumab; p=0,582). Die wöchentliche Gabe von nab-Paclitaxel führte jedoch im gesamten Patientinnenkollektiv zu einer signifikant höheren pCR-Rate im Vergleich zur nab-Paclitaxel-Gabe nach dem Schema d1,d8 q3w (45% vs. 39%). Bei der Gruppe von Patientinnen mit TNBC konnte sogar eine signifikante Steigerung der pCR-Rate um 10,4% von 50% nach dem Schema d1, d8 q3w auf 60,4% bei wöchentlicher Gabe erzielt werden. Die wöchentliche Gabe von nab-Paclitaxel führte jedoch zu einer höheren Rate an schwerwiegenden unerwünschten Ereignissen (SAEs) und damit verbundenen Therapieunterbrechungen aufgrund der Nebenwirkungen.
Als Fazit der Autoren zu dieser Studie zeigt aktuell im Gesamtkollektiv die Zugabe von Denosumab in der Neoadjuvanz keinen zusätzlichen Effekt auf die pCR-Rate. Der Einsatz von wöchentlichem nab-Paclitaxel in der neoadjuvanten Situation beim TNBC ist durchaus als klinikrelevant zu werten, muss aber weiter geprüft und bei gegebenem Toxizitätsprofil individuell abgewogen werden.
Keynote-522-Studie – die Hinzunahme von Pembrolizumab kann pCR-Raten signifikant steigern
In der placebokontrollierten Phase-III-Studie Keynote-522 (NCT03036488) wurden Patientinnen mit frühem TNBC entweder in einen optimalen Standardarm mit neoadjuvanter Gabe von Carboplatin plus Paclitaxel gefolgt von einem Anthrazyklin (Doxorubicin oder Epirubicin und Cyclophosphamid) in Kombination mit dem PD-1-Inhibitor Pembrolizumab (200mg q3w) oder in den Placeboarm mit Chemotherapie ohne PD-1-Inhibitor 2:1 randomisiert. Nach der Operation erhielten die Patientinnen in der Adjuvanz Pembrolizumab 200mg q3w oder Placebo für ein weiteres halbes Jahr. Insgesamt wurden 784 Patientinnen in den Pembrolizumab-Arm und weitere 390 Patientinnen in den Placeboarm randomisiert. Schon beim ESMO-Kongress 2019 wurde eine signifikante Steigerung der pCR-Rate um 13,6% (p=0,00055) durch die Kombination aus Pembrolizumab + Chemotherapie gegenüber Placebo + Chemotherapie gezeigt. Je höher die mit dem CPS („combined positive score“) berechnete Expression von PD-L1 („programmed celldeathligand 1) war, desto höher war das Ansprechen auf Pembrolizumab. Überraschend war dennoch, dass dieser relevante Effekt sowohl bei der PD-L1-positiven wie auch bei der PD-L1-negativen Patientinnengruppe nachgewiesen wurde (Abb. 1). Bei der Präsentation der Subgruppenergebnisse zeigte sich, dass vor allem Patientinnen mit positivem Lymphknotenstatus von der Zugabe des PD-L-Inhibitors profitieren und eine signifikante Steigerung der pCR-Rate um 20% zeigten (44,1% vs. 64,8%). Neben den Vorteilen des Inhibitors konnte im Zuge der Subgruppenanalyse auch der Vorteil einer wöchentlichen Gabe von Carboplatin zur dreiwöchentlichen Gabe demonstriert werden, mit einem pCR-Unterschied von 18,4 versus 7,7%.
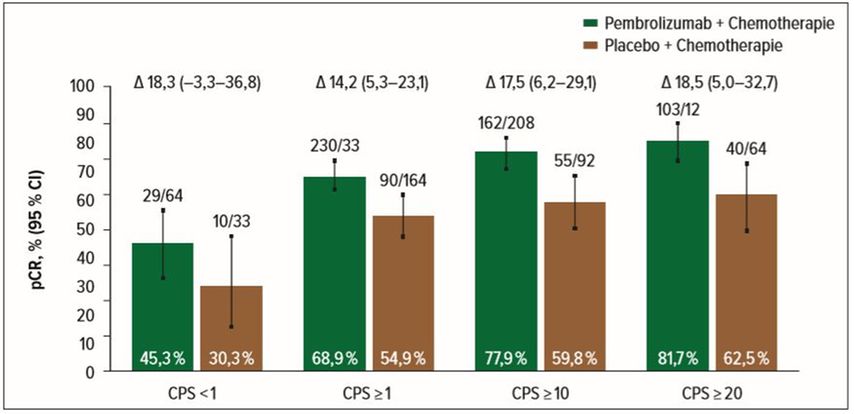
Abb. 1: Rate an pathologisch kompletten Remissionen (pCR) nach PD-L1-Expressionslevel: Es zeigt sich eine deutliche Verbesserung der pCR-Rate durch Zugabe von Pembrolizumab, unabhängig von der PD-L1-Expression (modifiziert nach Schmid P et al., SABCS 2019, Abstr. #GS3-03)
Eine erste Analyse des ereignisfreien Überlebens nach 18 Monaten und einem medianen Follow-up von 15,5 Monaten zeigte ein Auseinanderdriften der Kurven von 91,3% versus 85,3% zugunsten des experimentellen Arms (HR: <0,4; p=0,000051). Ergebnisse nach eine längeren Nachbeobachtung sind vorerst natürlich abzuwarten. Das Spektrum der bekannten immunvermittelten Nebenwirkungen betreffend Schilddrüse, Lunge, Haut und Nebennieren gestaltete sich wie aus bereits erfolgten Anwendungen bekannt.
Als Fazit zu dieser Studie kann zusammengefasst werden, dass durch die Hinzunahme von Pembrolizumab beim TNBC die pCR-Rate signifikant gesteigert werden kann. Das wird sich voraussichtlich auch nach entsprechender Nachbeobachtung auf das Gesamtüberleben niederschlagen. Die Nebenwirkungen müssen frühzeitig erkannt und behandelt werden.
NeoTrip-Studie – keine Verbesserung der pCR-Rate durch Atezolizumab + neoadjuvante Chemotherapie
In dieser Phase-III-Studie, präsentiert von Gianni L. et al., wurde Atezolizumab (PD-L1-Checkpoint-Inhibitor) bei Patientinnen mit frühem TNBC und hohem Rezidivrisiko, aber auch bei Patientinnen mit lokal fortgeschrittenem TNBC neoadjuvant mit nab-Paclitaxel/Carboplatin kombiniert und mit der alleinigen Chemotherapie verglichen. Adjuvant erhielten die Patientinnen jeweils eine anthrazyklinhaltige Kombinationschemotherapie (AC, EC oder FEC). Die Hinzunahme des Anti-PD-L1-Antikörpers Atezolizumab zu einer neoadjuvanten Chemotherapie verbesserte die Rate an pathologischen Komplettremissionen im Vergleich zur alleinigen Chemotherapie jedoch nicht. (43,5% der Patientinnen im Kombinationsarm vs. 40,8% im Chemotherapie-Arm; nicht signifikant). In einer Subgruppenanalyse von Patientinnen mit PD-L1-positiven Tumoren zeigte sich in der Gruppe mit Atezolizumab + Chemotherapie eine pCR-Rate von 51,9% vs. 48,0% mit alleiniger Chemotherapie. Auch diese leichte Steigerung war nicht signifikant. Als Kritikpunkte wurden unter anderem das Fehlen einer standardisierten anthrazyklinhaltigen Chemotherapie in der Neoadjuvanz und das sehr heterogene Patientinnenkollektiv mit 49% lokal fortgeschrittenem TNBC angeführt.
Als Fazit schlussfolgerten die Autoren, dass zwar die Hinzugabe von Atezolizumab zur neoadjuvanten Chemotherapie keinen Benefit auf die pCR zeigen konnte, eine eventuelle positive Auswirkung der Kombinationstherapie aber erst im Langzeitverlauf beurteilt werden kann.
Der FLORENCE-Trial – neue Langzeitdaten zur Teilbrustbestrahlung
Als Höhepunkt zur Radioonkologie präsentierten Meattini et al. die 10-Jahres-Daten zum FLORENCE-Trial, einer randomisierten Phase-III-Studie zur beschleunigten (akzelerierten) Teilbrustbestrahlung (APBI) mittels intensitätsmodulierter Radiotherapie (IMRT). Eingeschlossen wurden 520 postoperative Patientinnen über 40 Jahre mit einem Mammakarzinom im Frühstadium und niedrigem Rückfallrisiko. 260 (APBI-Arm) von ihnen erhielten eine Teilbrustbestrahlung des ehemaligen Tumorbetts inklusive Sicherheitsabstand über 5 Fraktionen bis zu einer Gesamtdosis von 30Gy innerhalb einer Woche mittels externer IMRT. Bei den anderen 260 Patientinnen (WBI-Arm) wurde konventionell die gesamte Brust über 25 Fraktionen täglich bis zu einer Gesamtdosis von 50Gy bestrahlt und anschließend ein Boost von 10Gy im Bereich des Tumorbetts über 5 Tage appliziert. Das Langzeitergebnis hinsichtlich der lokalen Kontrolle war zwischen den beiden Therapiearmen nicht signifikant unterschiedlich. Ein Wiederauftreten des Tumors in der gleichen Brust trat bei 3,74% in der Teilbrustbestrahlungsgruppe auf und bei 2,5% in der Vergleichsgruppe (p=0,58). Das Gesamtüberleben nach 10 Jahren war ebenfalls sehr ähnlich zwischen den beiden Gruppen: 92,7% im APBI-Arm und 93,3% im WBI-Arm. Das Brustkrebs-spezifische Überleben betrug 97,6% nach APBI und 97,5% nach WBI. Die Rate des metastasenfreien Überlebens war in beiden Armen 96,9%. Hinsichtlich der Hauttoxizität zeigten Patientinnen des APBI-Arms sowohl bei akuten Nebenwirkungen (21,1% vs. 66,5%) als auch chronischen Nebenwirkungen (4,5% vs. 30%) signifikant geringeres Auftreten.
Als Fazit des Autors stellt die APBI mittels IMRT eine weitere nicht invasive Möglichkeit der Teilbrustbestrahlung dar, bei guter Verträglichkeit, geringem Nebenwirkungsprofil und bei entsprechender Patientinnenselektionierung mit exzellenter Krankheitskontrolle.
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Candida auris: die dunkle Bedrohung?
Neu auftretende Krankheitserreger stellen eine Bedrohung für unsere Gesellschaft dar, die vor dem Hintergrund von Klimaveränderungen, zunehmender weltweiter Mobilität und anderen ...
Update Reisemedizin
Was gibt es Neues zur Malariachemoprophylaxe, wie lauten die Empfehlungen für eine Impfung gegen Dengue und wie schützt man sich bei Reisen in Risikoländern richtig gegen Polio? Wir ...
Bruxismus: harmloses Phänomen oder Ursache für schmerzhafte Verspannungen?
«Krisenmodus» war das Wort des Jahres 2023. Ein Begriff, der sich in erster Linie auf das Weltgeschehen bezog, aber auch auf politische Entscheidungen im eigenen Land und für viele auch ...