Aktuelle Trends der diagnostischen Endosonografie bei Pankreaserkrankungen
Autor:
Dr. Christian Jenssen
Klinik für Innere Medizin
Krankenhaus Märkisch-Oderland
Institut für klinischen Ultraschall
Medizinische Hochschule Brandenburg
E-Mail: c.jenssen@khmol.de
Der in den 1990er-Jahren eingeführte endoskopische Ultraschall (EUS) in Form eines Echoendoskops mit Mikrokonvexschallkopf und Arbeitskanal führte insbesondere in der viszeralonkologischen Diagnostik zu einem Paradigmenwechsel. Der Weg durch die Wand gastrointestinaler Hohlorgane ermöglicht seither minimalinvasive Drainagen. Seit wenigen Jahren hält die künstliche Intelligenz (KI) Einzug in die endoskopische Diagnostik, ohne für den diagnostischen EUS bisher etabliert zu sein. Die Unterstützung der EUS-Diagnostik durch KI und das „genomische Profiling“ anhand EUS-gestützter Feinnadelbioptate sind aktuelle Entwicklungen des diagnostischen EUS, die perspektivisch insbesondere bei Pankreastumoren eine deutliche Verbesserung der prätherapeutischen Charakterisierung und Therapieplanung ermöglichen werden.
Keypoints
-
Der endoskopische Ultraschall (EUS) hat sich in den letzten Jahren zu einer „Königsdisziplin“ der gastrointestinalen Endoskopie entwickelt.
-
Künstliche Intelligenz hat das Potenzial, für bestimmte Anwendungen die diagnostische Genauigkeit des EUS zu verbessern, einen wertvollen Beitrag zur Standardisierung diagnostischer Kriterien und für die Ausbildung der Untersucher zu leisten.
-
Hinsichtlich der aktuellen zurückhaltenden Empfehlungen wird bei der laufenden Überarbeitung der S3-Leitlinie eine Neubewertung des Stellenwerts der endosonografischen Feinnadelpunktion beim potenziell resektablen Adenokarzinom des Pankreas erwartet.
-
Untersuchungen zum Stellenwert von endosonografischen Feinnadelbiopsien für die Prädiktion des Ansprechens von potenziell resektablen Pankreaskarzinomen auf eine neoadjuvante Therapie sorgen aktuell für großes Interesse.
Einleitung
Der endoskopische Ultraschall (EUS) ist keine neue Technik mehr. Es ist 43 Jahre her, dass in den USA, Deutschland und Japan erste Versuche unternommen wurden, flexible Endoskope mit miniaturisierten Ultraschallköpfen auszustatten. Ausgangspunkt war die Erkenntnis einer Studie von 1977, dass der transabdominelle Ultraschall etwa 25% aller Pankreaserkrankungen übersah.1 Erste experimentelle Ergebnisse mit der neuen Technologie wurden 1980 veröffentlicht.2,3 Bereits zwölf Jahre später ermöglichten es Echoendoskope mit einem Mikrokonvexschallkopf und einem Arbeitskanal, transmurale Gewebeentnahmen aus dem Pankreas und anderen schwer zugänglichen anatomischen Strukturen und Organen durchzuführen.4 Dies führte zu einem Paradigmenwechsel insbesondere in der viszeralonkologischen Diagnostik, ermutigte aber gleichzeitig auch zu einem Tabubruch in der gastrointestinalen Endoskopie: Der Weg durch die Wand gastrointestinaler Hohlorgane ermöglichte minimalinvasive Drainagen, zunächst von Pankreaspseudozysten, später von Abszessen und pankreatitisassoziierten Nekrosen, schließlich auch des gestauten Pankreas- oder Gallengangsystems, wenn der retrograde transpapilläre Zugang (ERCP) nicht möglich war. Auch die Therapie von gastrointestinalen Hohlorganobstruktionen durch endosonografisch gestützte Enteroanastomosen hat sich inzwischen als elegante Alternative zum luminalen endoskopischen Stenting und zu chirurgischen Bypässen etablieren können.5
Immer mehr hat sich der EUS in den letzten Jahren zu einer „Königsdisziplin“ der gastrointestinalen Endoskopie entwickelt. In einer Sitzung des virtuellen 50. Jahreskongresses der Deutschen Gesellschaft für Endoskopie und bildgebende Verfahren (DGE-BV) (8.–10. April 2021) wurden die Top-Publikationen der gastrointestinalen Endoskopie aus den letzten zwölf Monaten diskutiert. Daran anknüpfend berichtet diese Übersicht über zwei aktuelle, potenziell zukunftsweisende Trends in der endosonografischen Diagnostik von Pankreaserkrankungen.
EUS und künstliche Intelligenz
Die Nutzung künstlicher Intelligenz (KI) hat in den letzten 2–3 Jahren zunehmend Einzug in die endoskopische Diagnostik gehalten, insbesondere als Unterstützung der Detektion und Charakterisierung von Kolonpolypen, aber auch für die Diagnostik des Barrett-Ösophagus, die Detektion des Magenfrühkarzinoms und für die Kapselendoskopie.6 In der Endosonografie wurde schon seit etwa 20 Jahren immer wieder versucht, neuronale Netzwerkanalysen insbesondere zur Charakterisierung von Pankreasraumforderungen und insbesondere in der schwierigen Abgrenzung zwischen dem duktalen Adenokarzinom des Pankreas (PDAC) und fokalen, tumorartigen entzündlichen Veränderungen zu nutzen.7–10 Bisher haben sich diese Versuche nicht wirklich durchsetzen können. Gründe dafür sind Limitationen der neuronalen Netzwerke und der verfügbaren Rechnerleistung, aber auch die fehlende Verfügbarkeit größerer Bibliotheken prospektiv histologisch validierter EUS-Bilder und -Filme zum Training der KI-Systeme. Darüber hinaus sind bisher die KI-Lösungen für EUS nicht standardisiert, nicht kommerziell verfügbar und vor allem nicht in die Ultraschallsysteme intergriert.
Mehrere Studien der letzten zwei Jahre haben aber aufhorchen lassen und zeigen das große Zukunftspotenzial von KI-Anwendungen für den EUS.
KI für die endosonografische Diagnose der Autoimmunpankreatitis
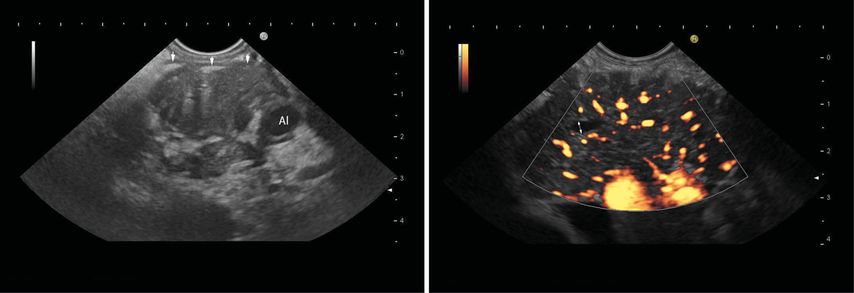
Die Diagnose der Autoimmunpankreatitis (AIP) insbesondere in ihrer Abgrenzung zur chronischen Pankreatitis und in der Differenzierung fokaler und segmentaler Formen zum PDAC bleibt anspruchsvoll, obwohl typische diagnostische EUS-Kriterien etabliert worden sind (Abb.1).11,12
Abb. 1: Typische endosonografische Befunde bei Autoimmunpankreatitis: A) Das Organ (hier Pankreaskorpus mit Leitstruktur Arteria lienalis; Al) ist aufgetrieben, echoarm-inhomogen ohne Gangerweiterung mit einem zarten echoarmen Halo (Pfeile). B) Bei einer anderen Patientin zeigt der kontrastverstärkte Farb-Doppler-EUS ein echoarmes Pankreas mit betontem Gang (Doppelpfeil), irregulärer Kontur und deutlich vermehrter Vaskularisation
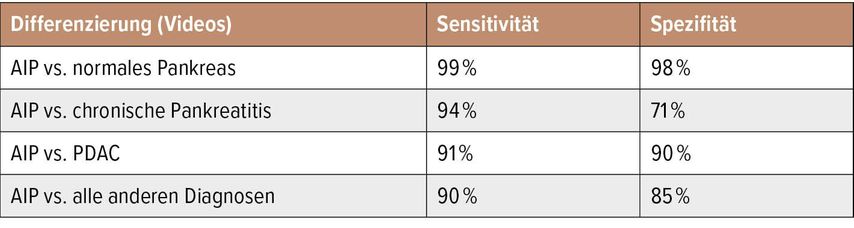
Eine Forschergruppe aus der Mayo-Klinik in Rochester (einer der Geburtsstätten des EUS) hat kürzlich Daten zur KI-gestützten EUS-Diagnose der AIP vorgelegt, die sich auf eine sehr große Kohorte mit histologisch verifizierten Pankreaserkrankungen stützt.13 Eingeschlossen wurden retrospektiv 583 Patienten, davon 146 mit AIP, 292 mit PDAC, 72 mit chronischer Pankreatitis und 73 mit Pankreas-Normalbefund. Ein komplexes „faltendes“ neuronales Netzwerk („convolutional neural network“, CNN) wurde mit insgesamt mehr als 1 Million endosonografischer Bilddateien „gefüttert“, für die eine histologisch gesicherte Diagnose vorlag. Die Daten wurden einer Trainings-, Validierungs- und Testgruppe zugeteilt. Mit den Gesamtdaten der Trainings- und Validierungsgruppe wurde das CNN in zwei Stufen trainiert und dann verwendet, um allen Standbildern der Testgruppe und den Videodateien Klassenwahrscheinlichkeitswerte zuzuordnen. An für jede von vier Wahrscheinlichkeitsklassen für die inkludierten Diagnosegruppen repräsentativen Bildern erfolgte dann eine „Okklusions-Heatmap-Analyse“, um den diagnostischen Vorhersagewert einzelner Bildregionen in „kalte“, d.h. positiv prädiktive, und „warme“, d.h. negativ prädiktive, zu klassifizieren. In der Analyse erwiesen sich Videodateien als besser geeignet für die Diagnose durch das CNN als Standbilder. Erwartungsgemäß konnte das CNN mit sehr hoher Genauigkeit zwischen Videodateien von Patienten mit gesicherter AIP und solchen mit Pankreas-Normalbefund differenzieren. Sehr gut gelang mit einer Sensitivität von 91% und einer Spezifität von 90% aber auch die Differenzierung gegenüber Videodateien von Patienten mit PDAC. Das CNN verkannte jedoch eine substanzielle Anzahl von Fällen mit chronischer Pankreatitis als AIP (Spezifität 71%) (Tab. 1).
Tab. 1: Diagnostische Genauigkeit der Differenzierung von Videodateien von Patienten mit gesicherter Autoimmunpankreatitis (AIP) gegenüber Videodateien mit Pankreasnormalbefund, chronischer Pankreatitis, duktalem Adenokarzinom des Pankreas (PDAC) und allen Nicht-AIP-Befunden durch ein gefaltetes neuronales Netzwerk in der Studie von Marya et al. 202013
In der Studie wurde an einem Teilkollektiv auch die diagnostische Genauigkeit des CNN zur Differenzierung zwischen AIP und anderen Pankreasdiagnosen mit der von sieben sehr erfahrenen Endosonografikern verglichen. Die Diagnosen der erfahrenen Endosonografiker erwiesen sich als ähnlich spezifisch, aber weniger sensitiv als die des CNN, d.h., die Endosonografiker übersahen deutlich häufiger als das CNN die Diagnose einer AIP (Tab.2). Insgesamt war das CNN den Endosonografikern in der diagnostischen Genauigkeit signifikant überlegen (75,6% vs. 61,6%, p=0,026). Eine mögliche Erklärung dafür liefert die Heatmap-Analyse. Hier erwies sich nämlich ein Kriterium als besonders spezifisch für die Diagnose einer AIP, das in den bisherigen Studien zur endosonografischen Diagnose der AIP nicht als relevant erkannt worden war: Das CNN fand hyperechogene Grenzflächenechos zwischen Pankreashauptgang und Gefäßen sowie Pankreasparenchym in 53% der Fälle mit AIP, jedoch in keinem einzigen Fall mit einer alternativen Diagnose. Umgekehrt identifizierte das CNN in 57% der Fälle mit PDAC eine dorsale Schallverstärkung durch den dilatierten Pankreashauptgang oder Gefäße, aber in keinem Fall mit einer AIP.13
Weitere Anwendungen und Perspektiven der KI in der Endosonografie
Ähnlich überzeugende Ergebnisse für die diagnostische Kapazität von CNN wurden in den letzten beiden Jahren auch für die ohne histologischen Befund schwierige Differenzierung gastrointestinaler Stromatumoren (GIST) von anderen echoarmen mesenchymalen Tumoren der Magenwand (Leiomyom und Schwannom)14–17 sowie für die endosonografische Charakterisierung von soliden fokalen Leberläsionen18 publiziert.
Zusammenfassend bleibt daher festzuhalten, dass KI das Potenzial hat, für bestimmte Anwendungen die diagnostische Genauigkeit des EUS zu verbessern. Schon jetzt, das zeigen die Daten insbesondere von Marya et al.,13,18 kann man von KI lernen, indem in Heatmap-Analysen identifizierte Charakteristika Eingang in Bildanalyse und Diagnose finden. Dennoch ist der Weg bis zur Integration von KI in den klinischen EUS-Alltag noch weit. Die bisher publizierten Ergebnisse betreffen ausschließlich die B-Bild-Diagnostik, nicht aber den multiparametrischen EUS unter Einbeziehung von Farb-Doppler-Sonografie, Elastografie und Kontrastverstärkung, die insbesondere auch für die Charakterisierung fokaler Pankreasläsionen und die Diagnose der AIP inzwischen etabliert sind.12,19–21 Darüber hinaus handelt es sich bisher noch um eine mehrschrittige aufwendige computergestützte Analyse nach Abschluss der eigentlichen Untersuchung. Daher wird die Stunde der KI für den EUS erst schlagen, wenn ein trainiertes neuronales Netzwerk in EUS-Systeme integriert wird und unmittelbar während der Untersuchung („real-time“) die Bildanalyse unterstützen kann. Voraussetzungen dafür sind auch die Adhärenz der Endosonografiker an definierte Qualitätskriterien und vordefinierte Standardeinstellungen sowie die Standardisierung von Untersuchungsabläufen.22,23
Es ist jedoch bereits jetzt abzusehen, dass die Integration von KI in die endosonografische Diagnostik einen wertvollen Beitrag zur Standardisierung diagnostischer Kriterien und für die Ausbildung der Untersucher wird leisten können. Jedem einzelnen Anwender wird durch KI die weltweite und Generationen übergreifende kumulative Expertise aller Endosonografiker zugänglich und damit auch die bekannt hohe Untersucherabhängigkeit und Interobserver-Variabilität des Verfahrens 24 deutlich abnehmen.
Endosonografische Feinnadelbiopsie und personalisierte Therapie des PDAC
Paradigmenwechsel in der Therapie des resektablen Pankreaskarzinoms
Derzeit ist die deutsche S3-Leitlinie zum Pankreaskarzinom, die 2007 publiziert und 2013 überarbeitet wurde, in Überarbeitung. Sie stellt die Indikation zur präoperativen endosonografisch gestützten Feinnadelaspiration (EUS-FNA) eines potenziell resektablen soliden Pankreastumors sehr zurückhaltend nur für den Fall, dass „es differenzialdiagnostische Hinweise gibt, die das Vorgehen ändern würden, wie z.B. Metastasenverdacht bei einem anderen Malignom in der Vorgeschichte“. Anderenfalls wurde die primäre Resektion ohne vorherige feingewebliche Diagnose empfohlen.25 Auch im Falle einer kurativ intendierten und histologisch kompletten (R0) Resektion hat das lokal fortgeschrittene PDAC jedoch eine schlechte Prognose, nur wenige Patienten erreichen ein Langzeitüberleben. Bei etwa 20% aller Patienten kommt es bereits innerhalb des ersten halben Jahres zu einem Rezidiv, bei 40% innerhalb eines Jahres.26
In den letzten Jahren konnte jedoch gezeigt werden, dass nicht nur Patienten mit borderline-resektablem, sondern auch mit einem resektablen PDAC von einer neoadjuvanten Chemotherapie oder Radiochemotherapie signifikant profitieren.27 Da jedoch ein Teil der neoadjuvant behandelten PDAC unter dieser Therapie einen Progress aufweist, verringert sich die Resektionsrate nach neoadjuvanter Therapie im Vergleich zur primären Operation.28 In diesem Kontext vollzieht sich derzeit ein Paradigmenwechsel in der therapeutischen Strategie des PDAC, indem die bildgebende Resektabilitätsvoraussage zunehmend von dem Versuch begleitet wird, die spezifischen molekulargenetischen Eigenschaften des Tumors in die therapeutische Entscheidungsfindung einzubeziehen („molekulares Profiling“).29,30 Daraus kann sich eine Neubewertung des Stellenwerts der endosonografischen Feinnadelpunktion bei potenziell resektablem PDAC ergeben.31
Endosonografische Biopsie bei potenziell resektablem Pankreaskarzinom?
Die in der deutschen S3-Leitlinie25 ebenso wie in einem internationalen Positionspapier namhafter Pankreaschirurgen32 vertretene restriktive Positionierung bezüglich der präoperativen feingeweblichen Diagnosesicherung von auf ein PDAC verdächtigen soliden Pankreasraumforderungen ergab sich aus:
-
den bis vor wenigen Jahren fehlenden therapeutischen Konsequenzen einer präoperativen Diagnosesicherung,
-
dem nur moderaten negativen prädiktiven Wert (71%) der EUS-FNA33
-
und schließlich auch aus dem durch Einzelfallberichte belegten Risiko für Tumorzellverschleppung durch den Punktionsvorgang.34
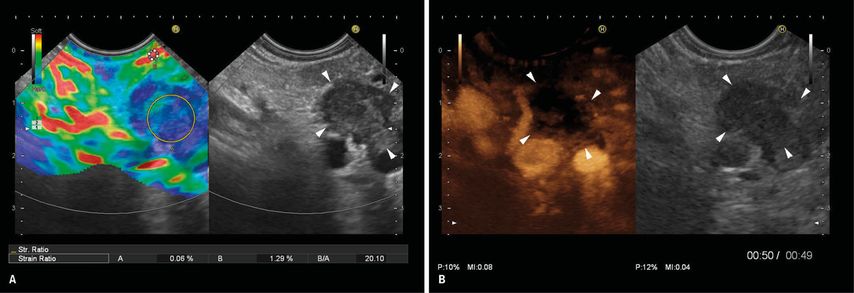
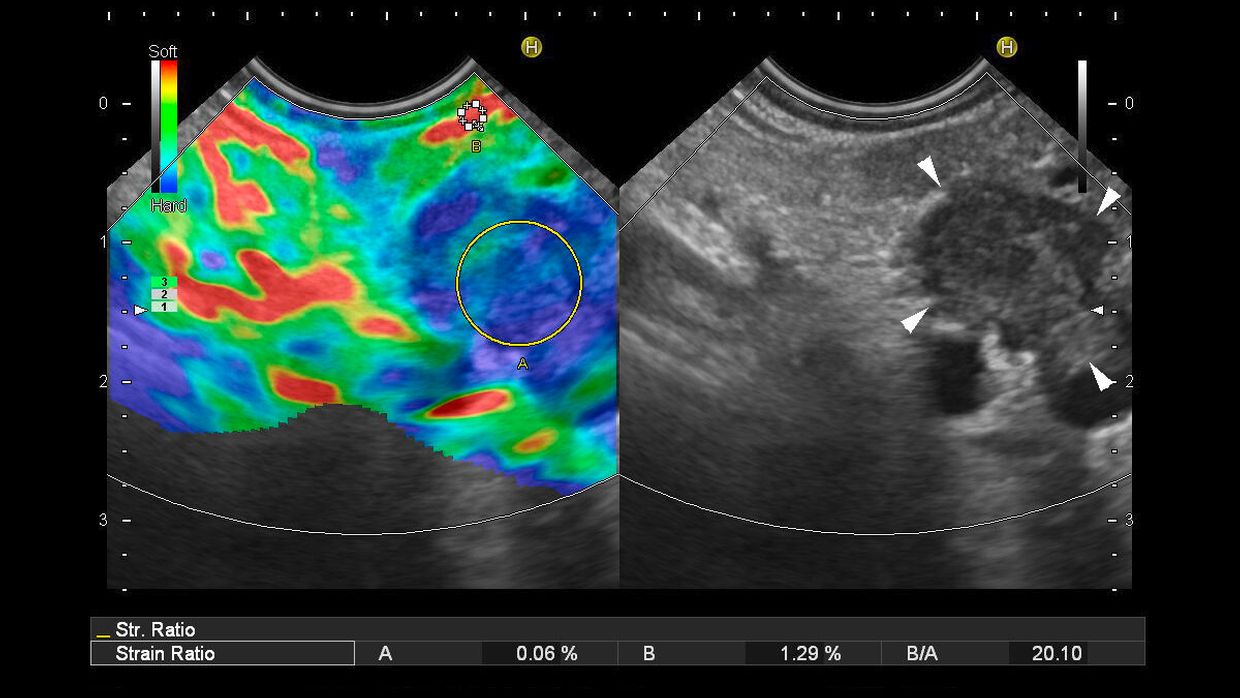
Zu allen drei Aspekten haben sich jedoch in den letzten Jahren neue Aspekte ergeben. Große chirurgische Kohortenstudien haben offenbart, dass bei 6,5–12,9% aller Patienten, die unter dem Verdacht auf ein PDAC einer Pankreaskopfresektion unterzogen werden, diese Diagnose postoperativ histologisch nicht bestätigt werden kann.35–38 Häufige Ursachen für präoperative Fehleinschätzungen sind die fokale Autoimmunpankreatitis, chronische Pankreatitis oder andere primäre oder sekundäre Pankreasneoplasien. Vor dem Hintergrund einer auch aktuell an Zentren noch bestehenden operativen Morbidität von 20–40% und Mortalität von 1–5%39 muss das Ziel sein, eine zuverlässigere präoperative Charakterisierung solider Pankreasraumforderungen zu erreichen, um ggf. zu einem radikalen onkologisch-chirurgischen Vorgehen alternative therapeutische Konzepte anbieten zu können. Darüber hinaus konnte gezeigt werden, dass unter den „kleinen“ soliden Pankreasraumforderungen (bis 15mm) alternative Diagnosen wie insbesondere neuroendokrine Tumoren und Pankreasmetastasen häufiger vertreten sind als das PDAC und diese Entitäten sowohl non-invasiv unter Einbeziehung des kontrastmittelverstärkten EUS und der EUS-Elastografie19,20 als auch durch EUS-FNA40 mit sehr hoher Sicherheit diagnostiziert werden können (Abb. 2).
Abb. 2: Karzinom des Pankreaskorpus: A) Der 15mm kleine Tumor ist im B-Bild (rechte Bildseite) echoarm und grenzt an die Milzgefäße. In der Strain-Elastographie (linke Bildseite) wird der Tumor (Konturen durch Pfeilspitzen hervorgehoben) durch blaue Farbkodierung als „hart“ klassifiziert, die Strain-Ratio als Vergleich zu „weichem“ Umgebungsgewebe (rot-gelb) ergibt ein Härteverhältnis von 20:1. B) Nach Injektion von Ultraschallkontrastmittel reichert der Tumor (Konturen durch Pfeilspitzen hervorgehoben) kaum Kontrastmittel an (rechte Bildseite). Das typische Verhalten des Tumors in der Elastographie und im kontrastverstärkten EUS erlaubt eine 90 % sichere Charakterisierung als duktales Adenokarzinom
Die Entwicklung von Feinnadeln mit speziellem Design hat darüber hinaus die endosonografische Gewinnung von Gewebezylindern ermöglicht (EUS-Feinnadelbiopsie, EUS-FNB), die bei im Vergleich zur EUS-FNA verbesserter Materialausbeute regelhaft histologische, immunhistochemische und molekularbiologische Untersuchungen erlauben.41 Und schließlich konnte in einer sehr großen Registeranalyse übezeugend dargestellt werden, dass die onkologische Prognose von Patienten mit PDAC durch präoperative endosonografische Feinnadelbiopsie nicht verschlechtert wird.42
Prädiktion des Ansprechens auf eine neoadjuvante Therapie des Pankreaskarzinoms anhand von endosonografischen Feinnadelpunktaten
Im Kontext der aktuellen Diskussion um die Indikationsstellung für eine neoadjuvante Therapie des potenziell resektablen PDAC verdienen aktuelle Untersuchungen zum Stellenwert von EUS-FNA und EUS-FNB für die Prädiktion des Ansprechens auf eine neoadjuvante Therapie großes Interesse.
Bereits 2018 konnten Tiriac et al. zeigen, dass durch Dissektion von mit EUS-FNB gewonnenen Gewebeproben aus PDAC in 87% der Fälle die Etablierung von Tumorzellorganoiden möglich ist, die sich ex vivo in einer Gelmatrix überwiegend (66%) als vermehrungsfähig erwiesen.43 Den Autoren gelang es, an diesen PDAC-Organoiden eine Chemosensitivitätstestung für fünf verschiedene Chemotherapeutika durchzuführen und die Heterogenität der Chemotherapie-Responsibilität aufzuzeigen.44 Eine japanische Autorengruppe konnte einen auf einem 10-Gen-Panel beruhenden Score validieren, mit dem für Patienten mit PDAC eine Prognosestratifizierung möglich war. In einer Teilkohorte von 56 Patienten wurde dieser Score genutzt, um an durch EUS-FNA gewonnenem Material aus PDAC das klinische Ansprechen auf eine neoadjuvante Radiochemotherapie (Gemcitabin und Radiotherapie mit 50–54Gy) vorauszusagen. Es wurden acht Responder und 48 Non-Responder identifiziert. Der Score hatte für diese Patientengruppe eine Sensitivität von 100% und eine Spezifität von 79,2%.45 Weitere Arbeiten haben zeigen können, dass mit der EUS-FNB die Ausbeute an molekularbiologisch untersuchbarem Material signifikant besser ist als mit der EUS-FNA.46 Diese und andere Arbeiten47 eröffnen eine völlig neue Perspektive der präoperativen Endosonografie und EUS-FNA/FNB von Patienten mit Verdacht auf resektable PDAC. Neben der bereits klinisch etablierten non-invasiven Charakterisierung durch multiparametrische Endosonografie und Resektabilitätseinschätzung könnte zukünftig die EUS-FNA/FNB nicht nur zur Diagnosesicherung, sondern darüber hinaus auch zu einem genomischen Profiling, zur Prognoseeinschätzung und zur Charakterisierung der individuellen Response auf neoadjuvante Therapiestrategien genutzt werden.31
Zusammenfassung und Ausblick
Neben den in dieser Übersicht nicht thematisierten bahnbrechenden Fortschritten des therapeutisch-interventionellen EUS5 verdienen aktuelle Entwicklungen des diagnostischen EUS Aufmerksamkeit, mit denen perspektivisch insbesondere bei Pankreaserkrankungen eine deutlich verbesserte prätherapeutische Charakterisierung und Therapieplanung ermöglicht werden kann. Der Einsatz von konvolutionalen neuralen Netzwerken hat das Potenzial, nach Etablierung klinisch praxistauglicher Applikationen Untersucherabhängigkeit und Interobserver-Variabilität der nichtinvasiven endosonografischen Differenzierung fokaler und diffuser Pankreaserkrankungen zu reduzieren und gleichzeitig die diagnostische Genauigkeit zu verbessern. Vielversprechende Ergebnisse zur Genotypisierung und Chemosensitivitätstestung an endosonografisch gewonnenem Material werden möglicherweise zu einer Neubewertung der Rolle der EUS-FNA/FNB beim potenziell resektablen PDAC beitragen, indem sie eine interessante Perspektive für die Personalisierung der neoadjuvanten Therapie des PDAC erschließen.
Literatur:
1 DiMagno EP et al.: N Engl J Med 1977; 297(14): 737-42 2 DiMagno EP et al.: Lancet 1980; 1(8169): 629-31 3 Strohm WD et al.: Endoscopy 1980; 12(5): 241-4 4 Vilman P et al.: Gastrointest Endosc 1992; 38(2): 172-3 5 Dietrich CF et al.: Curr Opin Gastroenterol 2021; accepted 6 Cao J-S et al.: World J Gastroenterol 2021; 27(16): 1664-90 7 Norton ID et al.: Gastrointest Endosc 2001; 54(5): 625-9 8 Das A et al.: Gastrointest Endosc 2008; 6: 861-7 9 Zhu M et al.: PloS One 2013; 8(5): e63820 10 Ozkan M et al.: Endosc Ultrasound 2016; 5(2): 101-7 11 Kanno A et al.: Diagnostics 2020; 10(12): 1005 12 Fujii-Lau LL, Levy MJ: Gastrointest Endosc Clin N Am 2017; 27(4): 643-55 13 Marya NB et al.: Gut 2020; doi: 10.1136/gutjnl-2020-322821. Online ahead of print 14 Minoda Y et al.: J Gastroenterol 2020; 55(12): 1119-26 15 Yang X et al.: Endoscopy 2021; doi: 10.1055/a-1476-8931. Online ahead of print 16 Kim YH et al.: J Clin Med 2020; 9(10): 3162 17 Lee MW et al.: Gastric Cancer 2019; 22(5): 980-7 18 Marya NB et al.: Gastrointest Endosc 2021; 93(5): 1121-30 19 Dietrich CF et al.: Gastrointest Endosc 2016; 84(6): 933-40 20 Ignee A et al.: Endoscopy 2018; 50(11): 1071-9 21 Cho MK et al.: Gut Liver 2018; 12(5): 591-6 22 Denzer U et al.: Z Gastroenterol 2015; 53(12): E1-227 23 Ku L et al.: Diagnostics 2021; 11(2): 242 24 Yamamiya A et al.: Diagnostics 2020; 10(11): 953 25 Adler G et al.: Z Gastroenterol 2007; 45(6): 487-523 26 Groot VP et al.: Ann Surg 2019; 269(6): 1154-62 27 Versteijne E et al.: Br J Surg 2018; 105(8): 946-58 28 Pan L et al.: World J Surg Oncol 2019; 18(1): 1 29 Salvia R et al.: Updates Surg 2020; 72(2): 321-4 30 Attiyeh MA et al.: J Surg Oncol 2021; 123(6): 1395-404 31 Bispo M et al.: GE Port J Gastroenterol 2021; 28: 111-20 32 Asbun HJ et al.: Surgery 2014; 155: 887-92 33 Jenssen C et al.: Ultraschall Med 2016; 37(2): E33-76 34 Gao R-Y et al.: World J Gastroenterol 2020; 26(4): 6182-94 35 Abraham SC et al.: Ann J Surg Pathol 2003; 17(1): 110-20 36 Kennedy T et al.: Am J Surg 2006;191(3):437-41 37 Gomes RM et al.: Langenbecks Arch Surg 2016; 401(2): 169-79 38 Gerritsen A et al.: Ann Surg Oncol 2014; 21(12): 3999-4006 39 Werner J, Büchler MW: Dtsc Med Wochenschr 2011; 136(36): 1807-10 40 Sugiura R et al.: Dig Dis Sci 2019; 64(7): 2006-13 41 Soltani AK, Krishnan K: J Am Soc Cytopathol 2020; 9(5): 389-95 42 Ngamruengphong S et al.: Gut 2015; 64(7): 1105-10 43 Tiriac H et al.: Gastrointest Endosc 2018; 87(6): 1474-80 44 Tiriac H et al.: Cancer Discov 2018; 8(9): 1112-29 45 Nishiwada S et al.: Int J Cancer 2020; 148(3): 769-79 46 Kandel P et al.: Endoscopy 2021; 53(4): 376-82 47 Iwasaki E et al.: Diagnostics 2021; 11(3): 469
Das könnte Sie auch interessieren:
HIV-Diagnostik: Die Unterstützung vonseiten der Dermatologie ist gefragt!
Etwa 40% der HIV-Erstdiagnosen in Österreich werden zu einem Zeitpunkt gestellt, zu welchem das Immunsystem der Patient:innen bereits stark beeinträchtigt ist.1 Solche späten Diagnosen ...
Vitiligo: mit Ausdauer und Kombinationstherapien zum Erfolg
Rasche Diagnosesicherung und Therapieeinleitung sind bei der Vitiligo essenziell, auch aufgrund der individuellen Belastungssituation vieler Patient:innen. Vier Therapieziele, die ...
Periphere Nervenscheidentumoren
Periphere Nervenscheidentumoren sind eine seltene, aber dennoch bedeutende Tumorentität, die das periphere Nervensystem betrifft. Sie können eine Vielzahl an Symptomen verursachen und ...