Mit Covid-19-Infektion assoziierte kardiovaskuläre Komplikationen
Das SARS-CoV-2-Virus verursacht in vielen Fällen nicht nur eine gefürchtete Viruspneumonie, sondern hat auch eine große Bedeutung für das kardiovaskuläre System. Einerseits sind es insbesondere jene Menschen, welche Risikofaktoren für die Ausbildung einer kardiovaskulären Erkrankung aufweisen, sowie Patienten mit bestehender Herzerkrankung, welche als besonders vulnerabel für eine SARS-CoV-2-Infektion eingestuft werden. Andererseits scheint das Virus bei einigen Patienten* ein breites Spektrum an myokardialen und vaskulären Komplikationen hervorzurufen. Die Palette reicht vom akuten Koronarsyndrom, oftmals ohne obstruktive KHK, über Arrhythmien, Kardiomyopathien bis hin zum kardiogenen Schock sowie thromboembolischen Komplikationen.
Keypoints
-
Kardiovaskuläre Komplikationen bei Covid-19-Patienten sind häufig und ein zusätzlicher unabhängiger Risikofaktor für ein schlechtes Outcome.
-
Beobachtet wurden Myokardinfarkte und andere Myokardschäden, fulminante Verlaufsformen viraler Myokarditiden und schwere thromboembolische Komplikationen.
-
Untersuchungsmethoden sind meist auf Klinik, Ananmeseerhebung und Bedside-Untersuchungen wie EKG, Echokardiografie und Gefäßultraschall eingeschränkt.
-
Tiefergehende Untersuchungen beschränkten sich auf Patienten mit STEMI-Bild im EKG sowie schwer kranke Patienten im kardiogenen Schock.
Seit den ersten Fallberichten aus der Stadt Wuhan in China im Dezember des Vorjahres ist die Krankheit Covid-19 (Coronavirus Disease 2019), ausgelöst durch das Severe Acute Respiratory Syndrome Coronavirus-2 (SARS-CoV-2), zu einer globalen Pandemie mit beinahe 3,5 Millionen Infizierten und fast 250000 Todesfällen Anfang Mai angewachsen.1 Die meisten Patienten klagen über Fieber, Krankheitsgefühl sowie Husten und Atemnot als Erstsymptome.2 In seltenen Fällen kann eine schwere Viruspneumonie auftreten, ebenso wird bei kritisch kranken Patienten oftmals ein Zytokinsturm, welcher zu einem Multiorganversagen führen kann, beobachtet.3
Acute Covid-19 Cardiovascular Syndrome (ACovCS)
Interessanterweise scheint dieses respiratorische Virus eine besonders große Bedeutung für das kardiovaskuläre System zu haben, sowohl in der Krankheitsentstehung, als auch im Rahmen schwerer Komplikationen. Eine Gruppe um Prof. Leslie Cooper hat diese kardiovaskulären Komplikationen als Acute Covid-19 Cardiovascular Syndrome (ACovCS) zusammengefasst.4 Oftmals treten diese kardiovaskulären Komplikationen als „second hit“ bei kritisch kranken Patienten auf, welche von pulmonaler Seite bereits auf dem Weg der Besserung waren. Neuerdings setzt sich jedoch mehr und mehr auch die Erkenntnis durch, dass sich viele Covid-19-Patienten oft bereits initial mit einem kardiovaskulären Leitsymptom präsentieren.
Veränderung der Charakteristika der ACS-Population
In diesem Zusammenhang ist es besonders interessant, dass sich knapp nach Ausrufung der Pandemie durch die World Health Organization (WHO) am 12. März 20205 und den damit einhergehenden zum Teil drastischen Maßnahmen im Sinne von Ausgangsbeschränkungen, Schließung von Restaurants und Geschäften sowie einer weitgehenden Verlagerung vieler beruflicher Tätigkeiten ins „home office“ die Charakteristika der ACS-Population dramatisch verändert haben. Die ersten Veränderungen waren im asiatischen Raum aufgrund der früheren Ausbreitung und Neuorganisation im medizinischen System bereits Ende Jänner zu bemerken. So kam es beispielsweise in Hongkong zu einem dramatischen Anstieg der Zeit von Symptombeginn bis zum ersten medizinischen Kontakt sowie der intrahospitalen Verzögerungen.6 Eine weitere Änderung, die in fast allen Herzkatheterlabors der Welt zu beobachten war, ist ein deutlicher Rückgang an ACS-Patienten, sowohl zu Patienten mit ST-Strecken-Hebungs-Infarkten (STEMI) als auch mit NSTEMI.7, 8 Auch in Österreich zeigte sich in einer ersten Analyse ein ähnliches Bild, hier zeigte sich Ende März ein Rückgang an ACS-Hospitalisierungen von 40% im Vergleich zur ersten März-Woche.9 In ihrer Beschreibung der französischen Daten stellte die Autorengruppe anstelle des Titels plakativ die Frage: „Where have the STEMIs gone during Covid-19 lockdown?“ Diese interessante Frage konnte bisher noch nicht klar beantwortet werden. Eine mögliche Erklärung könnte die Angst vor der Ansteckung im Krankenhaus darstellen, die Patienten davon abhält, den Rettungsdienst oder die Notaufnahme zu kontaktieren. Dies könnte insbesondere eine Erklärung für mildere NSTEMI-Formen darstellen, für hochsymptomatische STEMI-Patienten ist dies schwerer vorstellbar. Andere mögliche Erklärungen sind eine reduzierte Luftverschmutzung, eine Reduktion körperlicher Aktivität sowie psychischer und physischer Stressoren im Berufsleben. All diese Faktoren könnten einen kalmierenden Effekt auf das Endothel ausüben, sodass es zu weniger akuten Koronarsyndromen kommt. Da die NSTEMI-Beschwerdesymptomatik jener einer Covid-19-Infektion durchaus ähneln kann und auch laborchemisch Ähnlichkeiten bestehen, könnte auch dies zu einer verzögerten oder gar Fehldiagnose führen. Auch in der Lombardei, einer von SARS-CoV-2 am stärksten betroffenen Gegenden weltweit, konnte ein ähnliches Phänomen beobachtet werden. Auch hier kam es zu einer signifikanten Reduktion an NSTEMI- und STEMI-Fällen, bei Letzteren konnte in 40% der Fälle keine obstruktive KHK nachgewiesen werden.10, 11 Interessanterweise stellte in dieser Analyse der STEMI bei 85% der Patienten die Covid-19-Erstmanifestation dar. Gleichzeitig kam es allerdings zu einem mehr als 50%igen Anstieg an Herz-Kreislauf-Stillständen außerhalb des Krankenhauses, von denen rund drei Viertel (vermutlich) SARS-CoV-2 positiv waren.12
Ursache für Myokardschaden noch ungeklärt
In der Zusammenschau mit der zuvor beschriebenen niedrigen Rate an obstruktiver KHK bei STEMI-Patienten scheint es sich bei den beobachteten Myokardinfarkten eher um einen eventuell viral ausgelösten Myokardschaden zu handeln (Abb. 1).
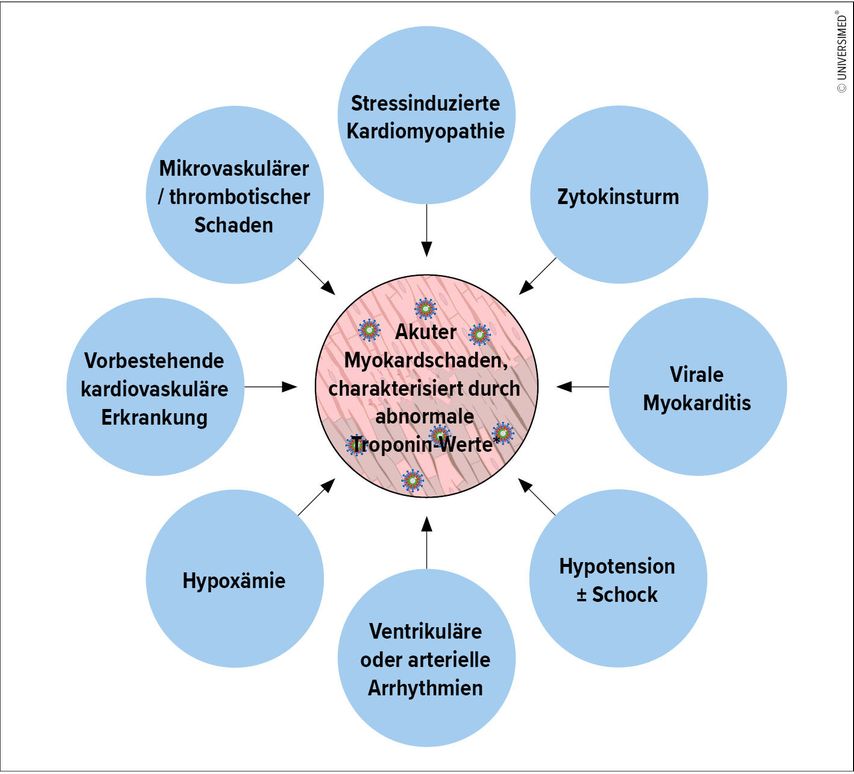
Abb. 1: Mögliche Mechanismen eines Myokardschadens bei akutem Covid-19-Herz-Kreislauf-Syndrom. Mehrere Mechanismen können zu einer nicht ischämischen Myokardverletzung bei Covid-19 führen. * Troponin-Wert >99. Perzentil der oberen Referenzwertes
Die Erfahrungen mit dem Middle Eastern Respiratory Syndrome (MERS), SARS sowie Non-SARS-Coronaviren zeigen, dass diese Viren durchaus imstande sind, eine klinisch manifeste Myokarditis auszulösen.13–15 Einige der in der Literatur publizierten Fälle weisen darauf hin, dass viele der als initial als Myokardinfarkt diagnostizierten Patienten in Wahrheit einen durch eine Myokarditis ausgelösten Myokardschaden aufweisen.16 Ein erheblicher Anteil insbesondere der kritisch kranken Covid-19-Patienten, welche einer Behandlung auf einer Intensivstation bedürfen, weist erhöhte Troponin-Werte im Sinne eines myokardialen Schadens auf, wie einige publizierte Fallserien zeigen. So wiesen zum Beispiel rund ein Drittel von 52 kritisch kranken Covid-19-Patienten in China eine signifikante Troponin-Erhöhung auf.17 Eine weitere, deutlich größere Analyse (n=416) konnte diese frühen Ergebnisse weitgehend bestätigen: So waren hier rund 20% der Patienten von einem myokardialen Schaden betroffen; diese Patienten waren älter, kränker und auch nach Adjustierung auf Alter und Komorbiditäten durch eine höhere Mortalität gekennzeichnet.18 Diese Mortalitätsassoziation konnte in einer weiteren Arbeit aus China bestätigt werden, hier wiesen 59% der Verstorbenen ein erhöhtes Troponin T auf, während nur 1% der Überlebenden Troponin-positiv waren.19 Ähnliche Daten wurden in Nordamerika festgestellt, so präsentierte sich rund ein Drittel der ersten Welle kritisch kranker Patienten in Washington State mit einer Kardiomyopathie.20
Die meisten Fallpräsentationen inkludieren Patienten mit klinisch apparenter Myokarditis ohne definitiven Nachweis mittels Pathologie, Histologie oder Bildgebung.16,21 Aus diesen Fallberichten und Fallserien ist daher nicht klar zu erheben, ob SARS-CoV-2 tatsächlich in das Myokard einwandern kann und dort direkten Schaden anrichtet oder ob der beobachtete Myokardschaden eine Nebenwirkung des Zytokinsturms ist, welcher für viele der schwer kranken Patienten charakteristisch ist.22 Zwei bisher publizierte Fallberichte versuchen hier ein wenig Licht ins Dunkel zu bringen, mit unterschiedlichen Ergebnissen. So zeigte die Histologie bei einer 43-jährigen Frau mit Covid-19-assoziiertem „reverse Tako-Tsubo syndrome“ diffuse T-lymphozytäre inflammatorische Infiltrate ohne Nachweis von SARS-Cov-2. Die finale Diagnose lautete daher „Covid-19-assoziierte, akute, Virus-negative lymphozytäre Myokarditis“. Ein eleganter Bericht aus Pavia, Italien, behandelt den Fall eines 69-jährigen Patienten mit Covid-19-assoziiertem kardiogenem Schock, der für einige Tage eine Kreislaufunterstützung mit einer venoarteriellen extrakorporalen Membran-Oxygenierung (VA-ECMO) benötigt hat.23 In diesem Fall jedoch ergab die Histologie den Befund einer Myokarditis mit nachgewiesenem Befall durch Viren, welche von der Morphologie und Größe als Coronaviren einzustufen waren. All diese publizierten Berichte legen nahe, dass die akute Myokarditis in vielen Fällen ursächlich für den beschriebenen Myokardschaden mit Troponin-Auslenkung verantwortlich ist. Wie bereits weiter oben angeführt, präsentieren sich viele Patienten, insbesondere jene mit schlechtem Outcome, mit der klinischen und laborchemischen Konstellation eines Zytokinsturms. Es bleibt daher letztlich unklar, ob eine virale Einwanderung in das Myokard oder doch eher die systemische Reaktion auf das Virus ursächlich für den beobachteten Myokardschaden verantwortlich ist (Abb. 1).
Rolle des Angiotensin-convertingEnzyme-2
Weshalb scheint SARS-CoV-2 so häufig myokardiale Komplikationen hervorzurufen? Das Virus verwendet das an der Oberfläche exprimierte Spike(S)-Protein, um an dem Angiotensin-convertingEnzyme-2 (ACE-2) der Wirtszelle zu binden. ACE-2 ist ein Enzym lokalisiert an der Zelloberfläche insbesondere von Typ-II-Alveolarzellen der Lunge. Interessanterweise weisen auch Myokardzellen einen signifikanten Anteil an ACE-2 auf, was möglicherweise die häufigen myokardialen Komplikationen erklärt.24, 25
Rhythmusstörungen
Eine weitere interessante kardiale Komplikation ausgelöst durch Covid-19 sind Rhythmusstörungen, welche ebenfalls selten das Leitsymptom bei Aufnahme darstellen können. So wurden sowohl maligne AV-Blockierungen26 als auch schwerwiegende ventrikuläre Rhythmusstörungen beschrieben.27 In mehr als der Hälfte der Fälle treten diese Rhythmusstörungen im Rahmen myokardialer Schädigung wie z.B. einer Myokarditis wie weiter oben beschrieben auf. Bei rund der Hälfte der Covid-19-Patienten mit Rhythmusstörungen kann jedoch kein Myokardschaden nachgewiesen werden. In diesem Fall könnten medikamentöse Therapieansätze wie zum Beispiel Chloroquin/Hydroxychloroquin, gewisse Antibiotikaklassen sowie experimentelle antivirale Therapien, welche allesamt QT-verlängernde Effekte aufweisen, eine wichtige Rolle spielen.27 Eine wichtige proarrhythmogene Rolle dürfte auch der starken Aktivierung des Immunsystems zugeschrieben werden. So konnte rezent gezeigt werden, dass inflammatorische Zytokine Einfluss auf das ventrikuläre Aktionspotenzial nehmen können und somit QT-verlängernde Effekte haben. Neben diesen direkten kardialen Effekten spielen auch Effekte einer systemischen inflammatorischen Aktivierung eine wichtige Rolle.28–30 Interessanterweise konnte gezeigt werden, dass Anti-Zytokin-Therapien in diesem Kontext antiarrhythmische Effekte bewirken.31
Thromboembolische Ereignisse
Eine weitere wichtige, häufige und gefährliche kardiovaskuläre Komplikation bei Covid-19-Patienten sind thromboembolischer Natur. Es konnte gezeigt werden, dass sowohl das venöse als auch das arterielle System betroffen sein kann, als Ursachen kommen eine überschießende Inflammation, eine Plättchenaktivierung, eine endotheliale Dysfunktion sowie eine Stase infrage.32 Bereits früh wurde erkannt, dass erhöhte D-Dimer-Werte als Zeichen der ablaufenden Fibrinolyse und somit als indirekter Biomarker für Thrombusformation Patienten mit einem schlechten und komplikationsträchtigen Verlauf identifizieren können.19, 33 In einer gepoolten Analyse von 4 Intensivstationen, welche insgesamt 150 Covid-19-Patienten behandelt haben, zeigte sich trotz prophylaktischer und teilweise sogar therapeutischer Antikoagulation eine hohe Rate thromboembolischer Komplikationen.34 Auffällig dabei war eine hohe Rate pulmonaler Embolien. Beinahe alle Patienten zeigten erhöhte D-Dimer-Werte, die meisten waren durch erhöhtes Von-Willebrand-Faktor-Antigen und -Aktivität sowie erhöhten Faktor VIII und einen positiven Lupus-Antikoagulans gekennzeichnet. Verglichen mit einem historischen ARDS-Kollektiv zeigte sich eine deutlich höhere Rate an thromboembolischen Komplikationen sowie ein deutlicher Unterschied in Koagulationsparametern.
Eine weitere Untersuchung aus der Lombardei konnte eine 22%ige Rate thromboembolischer Komplikationen unter prophylaktischer Antikoagulation mit „low molecular weight heparin“ (LMWH) nachweisen.35 Als Konklusion empfiehlt diese mit der Covid-19-Behandlung sehr erfahrene Gruppe ein Screening auf thromboembolische Komplikationen bei allen kritisch kranken Covid-19-Patienten. Ein Erklärungsversuch zur Pathophysiologie betrifft das Endothel, welches durch zirkulierende Bestandteile des Immunsystems wie z.B. Zytokine aktiviert werden kann und gemeinsam mit Thrombozyten und Leukozyten das Gerinnungssystem aktiviert.36 Thromboembolische Komplikationen scheinen jedoch über die klassische Beinvenenthrombose und Pulmonalembolie hinauszugehen. So scheinen einige Patienten schwere pulmonale Thrombosen zu entwickeln, welche dadurch die Oxygenierung erschweren, ein häufig beobachtetes Phänomen bei Covid-19-Pneumonien. Dies könnte auch erklären, weshalb Covid-19-Patienten häufig erhöhte D-Dimer-Werte aufweisen und diese stark prognostisch sind.37 Die Pathophysiologie scheint auch hier ein Zusammenspiel aus inflammatorischer Aktivierung sowie Endothel- und Plättchenaktivierung, welche zu Mikro- und Makrothromben in der pulmonalen Strombahn führen können, darzustellen.38 Ein hochkarätiges Panel internationaler Experten hat ein Guideline-Paper erstellt.32 Aufgrund mangelnder Evidenz wird allerdings lediglich eine prophylaktische Antikoagulation empfohlen, eine therapeutische Blutverdünnung als therapeutischer Ansatz wird jedoch nicht ausgeschlossen. Eine Gruppe aus den USA erwägt gar eine Lysetherapie in besonders schweren Fällen, dies sollte jedoch als experimenteller Ansatz eingestuft werden.39
Fazit
Kardiovaskuläre Komplikationen sindbei Covid-19-Patienten häufig und stellen einen zusätzlichen unabhängigen Risikofaktor für ein schlechtes Outcome dar. Das Spektrum reicht von Myokardinfarkt und Myokardschaden bis hin zu fulminanten Verlaufsformen viraler Myokarditis und schweren thromboembolischen Komplikationen. Die diagnostischen Möglichkeiten sind aufgrund der speziellen Konstellation aus instabilen Patienten, risikobehafteten Untersuchungen sowie dem Expositionsrisiko für Untersucher und der notwendigen Hygienemaßnahmen stark eingeschränkt. Siebeschränken sich daher auf Klinik, Anamneseerhebung und Bedside-Untersuchungen wie EKG, Echokardiografie und Gefäßultraschall. Eine Ausnahme stellen Patienten mit STEMI-Bild im EKG sowie schwer kranke Patienten im kardiogenen Schock dar.
Derzeit sind keine Therapieoptionen mit zufriedenstellender Evidenz verfügbar, daher sollten möglichst viele Patienten in randomisiert-kontrollierte Studien eingeschleust werden. Die Vorstellung möglicher Therapieoptionen ist nicht der Fokus dieses Artikels, die Datenlage ändert sich derzeit beinahe täglich. Ich möchte auf die aktuellen Richtlinien der europäischen Gesellschaft für Intensivmedizin und jener für Kardiologie verweisen.40, 41
*Bei Personenbezeichnungen wurde gemäß dem Usus des Journals die männliche Form verwendet. Es sind jedoch jeweils männliche und weibliche Personen gemeint.
Autor:
Priv.-Doz. Dr. Konstantin Krychtiuk, PhD
Universitätsklinik für Innere Medizin II
Klinische Abteilung für Kardiologe, MedUni Wien
Twitter: @krychtiukmd
E-Mail: konstantin.krychtiuk@meduniwien.ac.at
Literatur:
1 Coronavirus Resource Center. Johns Hopkins University. https://coronavirus.jhu.edu/, Zugriff 3. Mai 2020 2 Wang D et al.: Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA 2020; 323(11): 1061-9 3 Wu C et al.: Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med 2020; e200994 4 Hendren NS et al.: Description and Proposed Management of the Acute COVID-19Cardiovascular Syndrome. Circulation 2020; Apr 16. doi: 10.1161/CIRCULATIONAHA.120.0473495 World Health Organization Regional Office for Europe. WHO announces COVID-19 outbreak pandemic.http://www.euro.who.int/en/health-topics/health-emergencies/coronavirus-covid-19/news/ news/2020/3/who-announces-covid-19-outbreak-a-pandemic (Zugriff 2. Mai 2020) 6 Tam CF et al.: Impact of Coronavirus Disease 2019 (COVID-19) Outbreak on ST-Segment-Elevation Myocardial Infarction Care in Hong Kong, China. Circ Cardiovasc Qual Outcomes 2020; 13(4): e006631 7 Garcia S et al.: Reduction in ST-Segment Elevation Cardiac Catheterization Laboratory Activations in the United States during COVID-19 Pandemic. J Am Coll Cardiol 2020; S0735-1097(20)34913-5
8 Piccolo R et al.: Population Trends in Rates of Percutaneous Coronary Revascularization for Acute Coronary Syndromes Associated with the COVID-19 Outbreak. Circulation 2020 Apr 30. doi: 10.1161/CIRCULATIONAHA.120.047457 9 Metzler B et al.: Decline of acute coronary syndrome admissions in Austria since the outbreak of COVID-19: the pandemic response causes cardiac collateral damage. Eur Heart J 2020 Apr 16; ehaa314 10 De Filippo O et al.: Reduced Rate of Hospital Admissions for ACS during Covid-19 Outbreak in Northern Italy. N Engl J Med 2020 Apr 28. doi: 10.1056/NEJMc2009166 11 Stefanini GG et al.: ST-Elevation Myocardial Infarction in Patients with COVID-19: Clinical and Angiographic Outcomes. Circulation 2020 Apr 30. doi: 10.1161/CIRCULATIONAHA.120.047525 12 Baldi E et al.: Out-of-Hospital Cardiac Arrest during the Covid-19 Outbreak in Italy. N Engl J Med 2020 Apr 29. doi: 10.1056/NEJMc2010418 13 Alhogbani T: Acute myocarditis associated with novel middle east respiratory syndrome coronavirus. Ann of Saudi Med 2016; 36(1): 78-80 14 Chen J et al.: [Morphological study of severe acute respiratory syndrome (SARS)]. Zhonghua bing li xue za zhi = Chinese journal of pathology 2003; 32(6): 516-20 15 Riski H et al.: Carditis associated with coronavirus infection. Lancet 1980; 2(8185): 100-1 16 Inciardi RM et al.: Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol 2020 Mar 27. doi: 10.1001/jamacardio.2020.1096. 17 Yang X et al.: Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med 2020 Feb 24. doi: 10.1016/S2213-2600(20)30079-5 18 Shi S et al.: Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. JAMA Cardiol 2020; e200950 19 Zhou F et al.: Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395(10229): 1054-62 20 Arentz M et al.: Characteristics and Outcomes of 21 Critically Ill Patients With COVID-19 in Washington State. JAMA 2020; 323(16): 1612-4 21 Hu H et al.: Coronavirus fulminant myocarditis saved with glucocorticoid and human immunoglobulin. Eur Heart J 2020 Mar 16; ehaa190. doi: 10.1093/eurheartj/ehaa190 22 Mehta P et al.: COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395(10229): 1033-4 23 Tavazzi G et al.: Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail 2020 Apr 10. doi: 10.1002/ejhf.1828 24 Chen L et al.: The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res 2020; 116(6): 1097-100 25 Nicin L et al.: Cell type-specific expression of the putative SARS-CoV-2 receptor ACE2 in human hearts. Eur Heart J 2020 Apr 15; ehaa311 26 Azarkish M et al.: Transient complete heart block in a patient with critical COVID-19. Eur Heart J 2020 Apr 14; ehaa307 27 Lazzerini PE et al.: COVID-19, Arrhythmic Risk and Inflammation: Mind the Gap! Circulation 2020 28 Lazzerini PE et al.: Systemic inflammation and arrhythmic risk: lessons from rheumatoid arthritis. Eur Heart J 2017; 38(22): 1717-27
29 Lazzerini PE et al: Cardioimmunology of arrhythmias: the role of autoimmune and inflammatory cardiac channelopathies. Nat Rev Immunol 2019; 19(1): 63-4 30 Lazzerini PE et al.: Systemic inflammation as a novel QT-prolonging risk factor in patients with torsades de pointes. Heart 2017; 103(22): 1821-9 31 Lazzerini PE et al.: Antiarrhythmic potential of anticytokine therapy in rheumatoid arthritis: tocilizumab reduces corrected QT interval by controlling systemic inflammation. Arthritis Care & Research 2015; 67(3): 332-9 32 Bikdeli B et al.: COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-up. J Am Coll Cardiol 2020 Apr 15; S0735-1097(20)35008-7
33 Lippi G, Favaloro EJ. D-dimer is Associated with Severity of Coronavirus Disease 2019: A Pooled Analysis. Thromb Haemostasis 2020; 120(5): 876-8 34 Helms J et al.: High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med 2020 May 4. doi: 10.1007/s00134-020-06062-x 35 Tavazzi G et al.: Thrombotic events in SARS-CoV-2 patients: an urgent call for ultrasound screening. Intensive Care Med 2020 Apr 22;1-3. doi: 10.1007/s00134-020-06040-3 36 Frantzeskaki F et al.: Immunothrombosis in Acute Respiratory Distress Syndrome: Cross Talks between Inflammation and Coagulation. Respiration 2017; 93(3): 212-25 37 Marongiu F et al.: Pulmonary thrombosis in 2019-nCoV pneumonia? J Thromb Haemost 2020 Apr 15. doi: 10.1111/jth 38 Tomashefski JF Jr. et al.: The pulmonary vascular lesions of the adult respiratory distress syndrome. Am Journal of Pathol 1983; 112(1): 112-26
39 Barrett CD et al.: Fibrinolytic Therapy for Refractory COVID-19 Acute Respiratory Distress Syndrome: Scientific Rationale and Review. Research and Practice in Thrombosis and Haemostasis 2020; 28 April 2020: doi:10.1002/rth2.12357
40 Alhazzani W et al.: Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVID-19). Intensive Care Med 2020 Mar 28; 1-34. doi: 10.1007/s00134-020-06022-541 ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic: https://http://www.escardio.org/Education/COVID-19-and-Cardiology/ESC-COVID-19-Guidance
Das könnte Sie auch interessieren:
Nur eine von vielen Begleiterscheinungen
Warum er MRT-Veränderungen bei unspezifischen Rückenschmerzen wenig Bedeutung beimisst, erklärt Prof. Dr. med. Andreas Seekamp aus Kiel.
Modic Changes bei Rückenschmerzen
Obwohl die Erstbeschreibung fast 40 Jahre her ist, ist immer noch nicht klar, wodurch die MRT-Veränderungen entstehen und welchen Stellenwert sie für Diagnostik und Therapie haben.
Periphere Nervenscheidentumoren
Periphere Nervenscheidentumoren sind eine seltene, aber dennoch bedeutende Tumorentität, die das periphere Nervensystem betrifft. Sie können eine Vielzahl an Symptomen verursachen und ...